Valutazione delle proprietà fisico-chimiche di quattro sigillanti per canali radicolari
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo).
Abstract
Obiettivo: Valutare le proprietà fisico-chimiche e la morfologia superficiale di AH Plus, GuttaFlow, RoekoSeal e Activ GP sigillanti per canali radicolari.
Metodologia: Cinque campioni di ciascun materiale sono stati valutati per il tempo di indurimento, alterazione dimensionale, solubilità e test di radiopacità, secondo la specifica ANSI/ADA 57. Un totale di 50 mL di acqua distillata deionizzata dai test di solubilità è stato utilizzato per misurare la solubilità dei metalli mediante spettrometria di assorbimento atomico. Le morfologie della superficie esterna e della sezione trasversale dei campioni sono state analizzate mediante un microscopio elettronico a scansione (SEM). L'analisi statistica è stata eseguita utilizzando l'ANOVA unidirezionale e i test post hoc di Tukey–Kramer con l'ipotesi nulla impostata al 5%.
Risultati: AH Plus ha avuto il tempo di indurimento più lungo (580,6 ± 3,05 min) (P< 0,05). Activ GP non ha avuto un valore medio nei test di radiopacità e solubilità (1,31 ± 0,35 mm e 11,8 ± 0,43%, rispettivamente) in conformità con ANSI/ADA, risultando significativamente diverso dagli altri materiali (P< 0,05), che avevano valori medi per questi test in conformità con i requisiti dell'ADA. GuttaFlow è stato l'unico sigillante che ha rispettato la Specifica 57 riguardo al test di alterazione dimensionale (0,44 ± 0,16%) (P< 0,05). Il test di spettrometria ha rivelato un significativo rilascio di ioni Ca2+, K+, Zn2+ dal sigillante Activ GP (32,57 ± 5,0, 1,57 ± 0,22 e 8,20 ± 1,74 μg mL–1, rispettivamente). Nell'analisi SEM, la perdita di matrice era evidente e le particelle di riempimento erano più distinguibili in tutti i gruppi.
Conclusioni: Il tempo di impostazione di tutti i sigillanti era conforme ai requisiti ANSI/ADA. Activ GP non ha soddisfatto i protocolli ANSI/ADA riguardanti la radiopacità, la modifica dimensionale e la solubilità. Gutta-Flow è stato l'unico sigillante che ha rispettato la Specifica 57 in tutti i test. L'analisi SEM ha rivelato che le superfici di tutti i sigillanti presentavano cambiamenti micromorfologici dopo il test di solubilità.
Introduzione
Nella terapia endodontica, la completa sigillatura del sistema canalare dopo la pulizia e la modellazione è fondamentale per prevenire la colonizzazione e la reinfezione dei tessuti radicolari e periapicali da parte dei patogeni orali. Sebbene la guttaperca sia ancora il materiale di riempimento canalare più comunemente usato, sono state sviluppate diverse nuove tecniche e materiali con diverse proprietà fisico-chimiche (Ørstavik 2005, Versiani et al. 2006, Resende et al. 2009).
Durante le procedure di riempimento del canale, il sigillante endodontico svolge diverse funzioni, tra cui il riempimento di irregolarità delle pareti del canale radicolare come ramificazioni apicali e delta, così come spazi in cui la guttaperca non è stata in grado di adattarsi (Kontakiotis et al. 2007). Poiché i materiali di riempimento convenzionali non sigillano efficacemente lo spazio del canale radicolare, sono stati sviluppati nuovi sigillanti endodontici (Bouillaguet et al. 2008).
Sebbene AH Plus abbia una stabilità dimensionale adeguata a lungo termine, la sua capacità di sigillatura rimane controversa in parte perché AH Plus non si lega alla guttaperca (Ørstavik et al. 2001). RoekoSeal Automix (Coltène Whaledent, Langenau, Germania) è un sigillante contenente dimetilpolisilossano con dati limitati disponibili sulle sue proprietà fisico-chimiche (Gençoglu et al. 2003). Nonostante i promettenti dati clinici e di laboratorio riportati per il sigillante a base di silicone, RoekoSeal è stato testato in vari studi con risultati contraddittori (De-Deus et al. 2007). GuttaFlow (Coltène Whaledent, Alstätten, Svizzera) è un sigillante a base di polivinilsilossano ed è stato introdotto con l'intenzione di ridurre gli svantaggi delle tecniche di guttaperca calda (Eldeniz & Ørstavik 2009). È stato affermato che GuttaFlow potrebbe migliorare il sigillo grazie all'aumento della fluidità e al fatto che il materiale si espande leggermente durante l'indurimento (Bouillaguet et al. 2008, Eldeniz & Ørstavik 2009, Roggendorf et al. 2010).
Le applicazioni dentali dei sigillanti in vetroionomero sfruttano il loro legame con la dentina, il rilascio di fluoro, l'attività antimicrobica e la biocompatibilità (Ørstavik 2005). Tuttavia, alcuni test di laboratorio hanno indicato una propensione alla perdita e alla disintegrazione (Carvalho-Júnior et al. 2003, Schäfer & Zandbiglari 2003). Recentemente, il sistema di otturazione Activ GP Precision (Brasseler USA, Savannah, GA, USA) è stato commercializzato come un sistema monoblocco per il riempimento delle radici utilizzando coni di guttaperca convenzionali rivestiti in superficie con riempitivi in vetroionomero (Roggendorf et al. 2010). Il produttore afferma che il prodotto è superiore ai precedenti sistemi a base di vetroionomero in termini di caratteristiche di maneggevolezza, tempo di lavoro, radiopacità (Fransen et al. 2008) e sigillo, grazie all'aumentata fluidità e al fatto che il materiale si espande leggermente durante l'indurimento (Kontakiotis et al. 2007).
Sebbene siano stati proposti vari tipi di sigillanti endodontici come materiali di riempimento innovativi, il sigillante ideale per il canale radicolare deve ancora essere trovato (Ørstavik 1983, 2005, Ørstavik et al. 2001, Versiani et al. 2006, Resende et al. 2009). Pertanto, l'obiettivo di questo studio di laboratorio era confrontare il tempo di indurimento, la radiopacità, il cambiamento dimensionale e la solubilità dei sigillanti a base di silicone (GuttaFlow e RoekoSeal) e un sigillante a base di ionomero (Activ GP) con un sigillante a base di resina epossidica ben consolidato (AH Plus), secondo gli standard ANSI/ADA (2000).
Materiali e metodi
Il tempo di indurimento, la radiopacità, le variazioni dimensionali e la solubilità, dopo l'indurimento per AH Plus (gruppo I), GuttaFlow (gruppo II), RoekoSeal (gruppo III) e Activ GP (gruppo IV) sigillanti per canali radicolari sono stati misurati secondo gli standard ANSI/ADA (2000) per i materiali di sigillatura dei canali radicolari. I materiali testati (Tabella 1) sono stati manipolati secondo le istruzioni del produttore. Le analisi sono state eseguite da un singolo esaminatore che era cieco rispetto ai materiali sperimentali. Per standardizzare e omogeneizzare la quantità di materiale, 0,3 g di sigillante sono stati distribuiti su un pad di miscelazione e spatolati per 15 s per ciascun campione testato. Per i test fisico-chimici, è stata registrata la media aritmetica di cinque repliche per ciascun sigillante e considerata come il risultato del test.
Tempo di impostazione
Cinque anelli in gesso di Parigi, con un diametro interno di 10 mm e uno spessore di 2 mm, sono stati preparati. I bordi esterni degli stampi sono stati fissati con cera su una piastra di vetro (75 x 25 x 1 mm). Gli stampi sono stati quindi riempiti con il materiale e trasferiti in una camera con umidità relativa del 95% (RH) e una temperatura di 37 °C. Dopo 150 ± 10 s dall'inizio della miscelazione del sigillante, un ago di tipo Gilmore con una massa di 100 ± 0,5 g, avente un'estremità piatta di 2,0 ± 0,1 mm di diametro, è stato delicatamente abbassato verticalmente sulla superficie orizzontale di ciascun campione. La punta dell'ago è stata pulita e la misurazione è stata ripetuta fino a quando le indentazioni non sono state più visibili. Se i risultati differivano di oltre ±5%, il test è stato ripetuto.
Test di radiopacità
Cinque piastre acriliche (2,2 cm x 4,5 cm x 1 mm), contenenti quattro pozzetti di 1 mm di profondità e 5 mm di diametro, sono state preparate e posizionate su una piastra di vetro coperta da un foglio di cellophane. Ogni pozzetto è stato riempito con uno dei sigillanti, seguendo una sequenza in base al tempo di impostazione del materiale, dal più lungo al più corto, in modo che i campioni fossero pronti per la valutazione radiografica dopo l'impostazione finale di tutti i materiali. Per evitare la formazione di bolle, il sigillante appena miscelato è stato introdotto nei pozzetti utilizzando una siringa. Un'altra piastra di vetro coperta di cellophane è stata posizionata sopra fino a completa impostazione e qualsiasi eccesso di sigillante rimosso. Ogni piastra è stata mantenuta in un'incubatrice (37°C, 95% RH) per un periodo corrispondente a tre volte il tempo di impostazione.
Ciascuna delle lastre acriliche contenenti i sigillanti è stata posizionata, al momento dell'esposizione radiografica, accanto a un'altra lastra acrilica (1,3 cm x 4,5 cm x 1 mm), contenente un gradino in alluminio, realizzato in lega 1100, con uno spessore che varia da 1 a 10 mm, in passi uniformi di 1 mm ciascuno (Margraf Dental MFG Inc., Jenkintown, PA, USA). Questo set di lastre acriliche è stato posizionato di fronte a questa lastra di fosforo, accanto al gradino in alluminio, e è stata effettuata una radiografia digitale (sistema Digora™; Soredex Orion Corporation, Helsinki, Finlandia). Le immagini radiografiche sono state ottenute utilizzando la macchina a raggi X Spectro 70X (Dabi Atlante, Ribeirão Preto, SP, Brasile), a 70 kVp e 8 mA. La distanza oggetto-focale era di 30 cm e il tempo di esposizione era di 0,2 s. Le lastre di imaging esposte dei campioni di prova sono state immediatamente scansionate dopo l'esposizione (Scanner Digora™) e analizzate utilizzando il software Digora™ per Windows 5.1.
Cambiamento dimensionale
Cinque stampi in Teflon® (Politetrafluoroetilene, DuPont, HABIA, Knivsta, Svezia), preparati per la produzione di corpi di prova cilindrici alti 3,58 mm e con un diametro di 3 mm, sono stati posizionati su una lastra di vetro avvolta in un sottile foglio di cellophane. Gli stampi sono stati riempiti con un leggero eccesso di sigillanti freschi e un vetrino, anch'esso avvolto in cellophane, è stato premuto sulla superficie superiore dello stampo. Il gruppo assemblato è stato mantenuto saldamente unito con una morsa a forma di C e trasferito in un'incubatrice (37 °C, 95% RH) lasciato riposare per un periodo corrispondente a tre volte il tempo di indurimento. Dopo questo periodo, le estremità piatte degli stampi, contenenti i campioni, sono state levigate con carta vetrata umida a grana 600. I campioni sono stati rimossi dallo stampo, misurati con un calibro digitale, conservati in un contenitore da 50 mL contenente 2,24 mL di acqua distillata deionizzata e mantenuti in un'incubatrice (37 °C, 95% RH) per 30 giorni. Il campione è stato quindi rimosso dal contenitore, asciugato su carta assorbente e misurato nuovamente per la lunghezza. La percentuale delle alterazioni dimensionali è stata calcolata utilizzando la formula:
((L30 — L )/ L) x 100
dove L30 è la lunghezza del campione dopo 30 giorni di stoccaggio e L è la lunghezza iniziale del campione.
Solubilità
Uno stampo cilindrico in Teflon® spesso 1,5 mm e con un diametro interno di 7,75 mm è stato riempito con un sigillante appena mescolato. Lo stampo è stato sostenuto da una piastra di vetro più grande e coperto con un foglio di cellophane. Un filo di nylon impermeabile è stato posizionato all'interno del materiale e un'altra piastra di vetro, anch'essa coperta con pellicola di cellophane, è stata posizionata sopra lo stampo e premuta manualmente in modo che le piastre toccassero uniformemente l'intero stampo. L'assemblaggio è stato posto in un'incubatrice (37 °C, 95% RH) e lasciato riposare per un periodo corrispondente a tre volte il tempo di indurimento. Non appena i campioni sono stati rimossi dallo stampo, sono stati pesati tre volte ciascuno (HM-200, A & D Engineering, Inc., Bradford, MA, USA), e la lettura media è stata registrata. I campioni sono stati sospesi con un filo di nylon e posizionati due a due all'interno di un contenitore di plastica con un'ampia apertura contenente 7,5 mL di acqua distillata deionizzata, facendo attenzione a evitare qualsiasi contatto tra di loro e la superficie interna del contenitore. I contenitori sono stati sigillati e lasciati per 7 giorni in un'incubatrice (37 °C, 95% RH). Dopo questo periodo, i campioni sono stati rimossi dai contenitori, risciacquati con acqua distillata deionizzata, asciugati con carta assorbente e posti in un deumidificatore per 24 ore. Successivamente, sono stati pesati di nuovo. La perdita di peso di ciascun campione (massa iniziale meno massa finale), espressa come percentuale della massa originale (m% = mi – mf), è stata considerata come la solubilità del sigillante.
Un volume di 7,5 mL di acqua distillata da ciascun campione è stato versato in un crogiolo di porcellana pulito e asciutto. Ogni crogiolo è stato messo in un muffola e bruciato a 550 °C. La cenere è stata dissolta in 10 mL di acido nitrico concentrato (Merck KGaA, Darmstadt, Germania) utilizzando un bastoncino di vetro. Successivamente, i campioni sono stati messi in flask volumetrici da 50 mL e il volume è stato completato con acqua deionizzata ultrapura (MilliQ, Millipore, Billerica, MA, USA). Le soluzioni ottenute sono state spruzzate nell'assorbimento atomico spettrofotometro (Perkin Elmer, Überlingen, Germania) per verificare la presenza di ioni Ca2+, K+, Zn2+ e Ag+. La media aritmetica di tre replicati per ciascun campione è stata registrata e considerata come risultato, espressa in μg mL–1.
Esame al microscopio elettronico a scansione
Per l'esame al microscopio elettronico a scansione (SEM), stampi cilindrici in Teflon® (3 x 4 mm) sono stati riempiti con sigillanti appena mescolati. Gli stampi sono stati supportati da una piastra di vetro coperta con un foglio di cellophane e posti in una camera (37 °C, 95% RH) per un periodo corrispondente a tre volte il tempo di indurimento. Dopo di che, i campioni sono stati sezionati con una lama di bisturi chirurgico usa e getta numero 15, fissati su un supporto metallico (10 x 5 mm) e rivestiti con oro-palladio (Bal-Tec AG, Balzers, Germania) a 20 mA. Le morfologie della superficie esterna e della sezione trasversale dei campioni sono state analizzate qualitativamente sotto un SEM a emissione di campo (Jeol JSM 5410; Jeol Technic Co., Tokyo, Giappone) a una tensione di accelerazione di 15 kV, a una distanza di lavoro da 6 a 10 mm e a diverse ingrandimenti.
Analisi statistica
Cinque campioni di ciascun gruppo sono stati testati e le medie sono state confrontate statisticamente. Il test di Kolmogorov–Smirnov ha mostrato che i risultati erano coerenti con una curva di distribuzione normale, quindi è stata possibile un'analisi statistica parametrica (anova a una via e post hoc test di Tukey–Kramer), e l'ipotesi nulla è stata impostata al 5% (spss 17.0 per Windows; SPSS Inc., Chicago, IL, USA).
Risultati
Tempo di indurimento
La specifica ANSI/ADA (2000) richiede che il tempo di indurimento di un sigillante sia entro il 10% di quello dichiarato dai produttori. Secondo loro, i tempi di indurimento di AH Plus, RSA RoekoSeal e Gutta-Flow sono rispettivamente 480, 50 e 30 min. Al contrario, il produttore di Activ GP non fornisce queste informazioni e afferma solo che è stato formulato con un tempo di lavoro esteso di 15 minuti.
È stata osservata una differenza statisticamente significativa tra i gruppi AH Plus (580.6 ± 3.05 min), GuttaFlow (24.0 ± 2.0 min), RoekoSeal (40.0 ± 1.58 min) e Activ GP (15.2 ± 1.30 min) (P< 0.05). Tuttavia, i valori medi hanno mostrato accordo con la standardizzazione ANSI/ADA (Tabella 2).
Test di radiopacità
AH Plus (6.0 ± 0.12 mmAl), GuttaFlow (3.0 ± 0.04 mmAl) e RoekoSeal (4.17 ± 0.45 mmAl) avevano radiopacità superiore ai 3 mm di alluminio come raccomandato dalla specifica ANSI/ADA 57, mentre Activ GP (1.31 ± 0.35 mmAl) non soddisfaceva questo requisito. L'analisi statistica ha dimostrato una differenza tra i gruppi sperimentali (P < 0.05) (Tabella 2).
Cambiamento dimensionale
La standardizzazione ANSI/ADA (2000) stabilisce che la contrazione lineare media del sigillante non deve superare l'1% o lo 0,1% in espansione. Ad eccezione di GuttaFlow (0,44 ± 0,16%), nessun sigillante ha rispettato la Specifica 57 (ANSI/ADA 2000). Tutti i gruppi hanno mostrato espansione post-impostazione, ad eccezione di RoekoSeal che ha mostrato contrazione all'impostazione (-1,33 ± 0,12%). L'analisi statistica ha rivelato una differenza significativa tra i gruppi sperimentali (P < 0,05) (Tabella 2).
Solubilità
La Specifica 57 ANSI/ADA (2000) stabilisce che un sigillante per canali radicolari non deve superare il 3% in massa quando viene testata la solubilità del materiale indurito. Ad eccezione di Activ GP (11,8 ± 0,43%), tutti i sigillanti hanno rispettato la standardizzazione ANSI/ADA (P < 0,05) (Tabella 2). L'acqua distillata deionizzata utilizzata per il test di solubilità e sottoposta a spettrometria di assorbimento atomico ha mostrato un livello significativo di rilascio di ioni Ca2+, K+ e Zn2+ nel gruppo Activ GP rispetto ad AH Plus, Gutta-Flow e RoekoSeal (P < 0,05). Livelli significativi di rilascio di Ag+ non sono stati osservati in nessun gruppo (Tabella 3).

Esame SEM
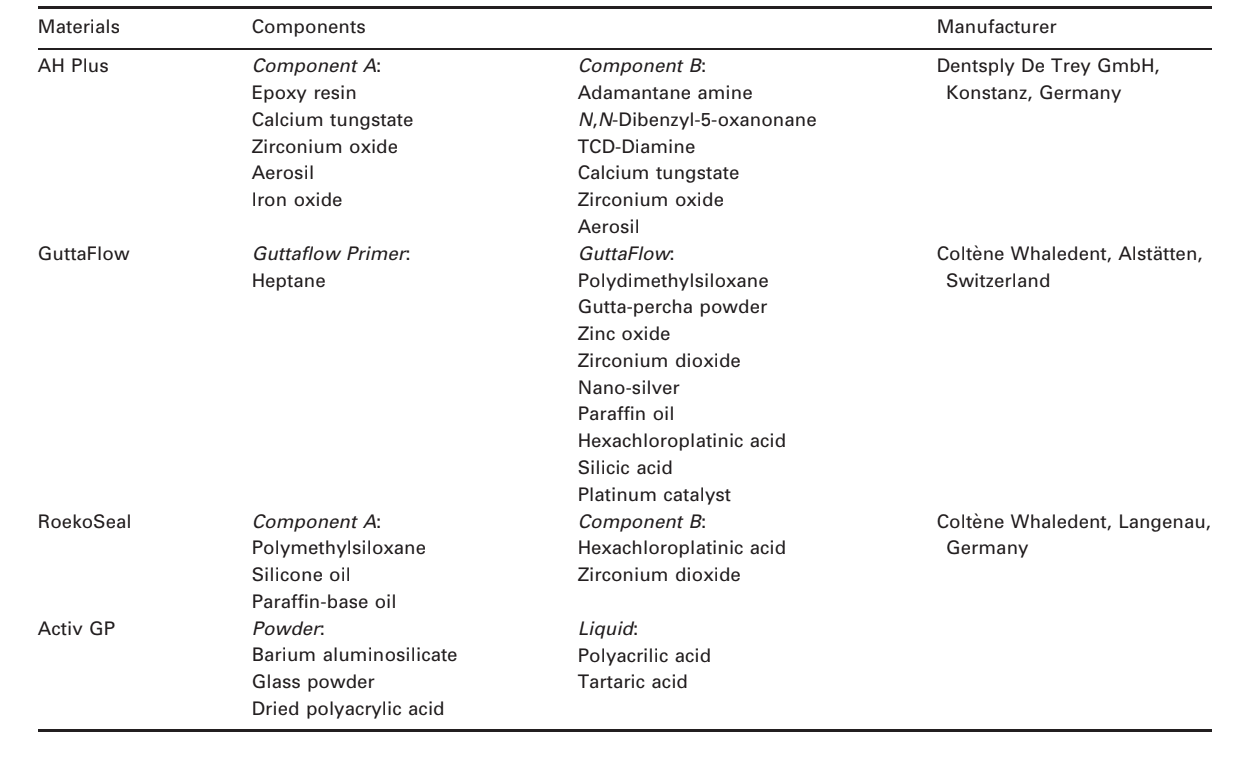
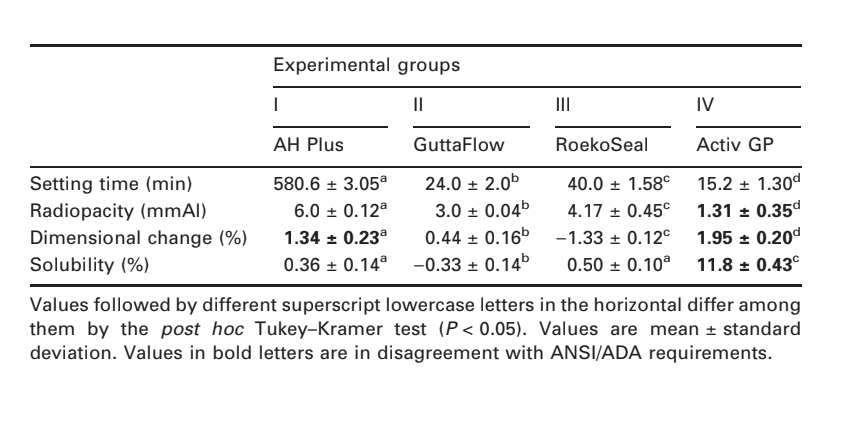
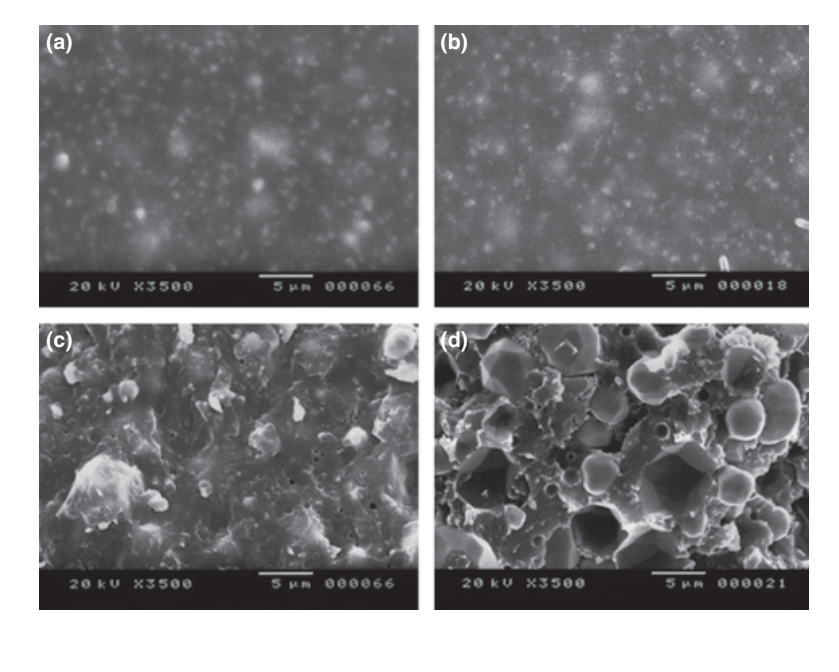
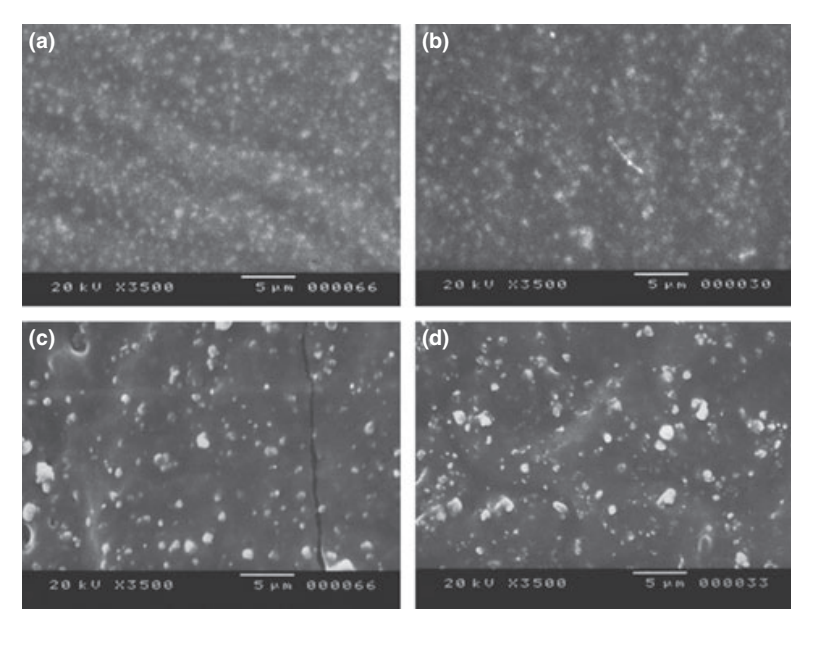
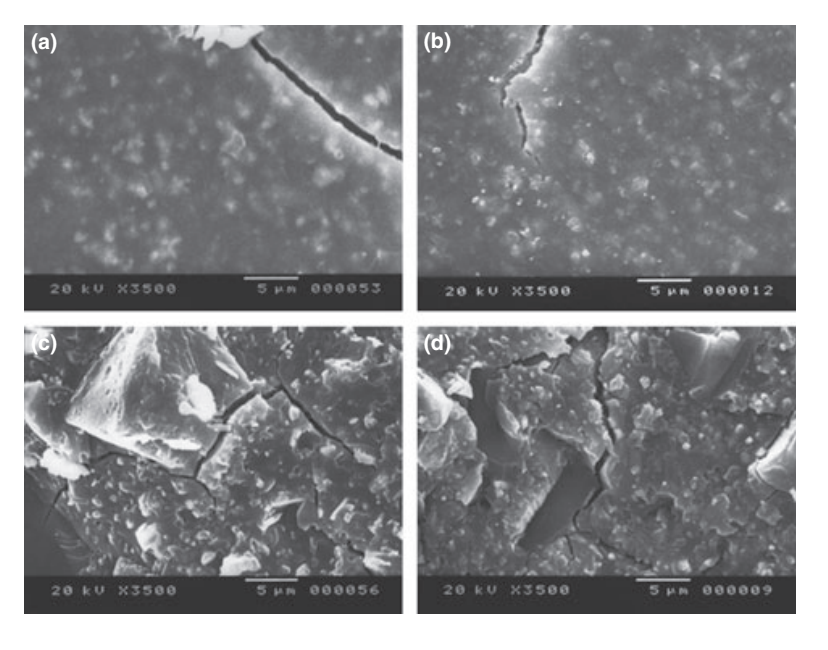
Fotomicrografie selezionate dei campioni polimerizzati ottenuti prima e dopo la conservazione in acqua per 7 giorni sono presentate nelle Fig. 1–4. Complessivamente, è stato notato che tutte le superfici avevano cambiamenti micromorfologici dopo il test di solubilità. La perdita della matrice era evidente e le particelle di riempimento erano più distinguibili. I gruppi AH Plus (Fig. 1a,b), GuttaFlow (Fig. 2a,b) e RoekoSeal (Fig. 3a,b) avevano una superficie esterna che appariva per lo più come superfici ruvide omogenee che diminuivano in ruvidità dopo il test di solubilità con un successivo irruvidimento della superficie. Non sono state osservate crepe nei campioni, ad eccezione del gruppo Activ GP. La superficie dei campioni Activ GP era relativamente più ruvida rispetto agli altri gruppi e il materiale superficiale appariva più danneggiato dopo il test di solubilità (Fig. 4a,b).
La microscopia elettronica a scansione della superficie della sezione trasversale dei campioni ha rivelato la presenza di polimeri a forma di sfera di diverse dimensioni, che erano distribuiti in modo non omogeneo. Dopo il test di solubilità, la superficie interna dei campioni di AH Plus (Fig. 1c,d), GuttaFlow (Fig. 2c,d) e Activ GP (Fig. 4c,d) è apparsa molto più irregolare e ruvida. Sono state osservate diverse micro-fessure alle interfacce matrice polimerica-riempitivo nel gruppo Activ GP prima e dopo il test di solubilità (Fig. 4c,d). D'altra parte, il gruppo RoekoSeal presentava uno strato più uniforme e compatto composto da polimeri a forma di sfera con una maggiore quantità di matrice resinosa (Fig. 3c,d).

Discussione
Il tempo di impostazione è principalmente un test di controllo sul comportamento stabile di un prodotto ed è dipendente dai componenti costitutivi, dalla loro dimensione delle particelle, dalla temperatura ambiente e dall'umidità relativa (Ørstavik 1983, 2005, Ørstavik et al. 2001). Nello studio attuale, tutti i risultati erano in conformità con la specifica ANSI/ADA. Il tempo di impostazione più lungo di AH Plus potrebbe essere spiegato dal fatto che questo sigillante è un materiale in pasta a due componenti basato su una reazione di polimerizzazione lenta di ammine di resina epossidica ad alto peso molecolare (Bisfenolo A e Bisfenolo F), dove la conversione dei monomeri in polimeri avviene gradualmente (Lin-Gibson et al. 2006, Resende et al. 2009). Questi risultati erano in accordo con ricerche precedenti (Versiani et al. 2006, Resende et al. 2009), tuttavia, Garrido et al. (2010) ha riportato un tempo di impostazione di 13 h per AH Plus, che è superiore alla variazione del 10% consentita dalla Specifica Numero 57 dell'ADA.
Gli standard ANSI/ADA (2000) per la radiodensità dei materiali di sigillatura dei canali radicolari sono stati determinati utilizzando film dentali convenzionali dove le immagini radiografiche sono ottenute tramite il processo chimico (Taşdemir et al. 2008). Tuttavia, la radiografia digitale sta diventando sempre più comune nello studio dei sigillanti endodontici (Baksi Akdeniz et al. 2007, Carvalho-Júnior et al. 2007a, Rasimick et al. 2007, Taşdemir et al. 2008). Pertanto, nello studio attuale sono state acquisite immagini digitali dei materiali di riempimento radicolare e dei passaggi di un cuneo a gradini in alluminio utilizzando un sistema a piastra fosforica e un sistema digitale di scansione, acquisizione e lettura.
Un'analisi della composizione dei materiali testati ha rivelato che tutti contengono agenti radiopacizzanti (Tabella 1), ad eccezione del sigillante Activ GP. Secondo Tanomaru-Filho et al. (2008), la presenza di polvere di vetro di alluminosilicato di bario nella sua composizione non fornisce una radiopacità soddisfacente. AH Plus contiene ossido di zirconio, ossido di ferro e tugstate di calcio come radiopacizzanti (Tanomaru-Filho et al. 2007) e ha avuto il valore medio di radiopacità più alto (6.0 ± 0.12 mmAl), come riportato in precedenza (Tagger & Katz 2003, Carvalho-Júnior et al. 2007a, Tanomaru-Filho et al. 2007, Taşdemir et al. 2008). Il sigillante RoekoSeal contiene biossido di zirconio come radiopacizzante (Baksi Akdeniz et al. 2007) e il risultato presente (4.17 ± 0.45 mmAl) era in accordo con i risultati precedenti che mostrano la sua radiopacità compresa tra 4.0 e 5.7 (Tagger & Katz 2003, Gambarini et al. 2006, Tanomaru-Filho et al. 2007, Rasimick et al. 2007). La radiopacità inferiore di GuttaFlow (3.0 ± 0.04 mmAl) rispetto a RoekoSeal è stata osservata anche in studi precedenti (Tagger & Katz 2003, Gambarini et al. 2006, Rasimick et al. 2007, Tanomaru-Filho et al. 2007). Poiché il produttore non fornisce il tipo chimico e la concentrazione di nano-argento in GuttaFlow, è evidente che queste particelle non hanno esercitato una caratteristica radiopaca. L'alta solubilità dei sigillanti per canali radicolari è indesiderabile perché la dissoluzione può causare il rilascio di materiali che potrebbero irritare i tessuti periapicali e potrebbe anche consentire la formazione di spazi tra i canali radicolari e i materiali di riempimento, aumentando probabilmente la perdita batterica nel tempo (Donnelly et al. 2007). Nonostante le raccomandazioni ANSI/ADA, nello studio presente è stata utilizzata una modifica precedentemente proposta per entrambi i test, che ha ottenuto risultati simili con una diminuzione del volume di materiale necessario per la produzione dei campioni di test (Carvalho-Júnior et al. 2007b). Nel presente studio, AH Plus si è espanso nel test di cambiamento dimensionale. L'acquisizione lenta di massa nel tempo è stata principalmente dovuta all'energia di interazione tra l'acqua e i siti di adsorbimento per il sistema (cioè un gruppo idrossile, un gruppo amminico, l'estremità della catena polimerica, ecc.), riempiendo gli spazi tra le catene polimeriche (McDermott 1993). Possibilmente, questa espansione ha compensato la contrazione subita dal sigillante a base di resina dopo la polimerizzazione (Phillips & Skinner 1991, Carvalho-Júnior et al. 2007b, Resende et al. 2009, Garrido et al. 2010).
La polimerizzazione dell'AH Plus avviene attraverso i monomeri di poliammine nella sua composizione (1-amantano ammina, N,N’-dibenzil-5-ossanonandi-ammina-1,9, TCD-Diamina). Quando i composti diepossidi e la pasta di poliammine vengono mescolati insieme, i gruppi amminici reagiscono con i gruppi epossidici per formare un legame covalente. L'utilizzo di gruppi amminici ciclici alifatici promuove modifiche nel tasso di indurimento, nella densità di reticolazione e nella morfologia delle resine epossidiche. Ogni gruppo NH può reagire con un gruppo epossidico, in modo che il polimero risultante sia fortemente reticolato, e quindi rigido e resistente (McDermott 1993, Case et al. 2005). Questo può spiegare la superficie ruvida omogenea e compatta rivelata nell'analisi SEM e i risultati di bassa solubilità dell'AH Plus nello studio attuale. Schäfer & Zandbiglari (2003) hanno anche misurato la solubilità delle resine epossidiche (AH Plus, AH 26), a base di silicone (RoekoSeal), idrossido di calcio (Apexit, Sealapex), ossido di zinco-eugenolo (Aptal-Harz) e a base di vetro ionomerico (Ketac Endo) nei confronti dell'acqua e della saliva artificiale. Secondo questi autori, l'AH Plus ha avuto la minore perdita di peso di tutti i sigillanti testati, indipendentemente dal mezzo di solubilità utilizzato.
I risultati precedenti hanno mostrato che i sigillanti a base di polidimetilsilossano si espandono leggermente durante l'indurimento e presentano una minima assorbimento d'acqua e solubilità (Donnelly et al. 2007, Monticelli et al. 2007). In accordo con questa affermazione, nello studio attuale i sigillanti GuttaFlow e RoekoSeal avevano una bassa solubilità con un minimo rilascio di ioni metallici. Considerando il test di cambiamento dimensionale, GuttaFlow è stato l'unico sigillante che ha rispettato la Specifica 57 (ANSI/ADA 2000), subendo un'espansione di circa lo 0,44%. Lo stesso non è stato osservato con il suo predecessore, RoekoSeal, che ha dimostrato una contrazione (1,33%). Al contrario, questo risultato non era in accordo con Ørstavik et al. (2001) che riportò che Roeko-Seal aveva una piccola espansione di circa lo 0,2% entro 4 settimane, ed era stabile successivamente.
La presenza di gutta-percha e particelle di nano-argento nel sigillante GuttaFlow conferisce una migliore stabilità alla matrice polimerica grazie alla forza di attrazione tra gli atomi di argento e le molecole di gutta-percha nel reticolo polimerico (Malynych et al. 2001). Queste interazioni possono spiegare il basso rilascio di ioni d'argento di GuttaFlow osservato nella spettroscopia di assorbimento atomico. Inoltre, la presenza di gutta-percha nel reticolo polimerico di GuttaFlow ha portato a una maggiore adsorbimento d'acqua rispetto a RoekoSeal (Gong et al. 2008), spiegando le differenze nei risultati del test di cambiamento dimensionale e lo strato più uniforme e compatto osservato sulla superficie di RoekoSeal sotto SEM.
I risultati più elevati di solubilità e cambiamento dimensionale del sigillante Activ GP possono essere correlati alla metodologia dell'ANSI/ADA che raccomanda di immergere un campione in acqua dopo un periodo di tre volte il tempo di indurimento del materiale. Secondo Wilson & McLean (1988), il tempo di indurimento del cemento ionomerico si completa solo 24 ore dopo la miscelazione. Durante il tempo di maturazione dei cementi vetroionomerici, la presenza di umidità può causare la dissoluzione di anioni e cationi che formano la matrice per le aree circostanti il cemento (Monticelli et al. 2007). Questa dissoluzione degli ioni non consente all'acqua, che fa parte della composizione del cemento, di idratare la matrice (Ca2+ e Al3+ formano polisali con gruppi di COO- di acido poliacrilico), rendendola instabile (Carvalho-Júnior et al. 2003, Schäfer & Zandbiglari 2003, Donnelly et al. 2007). Questo potrebbe spiegare la superficie più ruvida osservata in SEM e il significativo livello di rilascio di ioni calcio, potassio e zinco di Activ GP nello studio attuale. Poiché le strutture dei cementi vetroionomerici sono probabilmente influenzate dalla presenza o assenza di acqua, sono sensibili alla disidratazione nelle fasi iniziali del processo di indurimento (Wilson & McLean 1988). Per la valutazione SEM, la disidratazione del campione è un processo essenziale, che potrebbe spiegare le microfessure osservate sulla superficie dei campioni di Activ GP. Pertanto, i risultati ottenuti con Activ GP nello studio attuale dovrebbero essere interpretati con cautela.
Conclusioni
Il tempo di impostazione di tutti i sigillanti era conforme ai requisiti dell'ANSI/ADA. Activ GP non ha soddisfatto i protocolli dell'ANSI/ADA riguardo alla radiopacità, alterazione dimensionale e solubilità. GuttaFlow è stato l'unico sigillante che ha rispettato la Specifica 57 in tutti i test. L'analisi SEM ha rivelato che le superfici di tutti i sigillanti presentavano cambiamenti micromorfologici dopo il test di solubilità.
Autori: D. S. H. Flores, F. J. A. Rached-Júnior, M. A. Versiani, D. F. C. Guedes, M. D. Sousa-Neto, J. D. Pécora
Riferimenti:
- ANSI/ADA (2000) Specificazione n° 57 Materiale di Sigillatura Endodontica. Chicago, USA: ADA Publishing.
- Baksi Akdeniz BG, Eyuboglu TF, Sen BH, Erdilek N (2007) L'effetto di tre diversi sigillanti sulla radiopacità delle otturazioni radicolari in canali simulati. Chirurgia Orale Medicina Orale Patologia Orale Radiologia e Endodonzia 103, 138–41.
- Bouillaguet S, Shaw L, Barthelemy J, Krejci I, Wataha JC (2008) Capacità di sigillatura a lungo termine di Pulp Canal Sealer, AH-Plus, GuttaFlow ed Epiphany. International Endodontic Journal 41, 219–26.
- Carvalho-Júnior JR, Guimarães LF, Correr-Sobrinho L, Pécora JD, Sousa-Neto MD (2003) Valutazione della solubilità, disintegrazione e alterazioni dimensionali di un sigillante per canali radicolari a base di vetroionomero. Brazilian Dental Journal 14, 114–8.
- Carvalho-Júnior JR, Correr-Sobrinho L, Correr AB, Sinhoreti MA, Consani S, Sousa-Neto MD (2007a) Radiopacità dei materiali di otturazione radicolare utilizzando radiografia digitale. International Endodontic Journal 40, 514–20.
- Carvalho-Júnior JR, Correr-Sobrinho L, Correr AB, Sinhoreti MA, Consani S, Sousa-Neto MD (2007b) Solubilità e cambiamento dimensionale dopo l'impostazione dei sigillanti per canali radicolari: una proposta per dimensioni più piccole dei campioni di test. Journal of Endodontics 33, 1110–6.
- Case SL, O’Brien EP, Ward TC (2005) Profili di polimerizzazione, densità di reticolazione, tensioni residue e adesione in un modello di epossidico. Polimero 46, 10831–40.
- De-Deus G, Brandão MC, Fidel RA, Fidel SR (2007) La capacità di sigillatura di GuttaFlow in canali di forma ovale: uno studio ex vivo utilizzando un modello di perdita polimicrobica. International Endodontic Journal 40, 794–9.
- Donnelly A, Sword J, Nishitani Y et al. (2007) Assorbimento d'acqua e solubilità dei sigillanti per canali radicolari a base di resina metacrilica. Journal of Endodontics 33, 990–4.
- Eldeniz AU, Ørstavik D (2009) Una valutazione di laboratorio della perdita batterica coronale in canali radicolari riempiti con sigillanti nuovi e convenzionali. International Endodontic Journal 42, 303–12.
- Fransen JN, He J, Glickman GN, Rios A, Shulman JD, Honeyman A (2008) Valutazione comparativa del sigillante ActiV GP/Vetroionomero, Resilon/Epiphany e Gutta-Percha/AH Plus: uno studio di perdita batterica. Journal of Endodontics 34, 725–7.
- Gambarini G, Testarelli L, Pongione G, Gerosa R, Gagliani M (2006) Proprietà radiografiche e reologiche di un nuovo sigillante endodontico. Australian Endodontic Journal 32, 31–4.
- Garrido ADB, Lia RCC, França EC, da Silva JF, Astolfi-FIlho S, Sousa-Neto MD (2010) Valutazione di laboratorio delle proprietà fisico-chimiche di un nuovo sigillante per canali radicolari a base di Copaifera multijuga olio-resina. International Endodontic Journal 43, 283–91.
- Gençoglu N, Türkmen C, Ahiskali R (2003) Un nuovo sigillante per canali radicolari a base di silicone (Roekoseal-Automix). Journal of Oral Rehabilitation 30, 753–7.
- Gong W, Zeng K, Wang L, Zheng S (2008) Polimero alternato di blocco di polidimetilsilossano e polietere idrossilico di bisfenolo A e le sue miscele nanostrutturate con resina epossidica. Polimero 49, 3318–26.
- Kontakiotis EG, Tzanetakis GN, Loizides AL (2007) Uno studio comparativo degli angoli di contatto di quattro diversi sigillanti per canali radicolari. Journal of Endodontics 33, 299–302.
- Lin-Gibson S, Landis FA, Drzal PL (2006) Indagine combinatoria della caratterizzazione struttura-proprietà di reti di dimetacrilato fotopolimerizzate. Biomateriali 27, 1711–7.
- Malynych S, Robuck H, Chumanov G (2001) Fabbricazione di assemblaggi bidimensionali di nanoparticelle d'argento e nano-cavità in resina di polidimetilsilossano. Nano Letters 1, 647–9.
- McDermott J (1993) La Struttura dell'Industria dei Compositi Avanzati: Advance Composites Bluebook. Cleveland: Advanstar Communications.
- Monticelli F, Sword J, Martin RL et al. (2007) Proprietà di sigillatura di due sistemi di otturazione a cono singolo contemporanei. International Endodontic Journal 40, 374–85.
- Ørstavik D (1983) Proprietà fisiche dei sigillanti per canali radicolari: misurazione del flusso, tempo di lavoro e resistenza alla compressione. International Endodontic Journal 16, 99–107.
- Ørstavik D (2005) Materiali utilizzati per l'otturazione dei canali radicolari: test tecnici, biologici e clinici. Endodontic Topics 12, 25–38.
- Ørstavik D, Nordahl I, Tibballs JE (2001) Cambiamento dimensionale dopo l'impostazione dei materiali sigillanti per canali radicolari. Dental Materials 17, 512–9.
- Phillips RW, Skinner EW (1991) La Scienza dei Materiali Dentali di Skinner, 9a ed. Philadelphia: Saunders.
- Rasimick BJ, Shah RP, Musikant BL, Deutsch AS (2007) Radiopacità dei materiali endodontici su pellicola e un sensore digitale. Journal of Endodontics 33, 1098–101.
- Resende LM, Rached-Junior FJ, Versiani MA et al. (2009) Uno studio comparativo delle proprietà fisico-chimiche dei sigillanti per canali radicolari AH Plus, Epiphany ed Epiphany SE. International Endodontic Journal 42, 785–93.
- Roggendorf MJ, Legner M, Ebert J, Fillery E, Frankenberger R, Friedman S (2010) Valutazione micro-CT del materiale residuo in canali riempiti con Activ GP o GuttaFlow dopo rimozione con strumenti NiTi. International Endodontic Journal 43, 200–9.
- Schäfer E, Zandbiglari T (2003) Solubilità dei sigillanti per canali radicolari in acqua e saliva artificiale. International Endodontic Journal 36, 660–9.
- Tagger M, Katz A (2003) Radiopacità dei sigillanti endodontici: sviluppo di un nuovo metodo per la misurazione diretta. Journal of Endodontics 29, 751–5.
- Tanomaru-Filho M, Jorge EG, Guerreiro Tanomaru JM, Goncalves M (2007) Valutazione della radiopacità di nuovi materiali di riempimento per canali radicolari mediante digitalizzazione delle immagini. Journal of Endodontics 33, 249–51.
- Tanomaru-Filho M, Jorge EG, Tanomaru JM, Goncalves M (2008) Valutazione della radiopacità dei sigillanti per canali radicolari a base di idrossido di calcio e vetroionomero. International Endodontic Journal 41, 50–3.
- Tas¸demir T, Yesilyurt C, Yildirim T, Er K (2008) Valutazione della radiopacità di nuove paste/sigillanti per canali radicolari mediante radiografia digitale. Journal of Endodontics 34, 1388–90.
- Versiani MA, Carvalho-Junior JR, Padilha MI, Lacey S, Pascon EA, Sousa-Neto MD (2006) Uno studio comparativo delle proprietà fisico-chimiche dei sigillanti per canali radicolari AH Plus ed Epiphany. International Endodontic Journal 39, 464–71.
- Wilson AD, McLean JW (1988) Cemento Vetroionomero. Chicago: Quintessence Pub. Co.

/social-network-service/media/default/6758/89a8282e.png)