Valutazione dei detriti duri accumulati tramite microtomografia computerizzata e software gratuito per l'elaborazione e l'analisi delle immagini
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo).
Abstract
Introduzione: L'accumulo di detriti si verifica dopo le procedure di preparazione del canale radicolare, in particolare in finiture, isthmus, irregolarità e ramificazioni. L'obiettivo di questo studio era presentare una descrizione passo-passo di un nuovo metodo utilizzato per identificare, misurare e mappare tridimensionalmente l'accumulo di detriti di tessuto duro all'interno del canale radicolare dopo la preparazione biomeccanica utilizzando software gratuiti per l'elaborazione e l'analisi delle immagini.
Metodi: Sono stati selezionati e scansionati tre molari mandibolari con la radice mesiale caratterizzata da una grande larghezza dell'isthmus e una configurazione del canale di tipo II di Vertucci. I campioni sono stati assegnati a 1 dei 3 approcci sperimentali: (1) 5,25% di ipoclorito di sodio + 17% di EDTA, (2) acqua bidistillata e (3) nessuna irrigazione. Dopo la preparazione del canale radicolare, sono state effettuate scansioni ad alta risoluzione dei denti e sono stati utilizzati pacchetti software gratuiti per registrare e quantificare la quantità di detriti di tessuto duro accumulati sia nello spazio del canale che nelle aree dell'isthmus.
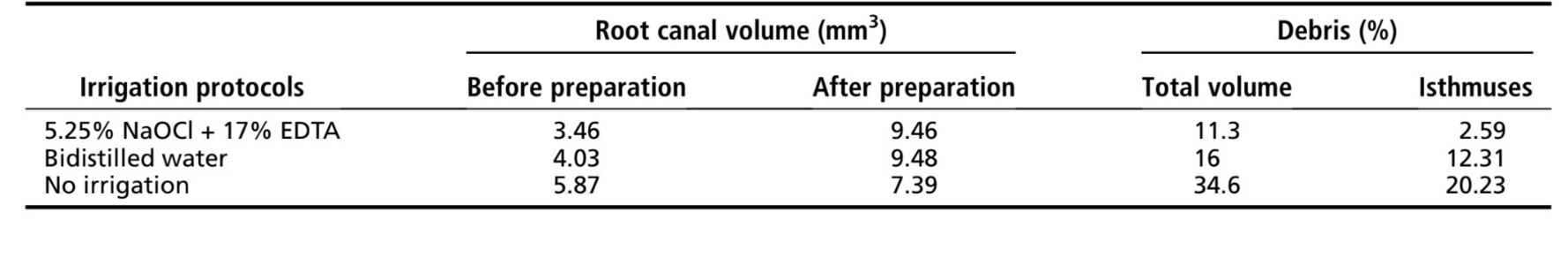
Risultati: La preparazione del canale senza irrigazione ha portato al riempimento del 34,6% del suo volume con detriti di tessuto duro, mentre l'uso di acqua bidistillata o NaOCl seguito da EDTA ha mostrato una riduzione della percentuale di volume di detriti al 16% e all'11,3%, rispettivamente. Più vicino era la distanza all'area dell'istmo, maggiore era la quantità di detriti accumulati indipendentemente dal protocollo di irrigazione utilizzato.
Conclusioni: Attraverso il presente metodo, è stato possibile calcolare il volume di detriti di tessuto duro negli istmi e nello spazio del canale radicolare. I pacchetti software gratuiti utilizzati per la ricostruzione delle immagini, la registrazione e l'analisi si sono dimostrati promettenti per l'applicazione da parte degli utenti finali. (J Endod 2014;40:271–276)
Sin dalla prima descrizione di uno strato di detriti sulla dentina radicolare strumentata, il concetto di strato di detriti ha svolto un ruolo fondamentale nella ricerca e nella pratica endodontica. Lo strato di detriti è stato definito come un film superficiale di detriti trattenuto sulla dentina e su altre superfici dopo la strumentazione con strumenti rotanti o file endodontici. Esso è composto da particelle di dentina, resti di tessuto pulpare vitale o necrotico, componenti batterici e irrigante trattenuto. Sfortunatamente, i risultati degli studi precedenti erano parzialmente contraddittori e la maggior parte delle raccomandazioni cliniche si basava solo su valutazioni descrittive o semiquantitative in vitro con microscopia elettronica a scansione. D'altra parte, Paqué et al. hanno riaperto un'interessante discussione sull'accumulo sostanziale di detriti che si verifica dopo la preparazione biomeccanica, specificamente in pinne, istmi, irregolarità e ramificazioni della complessa rete del canale radicolare. L'accumulo di detriti di tessuto duro è stato considerato un effetto collaterale delle procedure di pulizia e modellamento e potrebbe essere più clinicamente rilevante dello strato di detriti poiché la sua considerevole quantità potrebbe facilmente ospitare biofilm batterici derivanti dalle procedure di disinfezione. La valutazione dell'accumulo di detriti di tessuto duro è stata resa possibile attraverso la combinazione di imaging micro–tomografia computerizzata (CT) non distruttiva e lo sviluppo di software robusti per l'analisi e l'elaborazione delle immagini. Attraverso l'imaging micro-CT, i denti possono essere scansionati prima e dopo le procedure di pulizia e modellamento e, con l'aiuto di software adeguati, i volumi delle immagini risultanti da entrambe le procedure di scansione possono essere geograficamente coregistrati (cioè, diversi set di dati possono essere trasformati e integrati in un sistema di coordinate).
Questo consente, in certa misura, l'identificazione dei detriti di dentina che sono stati imballati nello spazio originale del canale radicolare dopo la preparazione. La logica alla base di questo approccio ha una base semplice, che è stata descritta per la prima volta da Paqué et al e recentemente ben definita da Robinson et al come ‘‘pixel che erano occupati dall'aria e poi sono diventati dentina devono essere detriti.’’
Risultati interessanti sull'effetto delle attuali procedure di pulizia e modellatura sull'accumulo di detriti di tessuto duro sono stati mostrati in studi recenti.
- EDTA e irrigazione ultrasonica passiva hanno ridotto l'accumulo di detriti di tessuto duro, ma circa il 50% dei detriti è ancora rimasto nello spazio del canale radicolare.
- L'uso di un chelante compatibile con l'ipoclorito ha consentito la riduzione dell'accumulo di detriti di tessuto duro.
- I sistemi di file auto-regolanti (ReDent-Nova, Ra’anana, Israele) hanno portato a un accumulo di detriti di tessuto duro inferiore nei sistemi di canale radicolare contenenti istmo rispetto all'istrumentazione rotativa con ProTaper (Dentsply/Maillefer, Ballaigues, Svizzera) e irrigazione con ago/siringa.
Questi risultati devono essere sottolineati perché sono stati forniti da esperimenti metodologicamente solidi utilizzando la tecnologia micro-CT e l'analisi delle immagini. Pertanto, un punto degno di discussione è il recente cambiamento metodologico nello studio dell'accumulo di detriti di tessuto duro. Di conseguenza, alcune preoccupazioni riguardanti la tecnologia micro-CT devono essere evidenziate considerando che si tratta di una procedura ad alto costo, laboriosa e che richiede tempo, con una curva di apprendimento estesa per acquisire l'expertise necessaria per estrarre dati quantitativi. Uno dei motivi del costo elevato delle procedure sperimentali che utilizzano questa tecnologia è legato ai pacchetti software proprietari tipicamente costosi. Questo è uno dei punti che impediscono la diffusione mondiale di questa utile metodologia.
Pertanto, l'obiettivo di questo studio era presentare una descrizione passo-passo di un nuovo metodo utilizzato per identificare, misurare e mappare tridimensionalmente l'accumulo di detriti di tessuto duro all'interno dello spazio del canale radicolare dopo la preparazione biomeccanica utilizzando software gratuiti per l'elaborazione e l'analisi delle immagini. I suoi vantaggi rispetto ai pacchetti software proprietari per l'analisi delle immagini e le sue limitazioni sono anche attentamente affrontati.
Materiali e Metodi
Criteri di Selezione dei Denti
Questo studio è stato revisionato e approvato dal Comitato Etico, Nucleo di Studi sulla Salute Collettiva (protocollo n. 2223-CEP/HUPE). Sono stati ottenuti centoventi primi e secondi molari mandibolari umani con radici completamente separate da un pool di denti estratti. I denti sono stati estratti per motivi non correlati a questo studio e inizialmente selezionati sulla base di radiografie digitali effettuate in direzione buccolinguale per rilevare eventuali ostruzioni del canale radicolare e per determinare l'angolo di curvatura della radice mesiale come descritto da Schneider. L'angolo di curvatura è stato misurato utilizzando un programma di analisi delle immagini open source (Fiji v.1.47n; Madison, WI), e sono stati selezionati solo i denti con una radice mesiale con curvatura moderata (che varia da 10◦ a 20◦). Inoltre, i criteri di inclusione comprendevano solo molari in cui la misurazione apicale finale dei canali mesiali consentiva l'inserimento di un file manuale di dimensione 10 (Dentsply Maillefer, Ballaigues, Svizzera) fino alla lunghezza di lavoro. Inoltre, la lunghezza dei campioni è stata standardizzata tra 20 e 22 1 mm per prevenire l'introduzione di variabili confondenti, che potrebbero contribuire a variazioni nelle procedure di preparazione. Di conseguenza, sono stati selezionati e conservati 52 molari mandibolari in una soluzione di timolo allo 0,1% a 5◦C.
Per ottenere una panoramica generale dell'anatomia del canale radicolare, questi denti sono stati prescanati a una risoluzione isotropica relativamente bassa (70 mm) utilizzando uno scanner di microtomografia computerizzata (SkyScan 1172; Bruker-microCT, Kontich, Belgio) a 70 kV e 114 mA. Sulla base dei modelli tridimensionali (3D) di questo set di immagini prescanate, sono stati selezionati 37 molari mandibolari con una radice mesiale con un sistema di configurazione del canale di tipo II di Vertucci con una larghezza dell'istmo ampia tra i canali mesiali. Dopo la resezione della radice distale a livello della furcazione, 3 denti sono stati selezionati casualmente per lo studio presente e scansionati nuovamente a una risoluzione isotropica di 14,16 mm. Gli altri denti sono stati conservati per un uso futuro.
Preparazione e Irrigazione del Canale Radicolare
Le apici dei 3 denti sono stati sigillati con colla a caldo e incorporati in silossano polivinilico per simulare l'effetto dell'intrappolamento di gas apicale in un sistema di canale chiuso durante la preparazione del canale radicolare. Successivamente, per semplificare ulteriormente i processi di coregistrazione, ogni dente è stato posizionato coronale apicale all'interno di un supporto in resina epossidica su misura (Ø = 18 mm) per adattarsi senza problemi al supporto del campione del dispositivo micro-CT. I campioni sono stati assegnati casualmente a 1 dei 3 approcci sperimentali e è stata utilizzata una moneta per definire quali denti sarebbero stati trattati con i seguenti protocolli di irrigazione:
- 5,25% ipoclorito di sodio (NaOCl) + 17% EDTA
- Acqua bidistillata
- Nessuna irrigazione (controllo positivo)
I denti sono stati preparati utilizzando una tecnica di reciprocazione in nichel-titanio in modo standardizzato. I denti sono stati accessibili e la pervietà del canale radicolare è stata confermata inserendo una K-file di dimensione 10 (Dentsply Maillefer) attraverso il forame apicale prima e dopo il completamento della preparazione del canale radicolare. La lunghezza di lavoro è stata stabilita sottraendo 1 mm dalla lunghezza del canale. Reciproc R25 (VDW GmbH, Monaco, Germania) è stato introdotto nel canale fino a quando non si è sentita resistenza e poi attivato in un movimento di reciprocazione generato da un manipolo a contrangolo 6:1 (Sirona, Bensheim, Germania) alimentato da un motore elettrico (VDW Silver; VDW GmbH, Monaco, Germania) utilizzando la configurazione preimpostata "Reciproc ALL". Lo strumento è stato spostato in direzione apicale utilizzando un movimento di picchiettamento in entrata e uscita di circa 3 mm di ampiezza con una leggera pressione apicale. Dopo 3 movimenti di picchiettamento, lo strumento è stato rimosso dal canale e pulito. Un singolo operatore con esperienza nell'esecuzione di trattamenti canalari utilizzando tecniche di reciprocazione ha eseguito tutte le preparazioni.
Per i protocolli di irrigazione 1 (5,25% NaOCl + 17% EDTA) e 2 (acqua bidistillata), gli irriganti sono stati continuamente erogati da una pompa peristaltica VATEA (ReDent-Nova, Ra’anana, Israele) a una velocità di 2 mL/min collegata a una punta Endo-Eze da 30-G (Ultradent Products Inc, South Jordan, UT) inserita nel canale senza vincoli fino a 2 mm dall'apice del forame. L'aspirazione è stata eseguita con un SurgiTip (Ultradent Products Inc) attaccato a una pompa di aspirazione ad alta velocità. Tra ogni fase di preparazione, i canali radicolari sono stati irrigati con 2 mL di irrigante per 1 minuto. Di conseguenza, è stato utilizzato un volume totale di 20 mL di 5,25% NaOCl (protocollo 1) e acqua bidistillata (protocollo 2) per ogni canale radicolare durante la preparazione biomeccanica. Dopo la preparazione del canale radicolare, è stata eseguita un'ulteriore risciacquo con 20 mL di irrigante per 10 minuti. Così, in ciascun protocollo, è stato utilizzato un volume totale di 40 mL di irrigante per canale per un tempo totale di 30 minuti. Dopo questo passaggio, il film di detrito è stato rimosso con 3 mL di 17% EDTA (pH = 7,7) erogati a una velocità di 1 mL/min per 3 minuti. Quindi, tutti i canali sono stati asciugati con punti di carta assorbente (Dentsply Maillefer). Per il protocollo 3, i canali mesiali sono stati preparati senza soluzione irrigante.
Scans Micro-CT
Scans ad alta risoluzione, prima e dopo la preparazione del canale radicolare, sono stati effettuati per ogni dente utilizzando gli stessi parametri selezionati. I denti sono stati scansionati (SkyScan 1172) a 70 kV, 114 mA e con una dimensione del pixel isotropica di 14,16 mm. La scansione è stata eseguita con una rotazione di 360◦ attorno all'asse verticale con un tempo di esposizione della camera di 7.000 millisecondi, un passo di rotazione di 0,5◦ e una media dei fotogrammi di 5. I raggi X sono stati filtrati con un filtro in alluminio di 1 mm. Una correzione del campo piatto è stata effettuata prima delle procedure di scansione per correggere le variazioni nella sensibilità dei pixel della camera. Le immagini sono state ricostruite utilizzando NRecon v.1.6.3 (Brucker-microCT) con una correzione dell'indurimento del fascio del 40% e una correzione dell'artefatto ad anello del 10, risultando nell'acquisizione di 700–800 sezioni trasversali per dente in formato bitmap. Il volume di interesse è stato selezionato estendendosi dal livello di furcazione all'apice della radice mesiale.
Analisi Immagine Quantitativa
Per l'analisi quantitativa, le immagini originali in scala di grigi delle sezioni trasversali delle radici prima e dopo la preparazione sono state elaborate con una soglia di segmentazione interattiva per separare la dentina e i detriti dallo spazio del canale radicolare utilizzando l'interfaccia software Seg3D v.2.1.4 (National Institutes of Health Center for Integrative Biomedical Computing, University of Utah Scientific Computing and Imaging Institute, Salt Lake City, UT). Questo processo comporta la scelta dell'intervallo di livelli di grigio necessario per riconoscere le regioni di un'immagine data, dividendola nelle sue specifiche parti componenti di interesse. Il risultato finale è un'immagine binaria composta solo da pixel neri o bianchi in cui i pixel neri rappresentano gli spazi vuoti e i pixel bianchi l'oggetto di interesse. Successivamente, è stata applicata una maschera di etichetta alle regioni segmentate di interesse e salvata come strati opachi colorati. Utilizzando lo stesso software, gli stack di immagini della maschera di etichetta delle radici, dai denti prima e dopo la preparazione del canale, sono stati selezionati e coregistrati tramite un processo di sovrapposizione automatica basato sul contorno esterno della radice utilizzando 1.000 interazioni. Per convalidare questo processo, i denti non preparati sono stati sottoposti due volte al processo di scansione, venendo rimossi e reinseriti nel supporto del campione del dispositivo micro-CT. Successivamente, la differenza tra i dataset pre e post scansione ottenuta tramite un'operazione di sottrazione morfologica ha mostrato un errore computazionale di solo l'1% (~2 voxel), il che ha confermato l'affidabilità del processo di registrazione.
Le maschere di etichetta dei dataset registrati di ciascun dente sono state importate nel software Fiji e normalizzate. Nella procedura di normalizzazione, tutti i valori dei pixel nei file maschera sono stati classificati e divisi in un numero di quantili. Successivamente, ciascuno dei valori in un dato quantile è stato sostituito con il valore medio in quel quantile, risultando in una distribuzione molto simile dei valori dell'istogramma in tutte le immagini.
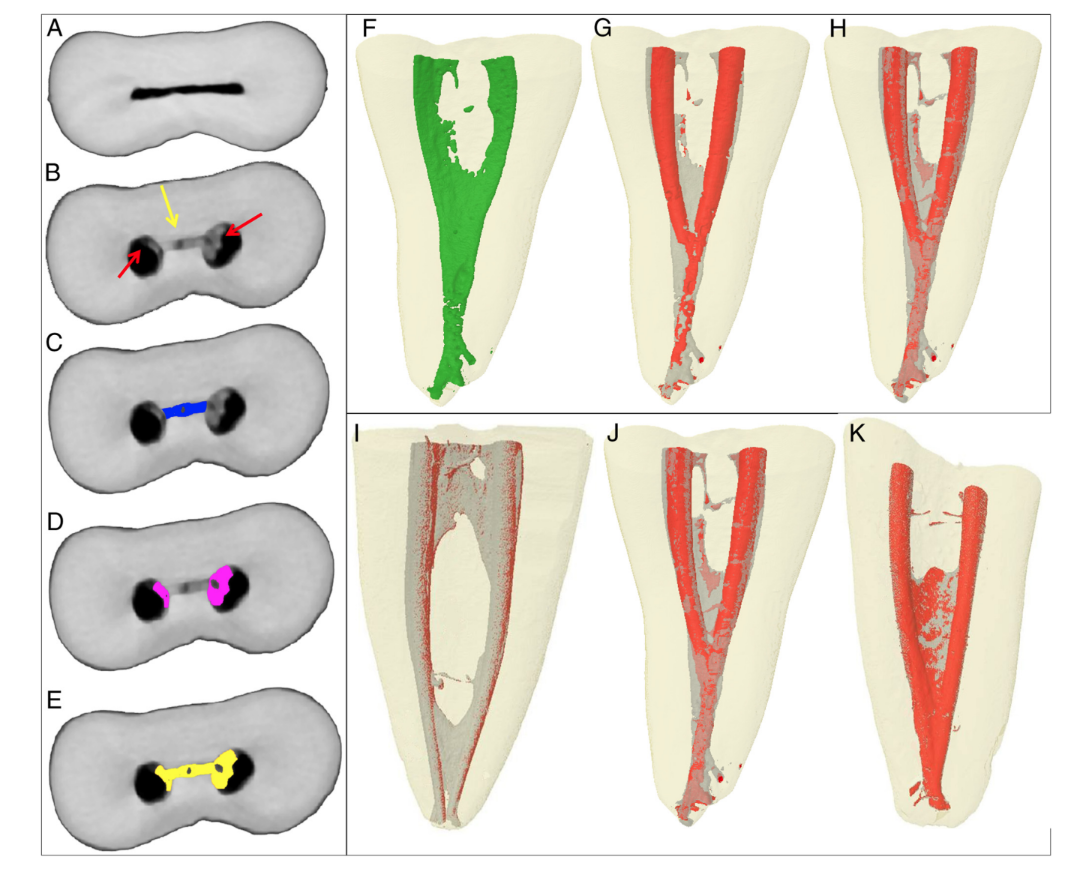
Successivamente, lo spazio del canale è stato segmentato come risultato di un'operazione bitwise automatica di eccezione tra la sequenza dell'immagine della radice con la dentina segmentata, e questa stessa sequenza è stata duplicata e invertita. La sequenza di immagini risultante da questa operazione è stata ulteriormente utilizzata per identificare i detriti di tessuto duro accumulati mediante operazioni morfologiche. La quantificazione dei detriti è stata eseguita dalla differenza tra lo spazio del canale radicolare non preparato e quello preparato utilizzando procedure di post-elaborazione nel software Fiji (Fig. 1A–H). La presenza di un materiale con densità simile alla dentina in regioni precedentemente occupate dall'aria nello spazio del canale radicolare non preparato è stata considerata detrito e quantificata dall'intersezione tra le immagini prima e dopo l'istrumentazione del canale. L'identificazione dei detriti di tessuto duro è stata il risultato dell'intersezione (AND) dell'immagine del canale radicolare preparato senza alcun detrito e la stessa immagine invertita ma con detrito all'interno. Il volume dello spazio del canale corrispondente prima e dopo la preparazione e il volume totale dei detriti di tessuto duro accumulati sono stati calcolati in valori assoluti.

Il risultato di A o B; canale preparato senza detriti; il canale non preparato non ne ha. (D) Un'immagine invertita di B. (E) Il risultato di C e D; le aree comuni
rappresentano gli spazi vuoti che sono stati riempiti dopo la preparazione. (F–H) Detriti totali. (F) Canale preparato segmentato senza detriti. (G) Il risultato di F o C. (H) Il risultato di G e D; detriti negli istmi e nello spazio del canale strumentato.
Successivamente, il mazzo di immagini ottenute dopo la quantificazione dei detriti (Fig. 2A–E) è stato reso tridimensionalmente utilizzando un plug-in per visualizzatori 3D (Internationale Medieninformatik; HTW Berlino, Berlino, Germania). Sono stati resi modelli tridimensionali del canale non preparato, del canale preparato e del totale dei detriti (Fig. 2F–H). Il software CTVol v.2.2.1 (Bruker-microCT) è stato utilizzato per la visualizzazione e la valutazione qualitativa dei modelli 3D.
Risultati
È stato possibile identificare e misurare i detriti di tessuto duro accumulati dopo la preparazione nei canali radicolari mesiali per tutti i protocolli testati (Fig. 2I–K). Tabella 1 mostra il volume percentuale di tessuto duro accumulato dopo la preparazione dei canali mesiali dei molari mandibolari utilizzando diversi protocolli di irrigazione. La preparazione del canale radicolare senza irrigazione (gruppo di controllo positivo) ha portato al riempimento del 34,6% del suo volume con detriti di tessuto duro, mentre l'uso di acqua bidistillata o NaOCl al 5,25% seguito da EDTA al 17% ha mostrato una riduzione nel volume percentuale di detriti al 16% e 11,3%, rispettivamente; questo è stato chiaramente osservato nei modelli 3D in Figura 2. Questa riduzione è stata osservata anche quando l'area dell'istmo è stata analizzata separatamente.
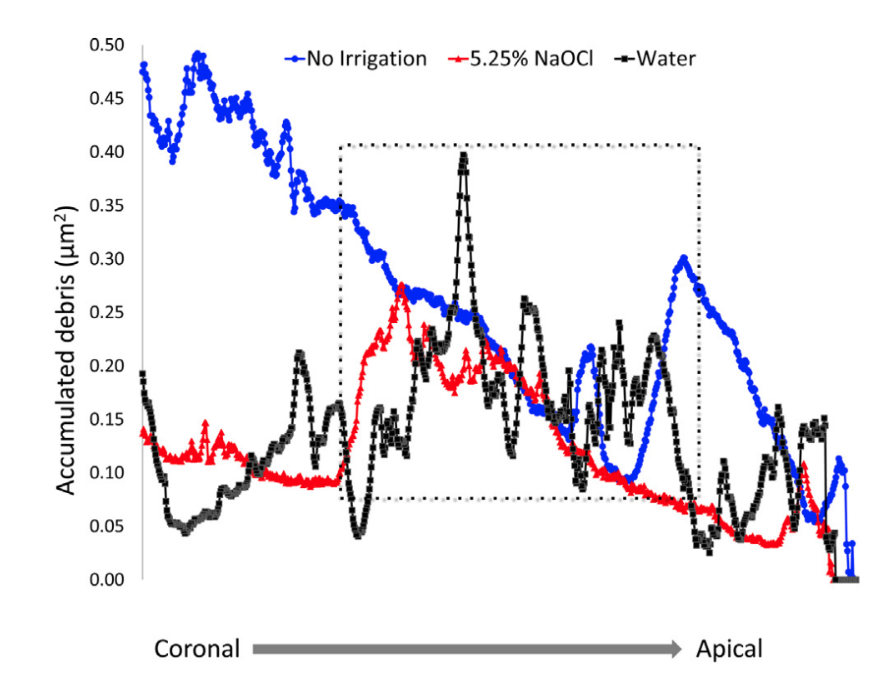
Dopo una valutazione qualitativa dei modelli 3D e delle sezioni trasversali dei campioni, è stato possibile osservare che i detriti di tessuto duro si accumulavano non solo nelle aree degli isthmus ma anche nelle irregolarità delle pareti dentinali (Fig. 2D e G), sottolineando che questo era un modello lungo tutta la lunghezza del canale radicolare. La distribuzione dei detriti di tessuto duro accumulati lungo i livelli del canale radicolare è mostrata nel grafico in Figura 3.
Discussione
Nell'endodonzia, la tecnologia micro-CT non distruttiva è stata utilizzata con successo per misurare i detriti in esperimenti ex vivo. Attraverso il metodo attuale, è stato possibile calcolare il volume dei detriti di tessuto duro accumulati negli isthmus e nello spazio del canale radicolare strumentato in modo separato (Fig. 2A–E). La capacità di valutare indipendentemente i detriti sia nell'area dell'isthmus non strumentato che nello spazio del canale radicolare strumentato è utile in quanto consente di comprendere l'effetto di una determinata tecnica di preparazione o protocollo di irrigazione in ciascuna di queste aree o nel sistema del canale radicolare nel suo complesso. A quanto ne sanno gli autori, questo è un aspetto innovativo rispetto agli studi precedenti in cui le misurazioni erano limitate all'area dell'isthmus. Si può presumere che l'elaborazione e l'analisi delle immagini utilizzate negli studi precedenti non fossero in grado di discernere tra lo spazio del canale radicolare preparato e i detriti accumulati densamente. Questo potrebbe spiegare perché i detriti accumulati fossero sovrapposti all'anatomia originale del canale radicolare piuttosto che all'anatomia dopo la preparazione.
Secondo alcuni rapporti precedenti, la soluzione di ipoclorito di sodio combinata con diversi protocolli di irrigazione non è stata in grado di rimuovere completamente i detriti dalle aree difficili da raggiungere dei canali radicolari, come istmi, pinne e irregolarità; i risultati attuali corroborano queste scoperte, che possono essere facilmente osservate nei modelli 3D dei denti preparati (Fig. 2). In questo rapporto iniziale, le misurazioni sono state eseguite solo per dimostrare che il metodo è in grado di calcolare in modo affidabile i detriti di tessuto duro accumulati sia nelle aree degli istmi che nel canale radicolare preparato; questo è stato il motivo per cui sono stati utilizzati solo 3 denti e, quindi, non sono state effettuate comparazioni statistiche. Anche così, si può presumere che i canali irrigati con acqua bidistillata mostrassero una maggiore tendenza a trattenere detriti rispetto al protocollo di irrigazione convenzionale, anche se in entrambi i casi è stato applicato lo stesso flusso della soluzione e lo stesso tempo di irrigazione (Fig. 2I–K). L'obiettivo generale di questo studio era testare se un metodo di approccio con software gratuito sarebbe stato efficace nel misurare l'accumulo di detriti e anche per evidenziare le differenze nella misurazione dei risultati. Per questo motivo, non sono stati creati gruppi sperimentali di dimensioni considerevoli e sono stati utilizzati solo 3 denti. Pertanto, oltre ai dati quantitativi, è stata eseguita un'analisi descrittiva qualitativa, e ciò è stato sufficiente per mostrare le differenze tra i 3 protocolli poiché la dimensione dell'effetto testato è grande e forte.
Come previsto, la percentuale di volume di detriti di tessuto duro accumulati era più alta nei canali non irrigati (34,6%) e nei canali irrigati con acqua bidistillata (16%) rispetto al protocollo di irrigazione convenzionale, che ha mostrato notevolmente meno detriti rimanenti (11,3%). La capacità di dissoluzione dei tessuti dell'ipoclorito acquoso combinato con EDTA può spiegare la percentuale più bassa di detriti rimanenti nel canale radicolare. Allo stesso modo, nell'area dell'istmo, è stata osservata la percentuale di volume di detriti più bassa quando i canali sono stati irrigati con 5,25% di NaOCl più 17% di EDTA. Come previsto, il dente non irrigato ha mostrato notevolmente più detriti accumulati, certamente a causa della mancanza dell'effetto del flusso liquido. Questo è in linea con uno studio classico di Baker et al, che ha trovato il 70% in più di detriti quando l'istrumentazione del canale è stata eseguita senza alcuna irrigazione.
È un risultato degno di nota che la percentuale di volume di detriti nello studio attuale fosse inferiore a quelle precedentemente riportate. Questo è infatti previsto e può essere spiegato perché in quegli studi il volume del canale radicolare prima della preparazione è stato utilizzato per il confronto, mentre nello studio attuale il parametro di riferimento era il volume del canale dopo la preparazione. L'assunzione alla base di questo nuovo approccio si basa sul ragionamento che il volume finale del canale è il reale volume del canale dopo l'ingrandimento meccanico.
Tipicamente, i pacchetti software proprietari sono piuttosto costosi e la loro disponibilità per la comunità di ricerca generale è limitata. Inoltre, la maggior parte di essi non soddisfa le funzioni speciali necessarie per la ricerca endodontica. Per questo articolo, la selezione del software di elaborazione e visualizzazione delle immagini si è basata su un vincolo principale: essere disponibile gratuitamente. In breve, il pacchetto NRecon (Brucker micro-CT) è stato utilizzato per ricostruire immagini sezionali a partire da immagini di proiezione tomografica. Successivamente, il software Seg3D (National Institutes of Health Center for Integrative Biomedical Computing) è stato utilizzato per registrare i dataset prima e dopo la preparazione del canale radicolare. Infine, la quantità di detriti è stata calcolata con il software Fiji. Questo è un aspetto importante e può beneficiare i gruppi di ricerca di tutti i budget. Di conseguenza, il software gratuito può aiutare a diffondere l'uso della ricostruzione 3D e dei metodi micro-CT in generale.
Da un lato, il software utilizzato in questo articolo ha molti strumenti automatici per l'elaborazione e la registrazione dei dati che rendono l'analisi delle immagini una procedura meno laboriosa e dispendiosa in termini di tempo. Dall'altro lato, questa gamma di strumenti automatici può portare a errori procedurali che si riflettono sulle misurazioni finali. Pertanto, è stata prestata particolare attenzione all'accuratezza del processo di registrazione eseguito con il software Seg3D e all'accuratezza dell'analisi e dell'elaborazione delle immagini digitali con il software Fiji attraverso l'uso di cuscinetti a sfera in alluminio. Tuttavia, contrariamente ai risultati di Robinson et al., l'errore computazionale per le sfere più grandi era inferiore per tutti i campioni, mentre quelle più piccole mostrano risultati uguali per il volume. Di conseguenza, le misurazioni effettuate dal software Fiji sono state considerate affidabili per quantificare il volume anche in campioni piccoli.
È stato fatto un grande sforzo anche per garantire la creazione di una base solida riguardo alla lunghezza e alla curvatura del canale radicolare, così come alla configurazione anatomica. Questo è un passo critico con lo scopo di minimizzare l'effetto dell'anatomia sui risultati finali. Nello studio presente, sono stati scelti solo canali con classificazione di Vertucci di tipo II per garantire la presenza di istmi e comunicazione tra i canali mesiali, così come aree difficili da raggiungere dove i detriti tissutali tendono ad accumularsi.
È stato utilizzato un design di canale a fondo chiuso per imitare le impostazioni in vivo in cui il forame è racchiuso all'interno dell'osso alveolare e del legamento parodontale; secondo Tay et al, il sistema di canale chiuso produce intrappolamento di gas, che spesso impedisce all'irrigante di raggiungere gli ultimi millimetri apicali dello spazio canalare. Questo stesso approccio è stato utilizzato anche in altri studi, il che sottolinea la preoccupazione scientifica nel comprendere l'effetto dell'intrappolamento di gas sui protocolli di irrigazione.
Gli istmi che collegano più canali sono il tipo di configurazione anatomica che presenta una sfida clinica direttamente correlata ai protocolli di irrigazione, poiché tutte le tecniche di preparazione spesso lasciano dietro di sé residui di tessuto duro e morbido accumulati, così come microrganismi in queste aree difficili da raggiungere. Per migliorare la somministrazione e il flusso dell'irrigante, sono disponibili diversi dispositivi e soluzioni. In questo studio, è stata utilizzata una soluzione di NaOCl al 5,25% seguita da EDTA al 17% perché è la soluzione irrigante più comunemente utilizzata a livello mondiale e ha proprietà di essere un solvente efficiente per i tessuti inorganici e organici. È stata utilizzata acqua bidistillata come protocollo di irrigazione di controllo, presunto meno efficace perché l'acqua è una soluzione inerte e, quindi, ci si aspetterebbe solo l'effetto fisico del flusso dell'irrigante. Inoltre, il tempo (30 minuti) e il volume totale (40 mL) degli irriganti sono stati attentamente osservati per garantire condizioni di irrigazione fisica comparabili tra questi protocolli sperimentali, riproducendo uno standard clinico valido. Seguendo lo studio di Paqué et al, non è stato utilizzato alcun protocollo di irrigazione qui; pertanto, è stato possibile garantire uno standard per il confronto con un enorme accumulo di detriti originato dall'azione meccanica diretta dello strumento sulle pareti dentinali e anche senza contare su alcun effetto di flusso della soluzione irrigante.
Una volta che si sa che la pulizia e la modellazione sono processi rilevanti per l'esito della terapia endodontica, sono necessari ulteriori esperimenti per valutare le strategie antidebris e testare la potenziale correlazione tra i detriti di tessuto duro accumulati e la penetrazione della soluzione irrigante, la sopravvivenza microbica all'interno dell'anatomia complessa del canale radicolare e il riempimento del canale radicolare.
In conclusione, nonostante la lunga curva di apprendimento richiesta per affrontare queste nuove tecnologie di imaging, i pacchetti software gratuiti utilizzati per la ricostruzione delle immagini, la registrazione e l'analisi nello studio attuale si sono dimostrati promettenti per l'applicazione da parte dell'utente finale nella ricerca endodontica contemporanea.
Autori: Gustavo De-Deus, Juliana Marins, Aline de Almeida Neves, Claudia Reis, Sandra Fidel, Marco A. Versiani, Haimon Alves, Ricardo Tadeu Lopes, Sidnei Paciornik
Riferimenti:
- McComb D, Smith DC. Uno studio preliminare con microscopia elettronica a scansione dei canali radicolari dopo procedure endodontiche. J Endod 1975;1:238–42.
- De-Deus G, Reis C, Paciornik S. Valutazione critica degli studi pubblicati sulla rimozione dello strato di detrito: questioni metodologiche. Oral Surg Oral Med Oral Pathol Endod 2011;112: 531–43.
- Glossario dei termini di endodonzia, 8ª ed. Chicago, IL: American Association of Endodontists; 2012.
- Paqué F, Laib A, Gautschi H, et al. Analisi dell'accumulo di detriti di tessuto duro tramite scansioni di tomografia computerizzata ad alta risoluzione. J Endod 2009;35:1044–7.
- Robinson JP, Lumley PJ, Claridge E, et al. Una metodologia analitica di Micro CT per quantificare i detriti di dentina inorganica dopo la preparazione interna del dente. J Dent 2012;40:999–1005.
- Versiani MA, Leoni GB, Steier L, et al. Studio di micro-tomografia computerizzata di canali a forma ovale preparati con i sistemi Self-adjusting File, Reciproc, WaveOne e Pro-Taper Universal. J Endod 2013;39:1060–6.
- Paqué F, Boessler C, Zehnder M. Livelli di detriti di tessuto duro accumulati nelle radici mesiali dei molari mandibolari dopo passaggi di irrigazione sequenziali. Int Endod J 2010; 44:148–53.
- Paqué F, Rechenberg D-K, Zehnder M. Riduzione dell'accumulo di detriti di tessuto duro durante l'istruzione rotativa del canale radicolare mediante acido etidronico in un irrigante di ipoclorito di sodio. J Endod 2012;38:692–5.
- Paqué F, Al-Jadaa A, Kfir A. Accumulo di detriti di tessuto duro creato da strumentazione rotativa convenzionale rispetto a quella con file auto-regolabili nei sistemi di canali radicolari mesiali dei molari mandibolari. Int Endod J 2012;45:413–8.
- Schneider SW. Un confronto delle preparazioni dei canali nei canali radicolari dritti e curvi. Oral Surg Oral Med Oral Pathol Endod 1971;32:271–5.
- Schindelin J, Arganda-Carreras I, Frise E, et al. Fiji: una piattaforma open-source per l'analisi delle immagini biologiche. Nature methods 2012;9:676–82.
- Vertucci FJ. Morfologia del canale radicolare e la sua relazione con le procedure endodontiche. Endod Topics 2005;10:3–29.
- Susin L, Liu Y, Yoon JC, et al. Efficacia della detersione del canale e dell'istmo di due tecniche di agitazione dell'irrigante in un sistema chiuso. Int Endod J 2010;43: 1077–90.
- Tay FR, Gu LS, Schoeffel GJ, et al. Effetto del blocco di vapore sulla detersione del canale radicolare utilizzando un ago a ventilazione laterale per la somministrazione di irrigante a pressione positiva. J Endod 2009;36: 745–50.
- Peters OA, Boessler C, Paqué F. Preparazione del canale radicolare con un nuovo strumento in nichel-titanio valutato con micro-tomografia computerizzata: preparazione della superficie del canale nel tempo. J Endod 2010;36:1068–72.
- Peters OA. Sfide e concetti attuali nella preparazione dei sistemi di canali radicolari: una revisione. J Endod 2004;30:559–67.
- Gao Y, Peters OA, Wu H, et al. Un framework applicativo di ricostruzione e misurazione tridimensionale per la ricerca endodontica. J Endod 2009;35:269–74.
- Johnson M, Sidow SJ, Looney SW, et al. Efficacia della detersione del canale e dell'istmo utilizzando una tecnica di irrigazione sonora in un sistema di canale chiuso. J Endod 2012;38: 1265–8.
- Baker NA, Eleazer PD, Averbach RE, et al. Studio con microscopia elettronica a scansione dell'efficacia di varie soluzioni irriganti. J Endod 1975;1:127–35.
- Peters OA, Peters CI, Schönenberger K, et al. Preparazione rotativa del canale radicolare ProTaper: effetti dell'anatomia del canale sulla forma finale analizzati tramite micro CT. Int Endod J 2003;36:86–92.
- Versiani MA, P´ecora JD, Sousa-Neto MD. Analisi di microtomografia computerizzata della morfologia del canale radicolare dei canini mandibolari a radice singola. Int Endod J 2013;46: 800–7.
- De Pablo OV, Estevez R, Péix Sánchez M, et al. Anatomia radicolare e configurazione del canale del primo molare mandibolare permanente: una revisione sistematica. J Endod 2010;36: 1919–31.
- Adcock JM, Sidow SJ, Looney SW, et al. Valutazione istologica dell'efficacia della detersione del canale e dell'istmo di due diverse tecniche di somministrazione dell'irrigante in un sistema chiuso. J Endod 2011;37:544–8.
- Parente JM, Loushine RJ, Susin L, et al. Detersione del canale radicolare utilizzando agitazione dinamica manuale o l'EndoVac per l'irrigazione finale in un sistema chiuso e in un sistema aperto. Int Endod J 2010;43:1001–12.
- Gu Li-sha, Kim Jong Ryul, Ling Junqi, et al. Revisione delle tecniche e dei dispositivi di agitazione dell'irrigante contemporanei. J Endod 2009;35:791–804.
- Saleh IM, Ruyter IE, Haapasalo M, et al. Penetrazione batterica lungo diversi materiali di riempimento del canale radicolare in presenza o assenza di strato di detrito. Int Endod J 2008;41:32–40.
- Siqueira JJ, Alves FR, Versiani MA, et al. Analisi batteriologica e micro-tomografica correlativa dei canali mesiali dei molari mandibolari preparati con i sistemi SAF, Reciproc e Twisted File. J Endod 2013;39: 1044–50.
- De-Deus G, Reis C, Beznos D, et al. Capacità limitata di tre tecniche di gutta-percha termoplastica comunemente utilizzate nel riempimento di canali a forma ovale. J Endod 2008;34: 1401–5.

/social-network-service/media/default/6758/89a8282e.png)