Uno Studio Controllato Randomizzato di Rigenerazione Ossea Guidata per Difetti di Deiscenza Peri-Implantare con Due Materiali Ossei Bovinici Anorganici Coperti da Reticoli in Titanio
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract
Lo scopo di questo studio è confrontare due materiali di osso bovino anorganico sinterizzati a bassa temperatura (ABBMs), Bio-Oss (Geistlich, Wolhusen, Svizzera) e A-Oss (Osstem, Seoul, Corea), per GBR in difetti di deiscenza. Un singolo impianto è stato posizionato simultaneamente con GBR nel difetto osseo buccale o bucco-prossimale mediante stratificazione doppia di allograft interno e ABBM esterno, coperto da una rete di titanio ultrafine preformata e una membrana di collagene assorbibile. Le variazioni di volume dell'innesto sono state valutate mediante tomografia computerizzata a fascio conico, effettuata preoperatoriamente (T0), immediatamente dopo l'intervento chirurgico per l'impianto (T1), dopo l'intervento di riesposizione (T2) e dopo la consegna della restaurazione finale (T3). La densità dell'osso rigenerato è stata valutata misurando la profondità di sondaggio al centro buccale della rete dopo la rimozione della rete a T2. Sono state registrate anche le sequel postoperatorie. È stata osservata una riduzione del volume dell'innesto del 46,0% (0,78 ± 0,37 cc) e del 40,8% (0,79 ± 0,33 cc) nel gruppo Bio-Oss (8 pazienti) e nel gruppo A-Oss (8 pazienti), rispettivamente, a T3 (p < 0,001). Non ci sono state differenze significative nelle variazioni di volume dell'innesto in base ai periodi di tempo o alla densità ossea tra i due gruppi. Nonostante l'esposizione postoperatoria della rete (3 pazienti), la rimozione prematura di queste reti esposte e un ulteriore innesto non sono stati necessari, e tutti gli impianti sono stati funzionali durante il periodo di follow-up di 1 anno. Entrambi gli ABBMs con reti di titanio non hanno mostrato differenze significative nella quantità e densità dell'osso rigenerato dopo GBR per difetti peri-impiantari.
Introduzione
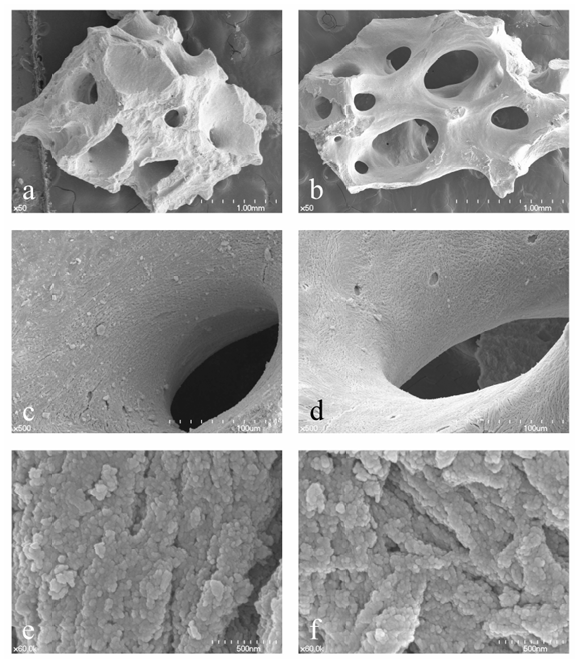
I dispositivi e le tecnologie innovative per ridurre la morbidità, i tempi biologici e chirurgici sono un argomento di intensa ricerca nell'odontoiatria implantare, e la rigenerazione ossea guidata (GBR) è una procedura chirurgica di aumento osseo per impianti dentali, utilizzando vari materiali di innesto osseo con membrane barriera concomitanti. I materiali ossei bovini anorganici (ABBM) sono stati ampiamente utilizzati come materiale osteoconduttivo per interventi di sollevamento del seno, preservazione dell'arcata, chirurgia implantare immediatamente dopo l'estrazione dentale e GBR. Il vantaggio unico dell'ABBM è la sua proprietà di mantenimento del volume con una lenta sostituzione da parte del nuovo osso rispetto ai materiali di innesto osseo autogeno e allogenico. Ci sono molti altri tipi di ABBM che sono sinterizzati ad alta temperatura o sono a base di suino e cavallo; tuttavia, gli ABBM a base bovina e sinterizzati a bassa temperatura sembrano dominare il mercato dentale. Storicamente, il Bio-Oss (Geistlich, Wolhusen, Svizzera) è stato a lungo considerato il gold standard grazie a forti evidenze scientifiche; tuttavia, l'A-Oss (Osstem, Seoul, Corea) è un ABBM prodotto mediante trattamento chimico con solvente aromatico e forte alcali e infine mediante un processo di ricottura a bassa temperatura al di sotto dei 400°C con un tasso di riscaldamento estremamente basso (<0.3°C al minuto). La caratterizzazione fisico-chimica dell'A-Oss, che potrebbe essere sostanzialmente equivalente a quella del Bio-Oss in considerazione sia della maggiore porosità che della minore cristallinità, è strettamente associata a una minore degradazione e attività di rimodellamento rispetto ad altri xenoinnesti (Figura 1).
Nel campo della chirurgia orale e maxillofacciale, la rete in titanio è stata ampiamente adottata per casi che richiedono una grande quantità di ricostruzione ossea grazie alla sua biocompatibilità e rigidità intrinseche come metallo leggero. In particolare, la recente introduzione di una rete in titanio ultrafine preformata, che è direttamente collegata e fissata all'impianto, ha aumentato la sua popolarità nella GBR per difetti ossei peri-implantari. Resistente al collasso durante l'intero periodo di guarigione della GBR, questa rete in titanio ultrafine ha molteplici pori di dimensioni variabili per risultati ottimali nella GBR.
Lo scopo di questo studio clinico controllato randomizzato era confrontare due ABBM sinterizzati a bassa temperatura, Bio-Oss e A-Oss, utilizzati nella GBR per la ricostruzione del difetto di deiscenza peri-implantare, in combinazione con la rete di titanio ultrafine. A nostra conoscenza, questo è il primo studio a misurare e confrontare i cambiamenti volumetrici tridimensionali degli ABBM per scopi di GBR. L'ipotesi nulla era che non ci fosse differenza nei cambiamenti del volume innestato (quantità di osso), densità (qualità dell'osso) dell'osso rigenerato e sequelae post-operatorie tra i gruppi.
Materiali e Metodi
Questo studio è stato progettato come un trial controllato randomizzato di disegno a gruppi paralleli ed è stato condotto presso la Divisione di Chirurgia Orale e Maxillofacciale, Dipartimento di Odontoiatria, Ospedale Universitario Hanyang, tra giugno 2018 e luglio 2019. Lo studio è stato approvato dal Comitato Etico dell'Ospedale Universitario Hanyang (IRB No. 2018-03-006) ed è stato registrato presso la piattaforma internazionale di registrazione degli studi clinici dell'OMS (KCT0004906). È stato condotto in conformità con le Dichiarazioni di Helsinki e le linee guida internazionalmente accettate per i RCT, inclusa la dichiarazione CONSORT (accesso il 2 marzo 2018). Tutte le procedure chirurgiche e protesiche sono state eseguite da un esperto implantologo (C.-J.P.).
Selezione dei Pazienti
Dopo esami clinici e radiologici preoperatori, inclusa la tomografia computerizzata a fascio conico (CBCT), è stato incluso in questo studio qualsiasi paziente sano di età pari o superiore a 18 anni, che necessitava di un posizionamento di impianto singolo nell'arcata alveolare guarita con GBR per il difetto di deiscenza peri-implantare quando l'impianto è stato simulato in una posizione guidata protesicamente (OneGuide, Osstem, Seoul, Corea), dopo aver fornito il consenso informato. In particolare, i difetti ossei dovevano essere limitati solo all'aspetto buccale e/o prossimale e non coinvolgevano la superficie del dente adiacente o l'aspetto linguale. I criteri di esclusione comprendevano la necessità di più di due impianti consecutivi e la presenza di controindicazioni sistemiche o locali per il posizionamento dell'impianto, inclusa una storia di disturbi metabolici non controllati, fumo, bruxismo o malattia parodontale non controllata. I pazienti arruolati sono stati informati sulle procedure chirurgiche, sui materiali da utilizzare, sui benefici e sui potenziali rischi e complicazioni di questo studio clinico, e è stato ottenuto il consenso informato scritto.
Procedura Chirurgica
Tutte le procedure sono state eseguite sotto anestesia locale e sedazione endovenosa moderata. È stata sollevata una flap a pieno spessore e tutto il tessuto di granulazione è stato rimosso accuratamente. La perforazione iniziale con marcatura dell'osso corticale è stata eseguita da un trapano guida. Sono stati utilizzati trapani a cono sequenziali per preparare il sito dell'impianto (kit OneGuide o kit 122 Taper, Osstem), e particolare attenzione è stata prestata per ottenere una corretta posizione tridimensionale dell'impianto. Un impianto dentale (TS III SOI, Osstem, o T01 SA, Toplan, Seoul, Corea) è stato installato 1 mm sotto il livello crestal linguale o palatale, e si è verificato un difetto di deiscenza attorno alla parte superiore dell'impianto, esponendo i fili buccali e/o prossimali dell'impianto.
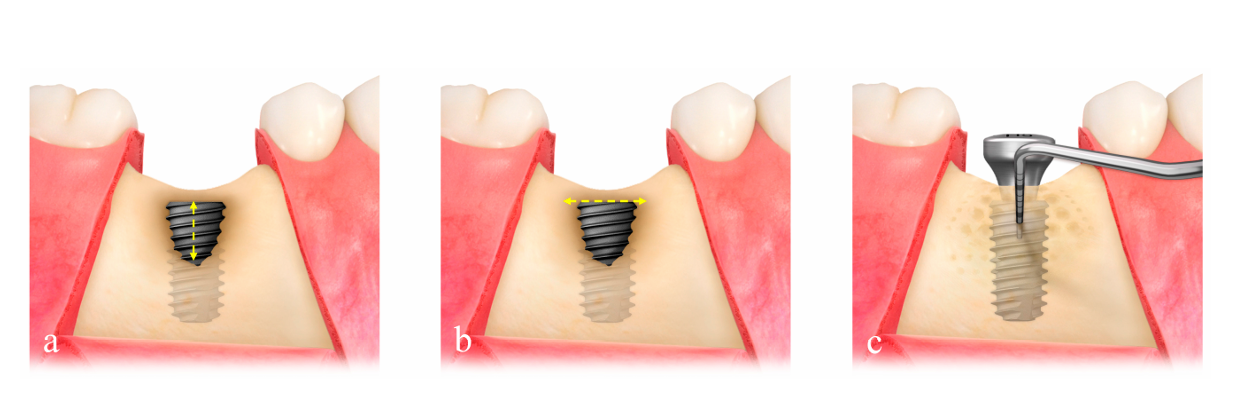
La dimensione del difetto (mm) consisteva in altezza del difetto, misurata dalla parte superiore dell'impianto al primo contatto osso-impianto, e larghezza del difetto, misurata dalla cresta ossea mesiale a quella distale a livello della parte superiore dell'impianto (Figura 2a,b). La rete di titanio ultrafine preformata (OssBuilder, Osstem), che era la più appropriata per la dimensione del difetto misurata, è stata selezionata da varie linee di tipo I per difetto di deiscenza buccale e tipo II per difetto di deiscenza bucco-prossimale combinato (Figura 3). Se necessario, sono stati effettuati piccoli ritocchi e modellamenti della rete di titanio per una migliore contenimento del materiale di innesto. Sono state eseguite più aperture del midollo osseo per indurre le cellule osteogeniche per una rigenerazione ossea più rapida e migliore.
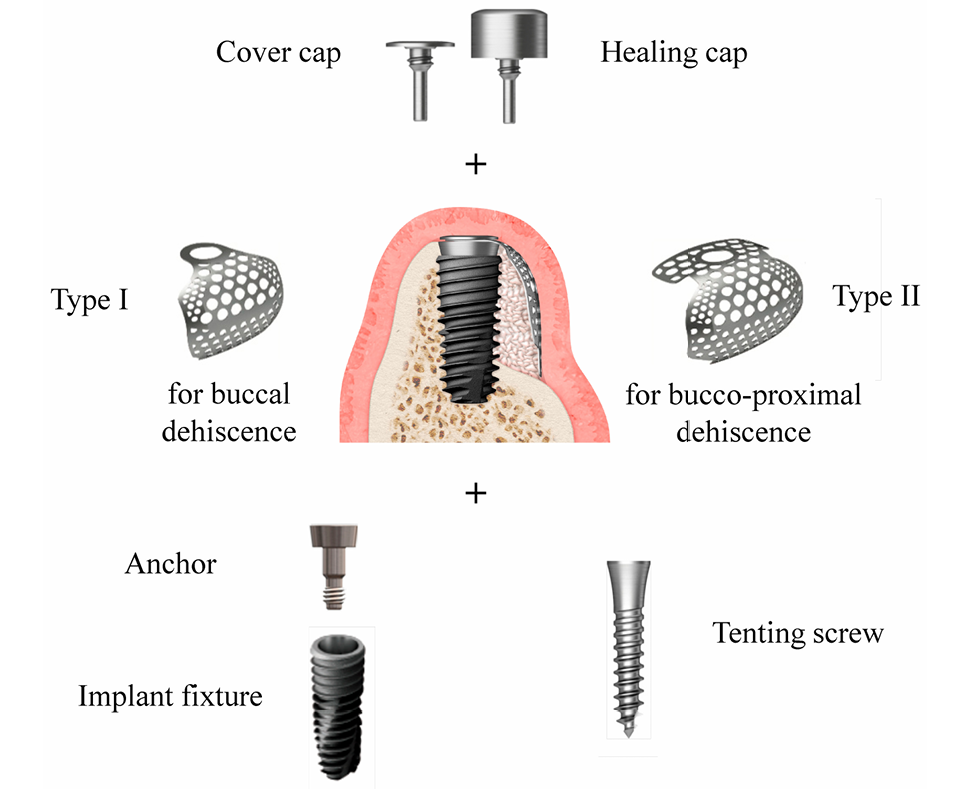
Secondo la busta di randomizzazione, i pazienti sono stati assegnati a due gruppi: gruppo Bio-Oss e gruppo A-Oss. I fili dell'impianto esposti sono stati coperti da un allograft osseo liofilizzato (FDBA; SureOss, HansBiomed, Seoul, Corea) e sovrapposti da un ABBM, Bio-Oss o A-Oss, in un rapporto di volume 1:1 per il mantenimento del contorno. La parte di ancoraggio, che collega l'impianto e la rete in titanio ultrafine preformata, è stata serrata a mano sull'impianto, e la rete in titanio ultrafine selezionata è stata applicata su questo ancoraggio per contenere tutto il materiale di innesto (Figura 3). Se l'impianto è stato inserito con una coppia di serraggio
≤30 Ncm o un valore di quotiente di stabilità dell'impianto ≤70, il cappuccio di copertura è stato collegato alla rete di titanio secondo un approccio sommerso. In caso contrario, il cappuccio di guarigione è stato immediatamente collegato secondo un approccio non sommerso. Una membrana di collagene assorbibile (OssGuide, SK Bioland, Cheonan, Corea) o OssMem hard (Osstem) è stata adattata sulla rete di titanio per ridurre al minimo il rischio di assottigliamento della gengiva sovrastante, che potrebbe portare all'esposizione precoce della rete di titanio. Il periostio del lembo a pieno spessore è stato rilasciato per una chiusura primaria della ferita senza tensione. I pazienti hanno ricevuto analgesici e antibiotici per 10 giorni per controllare il dolore postoperatorio e l'infezione. Sono stati prescritti anche risciacqui con clorexidina due volte al giorno. I punti sono stati rimossi 10 giorni dopo l'intervento chirurgico.
Otto mesi dopo l'intervento, è stata eseguita una chirurgia di re-entry utilizzando un design di lembo simile sotto anestesia locale. Dopo la rimozione della rete di titanio, la densità ossea è stata valutata in base alla profondità di sondaggio, misurata nell'osso rigenerato sotto il centro medio della rete di titanio, utilizzando una forza controllata di 0,25 N (Figura 2c). Il cappuccio di copertura o il cappuccio di guarigione è stato sostituito da un abutment di guarigione, e i lembi sono stati regolati e suturati. I punti sono stati rimossi 10 giorni dopo l'intervento. Dopo la chirurgia di re-entry, il tessuto molle attorno all'abutment di guarigione è stato lasciato guarire prima della presa dell'impronta. Una singola restaurazione temporanea è stata incorporata con l'abutment personalizzato in titanio per un carico progressivo, e la restaurazione finale è stata consegnata 12 mesi dopo l'intervento. Eventuali sequel postoperatori nelle procedure GBR sono stati registrati secondo la precedente classificazione delle complicazioni GBR e trattati dallo stesso chirurgo (C.-J.P.).
Valutazione del Volume Innestato
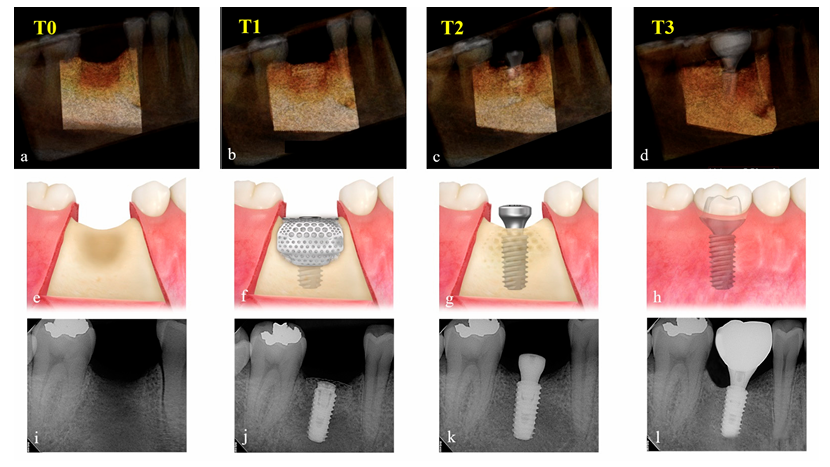
Le variazioni nel volume aumentato del materiale di innesto sono state valutate confrontando i dati CBCT ottenuti preoperatoriamente (T0), immediatamente dopo l'intervento chirurgico per l'impianto e GBR (T1), dopo l'intervento di re-entry (T2) e dopo la consegna della restaurazione finale (T3). I parametri di esposizione per la scansione CBCT (campo visivo 35 × 50 mm; dimensione del voxel 0.2 mm; tempo 10.8 s; kV 75; mA 10; prodotto dose area 240 mGy·cm2) sono stati impostati il più bassi possibile (ALARA). Utilizzando il software Aquarium iNtuition (TeraRecon, Durham, NC, USA), il sito dell'impianto è stato ricostruito in un'immagine tridimensionale e segmentato come una regione di interesse (ROI) utilizzando strutture anatomiche vicine, come denti adiacenti, pavimento del seno e canale alveolare inferiore. I compartimenti, che sono radiologicamente uniformi in densità e dimensione, come il corpo dell'impianto e l'abutment di guarigione, sono stati sottratti e il volume (cc) nella ROI è stato calcolato in base ai periodi di tempo (Figura 4) da un esaminatore indipendente e cieco (K.-G.H.). Poiché questo software è ampiamente utilizzato nel campo medico per rilevare con precisione la porzione occlusa dei principali vasi e misurare accuratamente il volume dell'organo per il trapianto, è stato applicato per questo studio per misurare il volume della ROI per integrare la tecnologia CT.
Analisi Statistica
La dimensione del campione è stata determinata per soddisfare il 90% di potenza del test con un minimo di α = 0,05 secondo l'assunzione di varianza uguale basata sui mezzi intra-soggetto e inter-soggetto dello studio controllato randomizzato precedente che confrontava Bio-Oss e l'ABBM rivestito in fosfato di calcio nell'aumento del seno. Sulla base di questi risultati, la dimensione minima del campione è stata stimata in 9 soggetti per ciascun gruppo, considerando un possibile tasso di abbandono del 10% durante il periodo di studio.
Il modello a effetti misti è stato utilizzato per esaminare le differenze nei cambiamenti di volume innestato tra i gruppi Bio-Oss e A-Oss con l'aggiustamento per le covariate, dove i cambiamenti di volume innestato sono stati misurati in tre periodi di tempo consecutivi così come al basale (T0). La significatività degli effetti delle covariate e i cambiamenti di volume innestato previsti
sono stati testati a α = 0,05. Inoltre, le statistiche descrittive sulle informazioni generali dei pazienti al basale sono state riassunte con il numero di casi e la percentuale per le variabili categoriali e con la media ± deviazione standard per le variabili continue.
Tutte le analisi statistiche sono state eseguite utilizzando SAS, versione 9.4 (SAS Inc., Cary, NC, USA). La significatività statistica è stata impostata come p < 0.05.
Risultati
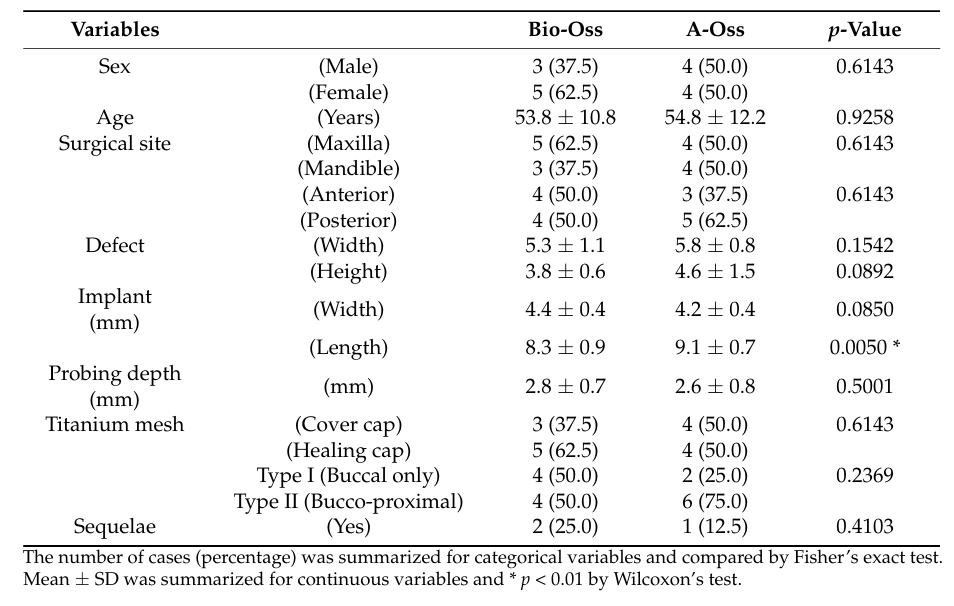
Un totale di 18 pazienti è stato arruolato consecutivamente e due pazienti hanno abbandonato (uno in ciascun gruppo) a causa della perdita di follow-up. Infine, i dati di 16 pazienti (7 uomini e 9 donne) con un'età media di 54.3 ± 11.7 anni (range da 28 a 72 anni) sono stati raccolti e valutati in questo studio (Tabella 1). Il confronto demografico tra i due gruppi è mostrato nella Tabella 2. C'era una differenza significativa tra i gruppi Bio-Oss e A-Oss solo in termini di lunghezza dell'impianto (p < 0.01).
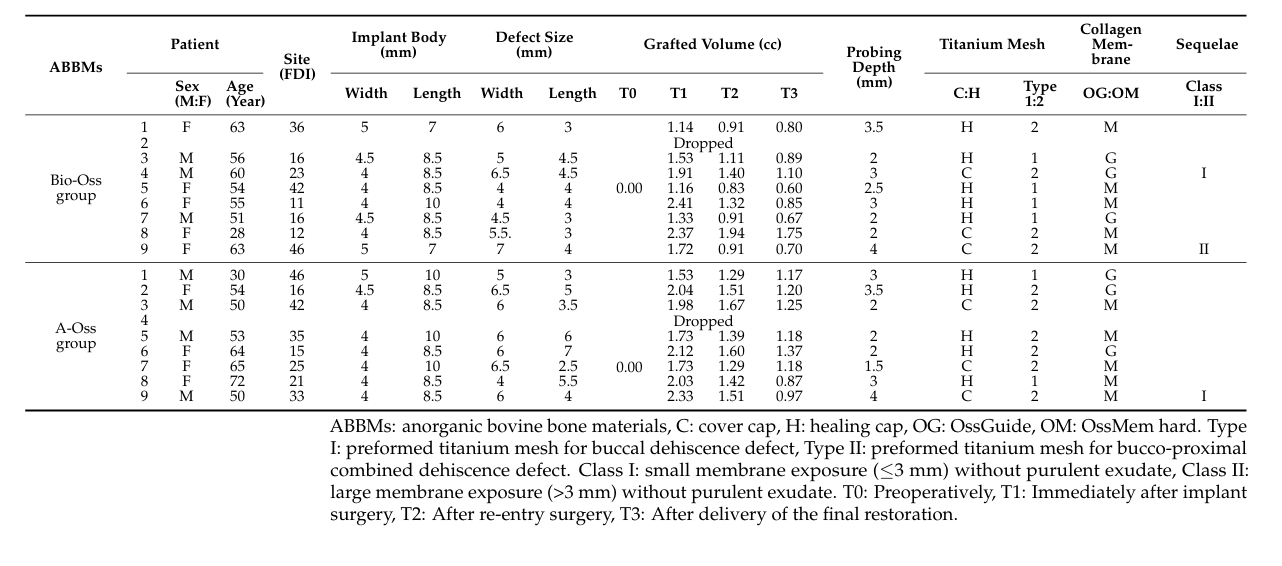
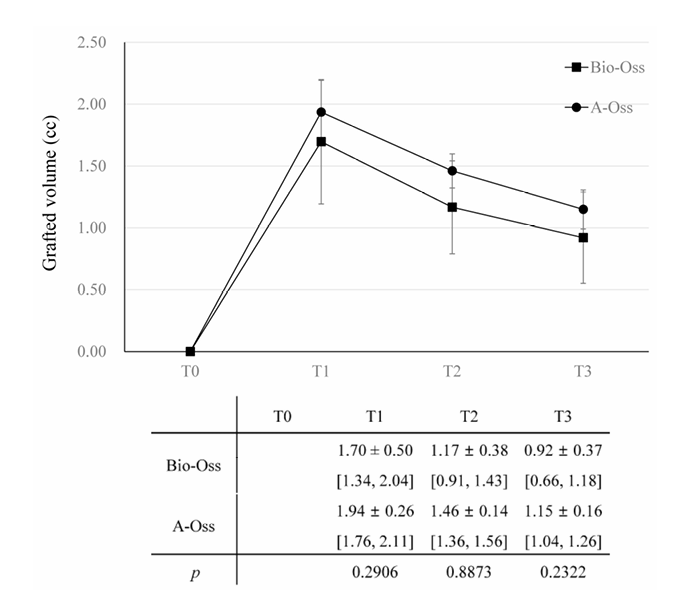
In entrambi i gruppi, il volume innestato, che ha raggiunto il picco di 1.70 ± 0.50 cc nel gruppo Bio-Oss e 1.94 ± 0.26 cc nel gruppo A-Oss a T1, ha continuato a ridursi fino a T3. I volumi innestati sono scesi a 1.17 ± 0.38 cc nel gruppo Bio-Oss e 1.46 ± 0.14 cc nel gruppo A-Oss a T2 e 0.92 ± 0.37 cc nel gruppo Bio-Oss e 1.15 ± 0.16 cc nel gruppo A-Oss a T3; c'era una differenza significativa nei volumi innestati tra i periodi di tempo (p < 0.001, Tabella 3). Tuttavia, non c'era alcuna differenza significativa tra i due gruppi in tutti i periodi di tempo (p > 0.05, Figura 5). Inoltre, non c'era alcuna differenza significativa nelle densità dell'osso rigenerato a T3 tra i gruppi (p > 0.05).

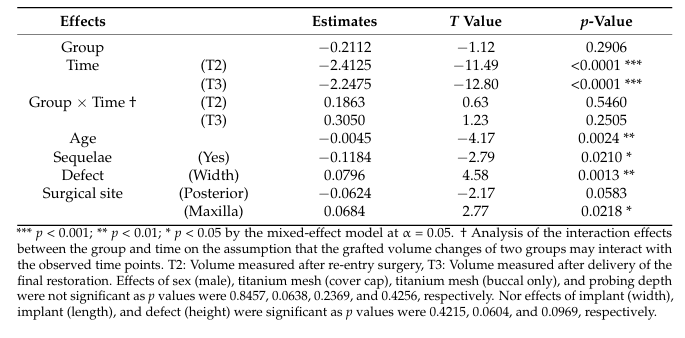
Nell'analisi del modello a effetti misti, T2 e T3 come periodi di tempo (p < 0.001), età avanzata (p < 0.01) e l'esistenza di sequele (p < 0.05) hanno indicato decrementi significativi nel volume innestato; al contrario, difetti più ampi (p < 0.01) e la mascella come sito chirurgico (p < 0.05) hanno portato a minori decrementi nel volume innestato (Tabella 4). Sequele postoperatorie sono state notate in tre pazienti, con due pazienti (Classe I e II nei siti di sutura crestal) nel gruppo Bio-Oss e uno (Classe I al bordo bucco-mesiale della rete) nel gruppo A-Oss. Tutte le sequele postoperatorie si sono verificate in casi sommersi con cappucci di copertura, e non c'era differenza significativa tra i due gruppi. Ai pazienti è stato istruito di spazzolare la rete con attenzione e delicatezza con uno spazzolino morbido imbevuto di gel di clorexidina al 1% due volte al giorno. Nonostante non ci fosse re-epitelizzazione a coprire l'area esposta della rete, la rimozione prematura di queste reti esposte non era necessaria, e la riesposizione dei fili dell'impianto e la grave perdita del materiale di innesto con suppurazione non sono state osservate durante l'intero periodo di guarigione; non è stato necessario alcun innesto aggiuntivo a T2.
Discussione
Questo studio controllato randomizzato è stato progettato per valutare il potenziale di A-Oss nel mantenere la quantità e la qualità ossea dell'osso rigenerato tramite GBR come ABBM sinterizzato a bassa temperatura rispetto a Bio-Oss, e l'ipotesi nulla di nessuna differenza è stata accettata. Nonostante l'uso di ABBM stabili nel volume, un totale del 46,0% (0,78 ± 0,37 cc) e del 40,8% (0,79 ± 0,33 cc) dei volumi innestati sono stati persi durante il processo di sostituzione con nuovo osso nei gruppi Bio-Oss e A-Oss, rispettivamente. Una possibile spiegazione per una maggiore riassorbimento oltre le aspettative è che il volume innestato misurato a T1 era chiaramente delineato da una sottile rete di titanio radiopaca sulle scansioni CBCT, mentre la periferia radiologica indistinta tra i materiali di innesto e il tessuto molle ha portato a una sottovalutazione del volume innestato dopo la rimozione della rete di titanio sia a T2 che a T3. Rispetto al 17,3~23,9% di perdita di volume innestato fino a 6 mesi post-operatori dopo l'intervento di sollevamento del seno, si presume che la contrazione del volume innestato dopo GBR sia stata maggiore perché la pressione complessiva del tessuto molle sovrastante potrebbe essere più alta della pressione pneumatica intrasinusale. Sono state effettuate solo misurazioni lineari per valutare lo spessore della regione aumentata tramite GBR in scansioni CBCT limitate, e i nostri risultati non sono sorprendenti, considerando che la riduzione lineare variava dal 20,2% al 42,8% alla spalla dell'impianto dopo l'innesto di Bio-Oss. Tuttavia, dobbiamo ammettere che c'era un costante rischio di errori di misurazione derivanti da artefatti metallici poiché vari componenti metallici, come un corpo di impianto e una rete di titanio, esistevano simultaneamente in CBCT.
Concentrandosi sul cambiamento del volume innestato, gli effetti dell'esistenza di sequele e del sito chirurgico hanno mostrato differenze statisticamente significative (p < 0.05). In altre parole, se il GBR aveva complicazioni postoperatorie o il sito chirurgico era posteriore (rispetto ad anteriore, p = 0.0583) e non il mascellare (rispetto alla mandibola), era più probabile che si verificasse una maggiore riassorbimento del volume innestato. L'area posteriore mandibolare è generalmente composta da osso duro con una corteccia più spessa, e il risultato dell'augmented bone è meno prevedibile anche se combinato con ampie aperture del midollo osseo. Inoltre, gli effetti dell'età e della larghezza del difetto hanno mostrato anch'essi differenze significative (p < 0.01), il che significa che i pazienti più anziani e i difetti di deiscenza più stretti mostreranno probabilmente un maggiore riassorbimento del volume innestato. I pazienti più anziani tendevano a presentare un rischio maggiore di fallimento dell'impianto con minori potenzialità di rigenerazione ossea dopo GBR, e c'era meno riassorbimento nel sito GBR poiché più materiali per innesto osseo erano imballati in difetti più ampi e protetti in modo sicuro da una rete di titanio massimizzando la proprietà di stabilità del volume degli ABBM. La rete di titanio ultrafine preformata era adatta per il contorno osseo ideale, particolarmente a livello della parte superiore dell'impianto, prevenendo il collasso dell'innesto. Supponendo che il difetto peri-impianto si trovi all'interno della sede ossea originale, i difetti di tipo fenestrazione hanno mostrato un maggiore riempimento osseo e meno complicazioni rispetto ai difetti di deiscenza. Pertanto, non possiamo trovare l'influenza significativa dell'altezza del difetto sul cambiamento del volume innestato.
In contrasto con l'ABBM per la preservazione del volume, i materiali di innesto osseo allogenico hanno mostrato una robusta formazione ossea con isole di nuovo osso che potrebbero essere interpretate come evidenza di induzione ossea e sembravano essere in uno stato di turnover e sostituzione più attivo. Una tecnica di stratificazione che utilizza diversi materiali di innesto è comunemente applicata per aumentare l'osso alveolare deiscente o carente attorno agli impianti dentali. In generale, l'osso autologo è stato utilizzato come strato interno in stretto contatto con l'impianto; tuttavia, l'osso allogenico è stato utilizzato anche quando il volume di prelievo di osso autologo non era adeguato. In questo studio, uno strato esterno di ABBM è stato posizionato sull'innesto allogenico per preservare e mantenere l'osso aumentato, e un terzo strato di membrana di collagene assorbibile è stato posizionato per prevenire l'invasione dei tessuti molli e delle cellule non osteogeniche nel sito innestato. In considerazione della necessità di una membrana barriera, è stata utilizzata una rete di titanio per la capacità di creare spazio e stabilizzare i coaguli di sangue, e la membrana di collagene assorbibile sovrastante è stata utilizzata per l'occlusività cellulare per prevenire l'assottigliamento prematuro della gengiva sovrastante separando completamente i compartimenti per la rigenerazione ossea ed epiteliale. Come membrana barriera non assorbibile, la rimozione della rete di titanio è inevitabile; tuttavia, la chirurgia di re-inserimento per rimuoverla è un'ottima opportunità per valutare la quantità e la qualità dell'osso rigenerato per determinare il successo della GBR. Comunemente, mentre la quantità di osso può essere valutata radiologicamente tramite ricostruzione tridimensionale delle scansioni CBCT nel sito GBR, la qualità dell'osso è stata valutata istologicamente o istomorfometricamente ottenendo e analizzando la biopsia del core osseo dalla cresta rigenerata. Tuttavia, nel nostro studio, la qualità dell'osso è stata valutata grossolanamente valutando la corticalizzazione del sito GBR utilizzando la profondità di sondaggio durante il re-inserimento poiché era tecnicamente difficile o frequentemente impossibile ottenere il campione osseo dal sito peri-implantare ricostruito. Dopo la rimozione della rete di titanio, un'ispezione più ravvicinata del sito guarito ha rivelato tessuto duro rigenerato superficialmente coperto da uno strato sottile di tessuto molle spesso 1–2 mm. Questo strato è stato descritto come "pseudo-periosteo" e il significato clinico di questo strato di tessuto connettivo e di granulazione istologicamente è sconosciuto; tuttavia, questo strato sottile sembra stabile nelle dimensioni, e la sua rimozione non è stata indicata durante il re-inserimento. Nel nostro studio, le profondità di sondaggio di 2.8 ± 0.7 mm e 2.6 ± 0.8 mm nei gruppi Bio-Oss e A-Oss, rispettivamente, potrebbero essere lo spessore dell'osso immaturo, incluso il "pseudo-periosteo", durante il processo di corticalizzazione sotto la rete di titanio. Questo approccio per valutare la qualità dell'osso rigenerato è ritenuto essere la principale limitazione del nostro studio e ulteriori indagini istologiche e istomorfometriche saranno necessarie per analizzare in dettaglio l'osso rigenerato.
Anche se non si è verificata re-epitelizzazione in piccole (2 pazienti) e grandi (1 paziente) esposizioni di rete di titanio senza essudato purulento durante il periodo di guarigione, non è stata osservata perdita di materiale di innesto, e non è stata indicata la rimozione prematura della rete di titanio esposta né innesti supplementari. Tuttavia, la profondità di sondaggio è aumentata fino a 3~4 mm a causa della presenza compensativa di un “pseudo-periosteo” più spesso, che era coinvolto nel mantenere il materiale di innesto contenuto in modo sicuro nei casi di rete di titanio esposta. Uno studio precedente ha anche confermato che l'esposizione alla rete di titanio non ha avuto un'influenza negativa sull'esito clinico della procedura di aumento e sul successo della procedura di innesto osseo. In particolare, tutte le sequele post-operatorie si sono verificate nei casi in cui la rete di titanio era fissata e stabilizzata con cappucci di copertura, sebbene non fosse statisticamente significativo. Poiché i cappucci di copertura erano collegati all'impianto con bassa stabilità primaria nel nostro studio, una maggiore tensione derivante da un tessuto molle meno ridondante potrebbe essere attribuita a una maggiore incidenza di deiscenza della ferita post-operatoria nell'approccio sommerso rispetto all'approccio non sommerso. Non c'era differenza significativa nelle sequele post-operatorie tra i gruppi Bio-Oss e A-Oss.
Conclusioni
All'interno delle limitazioni di questo studio, si può concludere che
- Un difetto di deiscenza peri-implantare è stato ricostruito con successo tramite GBR con doppio strato di allograft e ABBM, coperti da una rete di titanio ultrafine preformata e una membrana di collagene assorbibile;
- Nonostante l'effetto di mantenimento del volume delle ABBM, è stata osservata una resorbimento del volume innestato di circa il 27,8% a T2, e non c'era differenza significativa tra i gruppi Bio-Oss e A-Oss, anche nella qualità dell'osso rigenerato;
- La perdita di volume innestato (circa il 43,2%) è continuata fino a T3 e non ha mostrato differenze tra i gruppi Bio-Oss e A-Oss.
JaeHyung Lim, SangHo Jun, Marco Tallarico, Jun-Beom Park, Dae-Ho Park, Kyung-Gyun Hwang e Chang-Joo Park
Riferimenti
- Pjetursson, B.E.; Thoma, D.; Jung, R.; Zwahlen, M.; Zembic, A. Una revisione sistematica dei tassi di sopravvivenza e delle complicazioni delle protesi dentali fisse supportate da impianti (FDP) dopo un periodo medio di osservazione di almeno 5 anni. Clin. Oral Implant. Res. 2012, 23, 22–38. [CrossRef] [PubMed]
- Urban, I.; Caplanis, N.; Lozada, J.L. Rigenerazione ossea guidata verticale simultanea e rigenerazione tissutale guidata nella mascella posteriore utilizzando fattore di crescita derivato da piastrine umane ricombinante: Un rapporto di caso. J. Oral Implantol. 2009, 35, 251–256. [CrossRef]
- Adeyemo, W.; Reuther, T.; Bloch, W.; Korkmaz, Y.; Fischer, J.H.; Zöller, J.E.; Kuebler, A.C. Guarigione di innesti ossei mandibolari onlay coperti con membrana di collagene o sostituti ossei bovini: Uno studio microscopico e immunoistochimico negli ovini. Int. J. Oral Maxillofac. Surg. 2008, 37, 651–659. [CrossRef] [PubMed]
- Block, M.S.; Kaleem, A. Uso di xenograft sinterizzato sopra allograft per l'aumento del rialzo: Nota tecnica. J. Oral Maxillofac. Surg. 2014, 72, 496–502. [CrossRef] [PubMed]
- Buser, D.; Chappuis, V.; Kuchler, U.; Bornstein, M.; Wittneben, J.; Buser, R.; Cavusoglu, Y.; Belser, U.C. Stabilità a lungo termine del posizionamento precoce degli impianti con aumento del contorno. J. Dent. Res. 2013, 92, 176S–182S. [CrossRef] [PubMed]
- Jensen, S.S.; Bosshardt, D.D.; Gruber, R.; Buser, D. Stabilità a lungo termine dell'aumento del contorno nella zona estetica: Valutazione istologica e istomorfometrica di 12 biopsie umane 14-80 mesi dopo l'aumento. J. Periodontol. 2014, 85, 1549–1556. [CrossRef] [PubMed]
- Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Analisi comparativa radiologica tra riempimento con soluzione salina e fibrina ricca di piastrine dopo sollevamento idraulico del seno trascrestale senza innesto osseo aggiuntivo: Uno studio controllato randomizzato. Clin. Oral Implant. Res. 2020, 31, 1087–1093. [CrossRef]
- Nevins, M.; Nevins, M.L.; Kim, S.-W.; Schupbach, P.; Kim, D.M. L'uso della matrice di collagene mucograft per aumentare la zona di tessuto cheratinizzato attorno ai denti: Uno studio pilota. Int. J. Periodontics Restor. Dent. 2011, 31, 367–373.
- Lee, J.S.; Shin, H.K.; Yun, J.H.; Cho, K.S. Studio clinico randomizzato di innesto del seno mascellare utilizzando minerale osseo porcinico e bovino deproteinizzato. Clin. Implant. Dent. Relat. Res. 2017, 19, 140–150. [CrossRef] [PubMed]
- Susin, C.; Lee, J.; Fiorini, T.; Koo, K.T.; Schüpbach, P.; Angst, P.D.; Finger Stadler, A.; Wikesjö, U.M. Screening di biomateriali candidati per l'aumento alveolare utilizzando un modello di difetto calvariale critico nei ratti. J. Clin. Periodontol. 2018, 45, 884–893. [CrossRef]
- Amara, H.B.; Lee, J.-W.; Kim, J.-J.; Kang, Y.-M.; Kang, E.-J.; Koo, K.-T. Influenza di rhBMP-2 sulla Rigenerazione Ossea Guidata per il posizionamento e il carico funzionale degli impianti dentali: Uno studio radiografico e istologico nei cani. Int. J. Oral Maxillofac. Implant. 2017, 32, e265–e276. [CrossRef] [PubMed]
- Cho, J.S.; Kim, H.S.; Um, S.H.; Rhee, S.H. Preparazione di un nuovo xenograft osseo bovino anorganico con bioattività e osteoconduttività migliorate. J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 855–869. [CrossRef] [PubMed]
- Her, S.; Kang, T.; Fien, M.J. Rete di titanio come alternativa a una membrana per l'aumento del rialzo. J. Oral Maxillofac. Surg. 2012, 70, 803–810. [CrossRef]
- Louis, P.J.; Gutta, R.; Said-Al-Naief, N.; Bartolucci, A.A. Ricostruzione della mascella e della mandibola con innesto osseo particolato e rete di titanio per il posizionamento degli impianti. J. Oral Maxillofac. Surg. 2008, 66, 235–245. [CrossRef] [PubMed]
- Rakhmatia, Y.D.; Ayukawa, Y.; Furuhashi, A.; Koyano, K. Membrane barriera attuali: Rete di titanio e altre membrane per la rigenerazione ossea guidata nelle applicazioni dentali. J. Prosthodont. Res. 2013, 57, 3–14. [CrossRef]
- Jung, G.-U.; Jeon, J.-Y.; Hwang, K.-G.; Park, C.-J. Valutazione preliminare di una rete di titanio tridimensionale, personalizzata e preformata nella rigenerazione ossea alveolare peri-implantare. J. Korean Assoc. Oral Maxillofac. Surg. 2014, 40, 181. [CrossRef]
- Lee, S.-H.; Moon, J.-H.; Jeong, C.-M.; Bae, E.-B.; Park, C.-E.; Jeon, G.-R.; Lee, J.-J.; Jeon, Y.-C.; Huh, J.-B. Le proprietà meccaniche e l'effetto biometrico della membrana di titanio preformata 3D per la rigenerazione ossea guidata su difetti ossei alveolari. BioMed Res. Int. 2017, 2017, 7102123. [CrossRef]
- Tallarico, M.; Ceruso, F.M.; Muzzi, L.; Meloni, S.M.; Kim, Y.-J.; Gargari, M.; Martinolli, M. Effetto del posizionamento immediato dell'impianto e della ricostruzione ossea guidata con membrane di titanio ultrafine sui parametri radiografici e clinici dopo 18 mesi di carico. Materials 2019, 12, 1710. [CrossRef] [PubMed]
- Fontana, F.; Maschera, E.; Rocchietta, I.; Simion, M. Classificazione clinica delle complicazioni nelle procedure di rigenerazione ossea guidata mediante una membrana non riassorbibile. Int. J. Periodontics Restor. Dent. 2011, 31, 265.
- Liyanage, L.; Lee, N.J.; Cook, T.; Herrmann, H.C.; Jagasia, D.; Litt, H.; Han, Y. L'impatto del genere sulla calcificazione del sistema cardiovascolare in pazienti molto anziani con stenosi aortica severa. Int. J. Cardiovasc. Imaging 2016, 32, 173–179. [CrossRef]
- Lodewick, T.M.; Arnoldussen, C.W.; Lahaye, M.J.; van Mierlo, K.M.; Neumann, U.P.; Beets-Tan, R.G.; Dejong, C.H.; van Dam, R.M. Volumetria epatica rapida e accurata prima della epatectomia. HPB 2016, 18, 764–772. [CrossRef] [PubMed]
- Pang, K.-M.; Lee, J.-K.; Choi, S.-H.; Kim, Y.-K.; Kim, B.-J.; Lee, J.-H. Aumento del seno mascellare con osso bovino anorganico rivestito di fosfato di calcio: Studio clinico randomizzato multicentrico comparativo con valutazione istologica e radiografica. Implant. Dent. 2019, 28, 39–45. [CrossRef] [PubMed]
- Mir-Mari, J.; Wui, H.; Jung, R.E.; Hämmerle, C.H.; Benic, G.I. Influenza della chiusura della ferita cieca sulla stabilità del volume di diversi materiali GBR: Un esame tomografico cone-beam in vitro. Clin. Oral Implant. Res. 2016, 27, 258–265. [CrossRef] [PubMed]
- Ohe, J.Y.; Kim, G.T.; Lee, J.W.; Al Nawas, B.; Jung, J.; Kwon, Y.D. Stabilità del volume di materiale per innesto osseo bifasico di idrossiapatite e β-tricalcio fosfato nell'elevazione del pavimento del seno mascellare: Uno studio radiografico utilizzando tomografia computerizzata cone beam 3D. Clin. Oral Implant. Res. 2016, 27, 348–353. [CrossRef] [PubMed]
- Mir-Mari, J.; Benic, G.I.; Valmaseda-Castellón, E.; Hämmerle, C.H.; Jung, R.E. Influenza della chiusura della ferita sulla stabilità del volume di materiali GBR particolati e non particolati: Un esame tomografico cone-beam in vitro. Parte II. Clin. Oral Implant. Res. 2017, 28, 631–639. [CrossRef] [PubMed]
- Esposito, M.; Maghaireh, H.; Grusovin, M.G.; Ziounas, I.; Worthington, H.V. Gestione dei tessuti molli per impianti dentali: Quali sono le tecniche più efficaci? Una revisione sistematica Cochrane. Eur. J. Oral. Implant. 2012, 5, 221–238.
- Jemt, T. Fallimenti degli impianti e età al momento dell'intervento: Uno studio retrospettivo sul trattamento implantare in 2915 mascelle parzialmente edentule. Clin. Implant. Dent. Relat. Res. 2019, 21, 686–692. [CrossRef] [PubMed]
- Jensen, S.S.; Terheyden, H. Procedure di aumento osseo in difetti localizzati nel rialzo alveolare: Risultati clinici con diversi innesti ossei e materiali sostitutivi ossei. Int. J. Oral Maxillofac. Implant. 2009, 24, 218–236.
- Scheyer, E.T.; Heard, R.; Janakievski, J.; Mandelaris, G.; Nevins, M.L.; Pickering, S.R.; Richardson, C.R.; Pope, B.; Toback, G.; Velásquez, D.; et al. Uno studio clinico controllato randomizzato multicentrico di preservazione del rialzo alveolare post-estrazione. J. Clin. Periodontol. 2016, 43, 1188–1199. [CrossRef]
- Wang, H.-L.; Misch, C.; Neiva, R.F. Tecnica di aumento osseo “sandwich”: Razionale e rapporto di casi pilota. Int. J. Periodontics Restor. Dent. 2004, 24, 232–245.
- Sarnachiaro, G.O.; Chu, S.J.; Sarnachiaro, E.; Gotta, S.L.; Tarnow, D.P. Posizionamento immediato dell'impianto in socket di estrazione con difetti di deiscenza della piastra labiale: Una serie di casi clinici. Clin. Implant. Dent. Relat. Res. 2016, 18, 821–829. [CrossRef]
- Meloni, S.M.; Jovanovic, S.A.; Urban, I.; Baldoni, E.; Pisano, M.; Tallarico, M. Aumento orizzontale del rialzo utilizzando GBR con una membrana di collagene nativo e un rapporto 1:1 di xenograft particolato e osso autologo: Uno studio clinico prospettico a 3 anni dopo il carico finale. Clin. Implant. Dent. Relat. Res. 2019, 21, 669–677. [CrossRef] [PubMed]
- Cucchi, A.; Sartori, M.; Parrilli, A.; Aldini, N.N.; Vignudelli, E.; Corinaldesi, G. Analisi istologica e istomorfometrica del tessuto osseo dopo rigenerazione ossea guidata con membrane non riassorbibili vs membrane riassorbibili e rete di titanio. Clin. Implant. Dent. Relat. Res. 2019, 21, 693–701. [CrossRef]
- Proussaefs, P.; Lozada, J. Uso di rete di titanio per l'aumento localizzato a fasi: Valutazione clinica e istologica-istomorfometrica. J. Oral Implantol. 2006, 32, 237–247. [CrossRef]
- Sagheb, K.; Schiegnitz, E.; Moergel, M.; Walter, C.; Al-Nawas, B.; Wagner, W. Risultato clinico dell'aumento del rialzo alveolare con rete di titanio prodotta su misura CAD-CAM. Int. J. Implant. Dent. 2017, 3, 1–7. [CrossRef] [PubMed]
