Ruolo delle nuove superfici idrofile sul tasso di successo precoce e stabilità dell'impianto: risultati a 1 anno dopo il carico di uno studio controllato randomizzato multicentrico e split-mouth
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract
Obiettivo: Confrontare il fallimento precoce degli impianti e la stabilità degli impianti degli impianti Hiossen ET III a un solo stadio con la sua nuova superficie idrofila (NH), rispetto agli impianti Hiossen ET III con superficie sabbiata e acido-reattiva (SA) a un follow-up di 1 anno.
Materiali e Metodi: Questo studio è stato progettato come uno studio randomizzato controllato multicentrico a bocca divisa volto a confrontare gli impianti con superficie SA (gruppo SA) e quelli con superficie NH (gruppo NH). Gli esiti erano i tassi di sopravvivenza degli impianti e delle protesi, le complicazioni, la coppia di inserimento al posizionamento dell'impianto e i valori del quoziente di stabilità dell'impianto (ISQ).
Risultati: Ventuno pazienti (età media 59.9 ± 11.3 anni) sono stati trattati e seguiti fino a 1 anno dopo il carico. Nessun paziente ha abbandonato lo studio. Cinquantotto impianti (29 gruppo SA e 29 gruppo NH) sono stati posizionati. Nessun impianto o protesi ha fallito e non si sono verificate complicazioni durante il follow-up. La coppia di inserimento media era di 40.5 ± 3.23 (38.17–41.83) Ncm nel gruppo SA e 40.48 ± 3.49 (38.02–41.98) Ncm nel gruppo NH (p = 0.981). È stata trovata una differenza statisticamente significativa nella seconda settimana (T2) con valori più alti nel gruppo NH (p = 0.041). Risultati simili sono stati trovati nella mascella (p = 0.045), ma non nella mandibola (p = 0.362). È stata trovata una correlazione positiva tra la coppia di inserimento iniziale e l'ISQ con un valore più alto nel gruppo NH (0.73 vs. 0.66).
Conclusioni: Gli impianti NH sono un'alternativa valida alla superficie SA, poiché sembrano evitare il calo dell'ISQ durante la fase di rimodellamento osseo.
Introduzione
Il dentista moderno ha un'eccellente soluzione per risolvere l'edentulismo del paziente utilizzando impianti dentali. È stato dimostrato che gli impianti dentali hanno risultati di successo a lungo termine, rappresentando un'opzione valida per i clinici per riabilitare pazienti edentuli completi o parziali con soluzioni sia fisse che rimovibili. Albrektsson et al hanno introdotto il concetto di equilibrio del corpo estraneo, applicato all'osseointegrazione degli impianti dentali in titanio. Questo equilibrio è un bilanciamento della reazione immunitaria del corpo estraneo durante l'integrazione biologica degli impianti dentali nell'osso. Quando questo equilibrio si sposta a svantaggio, può verificarsi una perdita ossea periimplantare. Tuttavia, i fallimenti degli impianti potrebbero comunque verificarsi in un numero ridotto di pazienti compromessi, a causa della mancanza di una sufficiente comprensione dei fattori di rischio correlati.
Le cause della perdita ossea attorno agli impianti dentali e il conseguente fallimento dell'impianto possono essere diverse e correlate al macro-/microdesign dell'impianto e alla composizione chimica della superficie, a questioni biologiche, alla qualità dell'osso, alla tecnica chirurgica, ai fattori legati all'ospite e ai fattori iatrogeni. Il fallimento di un impianto dentale è stato classificato come precoce o tardivo a seconda del momento in cui si verifica. I fallimenti precoci degli impianti dentali si verificano prima della connessione del moncone, come conseguenza di una mancanza di integrazione con l'osso, e i fallimenti tardivi si verificano dopo il carico protesico, come conseguenza della peri-implantite indotta dalla placca e/o del sovraccarico occlusale. L'osseointegrazione attorno agli impianti in titanio è un fenomeno biologico complesso non ancora chiaramente compreso. Tuttavia, le modifiche superficiali degli impianti dentali in titanio svolgono ruoli importanti nel miglioramento dell'osseointegrazione. Con l'obiettivo di accelerare e migliorare il processo di osseointegrazione, sono stati proposti molti trattamenti superficiali per gli impianti. La modifica della superficie è focalizzata principalmente a migliorare chimicamente la rugosità degli impianti dentali per aumentare la risposta biologica appropriata tra i tessuti viventi e gli impianti dentali. Inoltre, oltre a migliorare l'osseointegrazione, queste modifiche superficiali degli impianti hanno dimostrato di aumentare la vitalità cellulare e la biocompatibilità.
Questo cambiamento topografico è ottenuto tramite trattamenti acidi, sabbiatura o diversi meccanismi di ossidazione.
Gli impianti dentali con superficie sabbiata e acido-reattiva (SA) presentano una macroruvidità ottenuta con particelle abrasive (sabbiatura) e micropit che migliorano l'osseointegrazione. La superficie SA fornisce uno spazio adeguato per l'adesione, la proliferazione e la differenziazione degli osteoblasti. Questo risultato può essere ulteriormente migliorato utilizzando un processo di doppia incisione che aumenta la superficie disponibile per la nuova crescita ossea, migliorando così notevolmente la fissazione meccanica. Maggiore è l'uso degli impianti dentali nella pratica odontoiatrica quotidiana, maggiore è l'interesse clinico per l'integrazione rapida degli impianti con l'osso affinché siano funzionali. Nell'ultimo decennio, c'è stato un impegno continuo per migliorare la superficie dell'impianto per accelerare il processo di osseointegrazione e migliorarne la qualità. Oggi, l'obiettivo è ridurre il periodo di guarigione da 6-8 settimane a 3-4 settimane in tutte le indicazioni. Questi sforzi si sono concentrati sul miglioramento dell'interfaccia osso-impianto chimicamente (incorporando fasi inorganiche sulla o all'interno dello strato di ossido di titanio) o fisicamente (aumentando il livello di ruvidità). Sebbene periodi di guarigione più brevi siano stati presentati in molti studi sperimentali e clinici utilizzando superfici sabbiate, a grana grossa e acido-reattive (SLA), la modifica di questa superficie sembra presentare una risposta ossea più forte rispetto al suo predecessore.
L'obiettivo di questo studio randomizzato controllato split-mouth era di confrontare il fallimento precoce dell'impianto e la stabilità dell'impianto degli impianti Hiossen ET III a una fase con la sua nuova superficie idrofila (NH), rispetto agli impianti Hiossen ET III con la ben nota superficie SA a un follow-up di 1 anno. L'ipotesi nulla era che non ci fosse differenza tra i gruppi. L'ipotesi nulla è stata testata contro l'ipotesi alternativa di differenze tra di essi. È stato pubblicato un rapporto preliminare da un centro. Il seguente studio è stato riportato secondo le linee guida della dichiarazione CONSORT (http://www.consort-statement.org/).
Materiali e Metodi
Questo studio è stato progettato come uno studio randomizzato controllato split-mouth di gruppi paralleli con due bracci e valutazione indipendente dei risultati quando possibile, condotto in quattro centri tra novembre 2017 e maggio 2018. Il protocollo è stato registrato nel clinicaltrial.gov (NCT03649100). È stata rispettata la dichiarazione di Helsinki del 2013. Lo studio è stato eseguito dopo aver ricevuto l'approvazione dal Comitato Etico dell'Università Aldent, Tirana, Albania (marzo 2018). Tutte le procedure chirurgiche e protesiche sono state eseguite da un clinico esperto in ciascun centro.
Qualsiasi paziente sano, di età pari o superiore a 18 anni, che necessitava di almeno due impianti per essere riabilitato con una protesi fissa supportata da impianti, con un indice di sanguinamento e un indice di placca orale ≤25%, con un osso sufficiente per consentire l'inserimento di impianti lunghi almeno 11,5 mm e una larghezza ossea di almeno 6-8 mm per l'inserimento di un impianto Hiossen ET III a piattaforma regolare (Deutsche Osstem GmbH, Eschborn, Germania) sono stati inclusi in questo studio. I criteri di esclusione sono riportati nella Tabella 1.
I pazienti sono stati informati sulle procedure cliniche, sui materiali da utilizzare, sui benefici, sui potenziali rischi e sulle potenziali complicazioni, così come su eventuali valutazioni di follow-up richieste per lo studio clinico. I pazienti dovevano firmare il consenso informato prima di essere inclusi nello studio.
Una singola dose di antibiotico (2 g di amoxicillina e acido clavulanico o clindamicina 600 mg se i pazienti erano allergici alla penicillina) è stata somministrata profilatticamente 1 ora prima dell'intervento chirurgico. I pazienti hanno sciacquato con clorexidina allo 0,2% per 1 minuto. L'anestesia locale sarà indotta utilizzando una soluzione di articaine al 4% con epinefrina 1:100.000 (Ubistesin; 3M Italia, Milano, Italia). Gli impianti sono stati posizionati nei siti anatomici pianificati utilizzando un approccio senza lembo o un mini-lembo. La densità ossea è stata valutata, secondo la classificazione di Lekholm e Zarb, durante la fase di perforazione, in base all'esperienza e al giudizio del clinico. Il sito dell'impianto è stato preparato simultaneamente, secondo il protocollo di perforazione raccomandato dal produttore (posizionato a livello subcrestale di 0,5 mm o più profondo in base alla qualità dell'osso e allo spessore dei tessuti molli). Gli impianti con superficie SA (gruppo SA) o gli impianti con superficie SA con un nuovo rivestimento nanostrutturato bioassorbibile in apatite (gruppo NH) sono stati randomizzati dopo la preparazione del sito dell'impianto, immediatamente prima del posizionamento dell'impianto. Gli impianti utilizzati in ogni gruppo erano identici tranne che per il trattamento superficiale. Gli impianti sono stati posizionati secondo un protocollo a una fase.
Il trattamento analgesico postschirurgico è stato effettuato con ibuprofene 600 mg, somministrato due volte al giorno per 2 giorni dopo l'intervento, e successivamente, se necessario. Le radiografie periapicali sono state eseguite con un supporto personalizzato al momento dell'inserimento dell'impianto, alla consegna della protesi definitiva (Figg. 1 e 2), e poi annualmente (Figg. 3 e 4). Due o tre mesi dopo l'inserimento degli impianti, i pazienti ricevono restauri a vite singola.
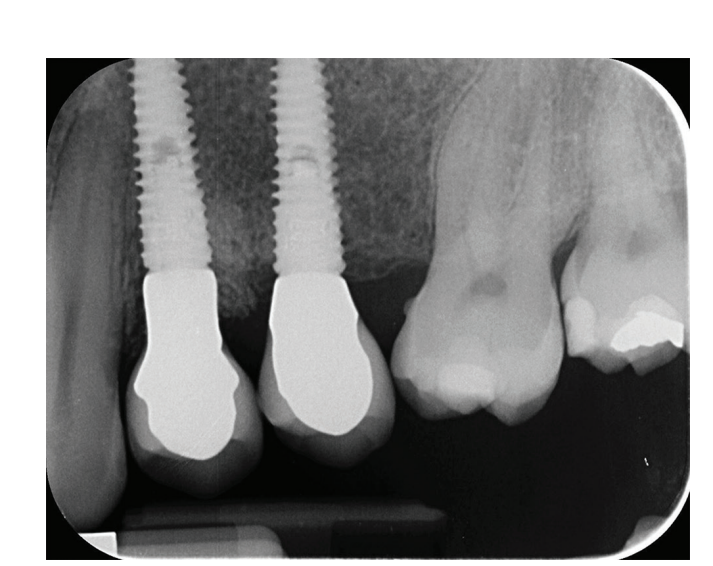
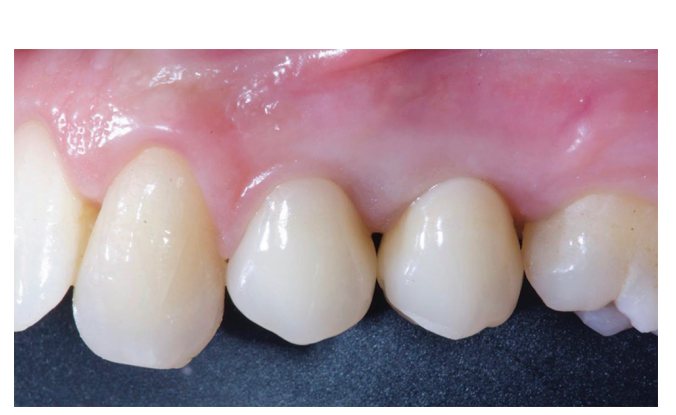
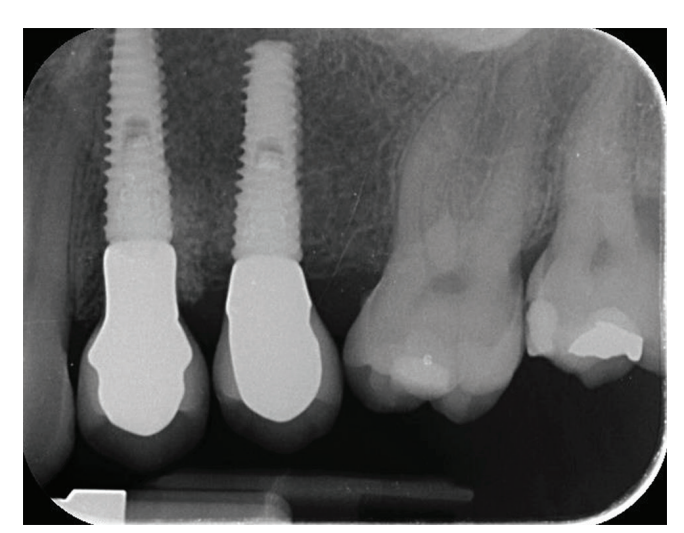
Le misure di esito erano i tassi di sopravvivenza degli impianti e delle protesi, eventuali complicazioni biologiche o meccaniche agli impianti che si sono verificate durante l'intero periodo di osservazione, la coppia di inserimento al posizionamento dell'impianto e l'indice di stabilità dell'impianto (ISQ).
I tassi di successo degli impianti e delle protesi sono stati valutati da un valutatore indipendente (E.X.). Un impianto è stato considerato un fallimento se presentava mobilità, valutata dopo il periodo di osteointegrazione battendo o oscillando la testa dell'impianto con le maniglie metalliche di due strumenti, perdita ossea marginale progressiva o infezione, o qualsiasi complicazione meccanica che rendesse l'impianto inutilizzabile, sebbene ancora meccanicamente stabile nell'osso. Una protesi è stata considerata un fallimento se doveva essere sostituita con un'altra protesi.
Complicazioni biologiche (dolore, gonfiore, suppurazione, ecc.) e/o meccaniche (allentamento delle viti, frattura del telaio, del materiale di rivestimento, ecc.) si sono verificate durante il periodo di follow-up. Le complicazioni sono state valutate e trattate dallo stesso chirurgo (M.T.).
La coppia di inserimento è stata registrata al momento dell'inserimento dell'impianto dallo stesso chirurgo (M.T.) utilizzando l'unità chirurgica iChiropro (Bien-Air, Bienne, Svizzera).
I valori della coppia di inserimento degli impianti sono stati misurati e registrati al momento dell'inserimento dell'impianto, utilizzando la stessa unità chirurgica utilizzata per posizionare gli impianti.
L'ISQ è stato misurato e registrato utilizzando un perno intelligente (Tipo 47 cod. 100478, Osstell, Göteborg, Svezia) collegato agli impianti, e il dispositivo Osstell Mentor (Osstell). Le misurazioni sono state effettuate al momento dell'inserimento dell'impianto e ogni settimana fino a 8 settimane dopo l'inserimento dell'impianto. In caso di valore ISQ <55 o in caso di mobilità dell'impianto, l'abutment di guarigione è stato sostituito con una vite di copertura e l'impianto è stato lasciato guarire sommerso per almeno 6 settimane.
Un valutatore cieco dei risultati ha raccolto i dati (E.X.), secondo uno studio precedentemente pubblicato.
È stata creata una lista casuale pregenerata, composta da una sequenza randomizzata di numeri consecutivi corrispondenti alle due diverse procedure all'interno del gruppo A o del gruppo B, utilizzando il generatore di numeri casuali pro 1.91 per Windows (Segobit Software; www.segobit.com). Buste opache contenenti i codici di randomizzazione sono state numerate in sequenza e sigillate. Secondo una lista pregenerata, un consulente indipendente, non precedentemente coinvolto nello studio, ha preparato tutte le buste e poi le ha aperte immediatamente dopo la preparazione dei siti implantari. Il sito uno è stato definito il sito con il numero di sestante più basso e il più mesiale. I pazienti e il statistico erano ciechi, mentre il medico no a causa della diversa opacità della superficie dell'impianto. I dati dei pazienti sono stati raccolti in un foglio di calcolo Excel (Microsoft) che rifletteva i parametri nelle cartelle cliniche dei pazienti. I dati sono stati esportati nel software SPSS per Mac OS X (versione 22.0; SPSS, Chicago, Illinois, Stati Uniti), per l'analisi statistica. È stata eseguita un'analisi descrittiva per i parametri numerici utilizzando medie e deviazioni standard (intervallo di confidenza del 95%). Le complicazioni e i fallimenti sono stati confrontati utilizzando il test esatto di Fisher. I confronti tra gruppi (SA vs. NH) e tra mascelle (mascella vs. mandibola) sono stati effettuati tramite t-test non appaiati, mentre il confronto tra il basale (T0) e l'ultimo follow-up (T8) è stato effettuato tramite t-test appaiati per rilevare eventuali cambiamenti durante il follow-up. Il coefficiente di correlazione di Pearson è stato utilizzato per valutare la correlazione tra la coppia di inserimento al momento dell'inserimento dell'impianto e il valore ISQ 8 settimane dopo l'inserimento dell'impianto. Tutti i confronti statistici sono stati bilaterali e condotti al livello di significatività dello 0,05. Il paziente è stato utilizzato come unità statistica di analisi.
Risultati
Solo tre dei quattro centri sono riusciti a reclutare e trattare i pazienti secondo il protocollo dello studio. Inizialmente, 39 pazienti sono stati sottoposti a screening, ma sei pazienti non sono stati inclusi perché non avevano sufficiente osso per consentire l'inserimento di impianti lunghi 11,5 mm e di diametro 4 mm; due pazienti non sono stati inclusi perché non volevano partecipare allo studio; e gli altri due pazienti erano forti fumatori. Un totale di 29 pazienti (22 femmine e sette maschi, con un'età media all'inserimento dell'impianto di 59,9 ± 11,3 anni) sono stati trattati secondo le interventi assegnati e seguiti fino a 1 anno dopo il carico. Nessun paziente ha abbandonato. Un totale di 58 impianti (29 con superficie SA e 29 con superficie SA con il nuovo rivestimento nanostrutturato bioassorbibile in apatite) sono stati posizionati. Diciotto pazienti sono stati riabilitati nella mascella e 11 nella mandibola. Un anno dopo il carico, nessun impianto e nessuna protesi sono falliti. Due settimane dopo l'inserimento dell'impianto, due impianti Hiossen ET III SA hanno mostrato una leggera mobilità con valori ISQ inferiori a 55 (49 e 51, rispettivamente). Gli abutment di guarigione sono stati sostituiti con viti di copertura e gli impianti sono stati lasciati a guarire indisturbati fino a 8 settimane dopo il loro posizionamento. Tuttavia, non è stata raggiunta alcuna differenza statisticamente significativa (p = 0,491). In entrambi gli impianti, gli abutment di guarigione sono stati sostituiti con una vite di copertura e gli impianti sono stati lasciati a guarire sommersi per 6 settimane (fino a 8 settimane dopo il posizionamento dell'impianto).
Il valore medio della coppia di inserimento variava tra 35,0 e 45,0 Ncm (media di 40,5 ± 3,23 [38,17–41,83] Ncm nel gruppo SA e 40,48 ± 3,49 [38,02–41,98] Ncm nel gruppo NH). La differenza tra i gruppi non era statisticamente significativa (p = 0,981).
Il confronto tra i valori ISQ è stato riportato nella Tabella 2 e nelle Figs. 5 a 7.
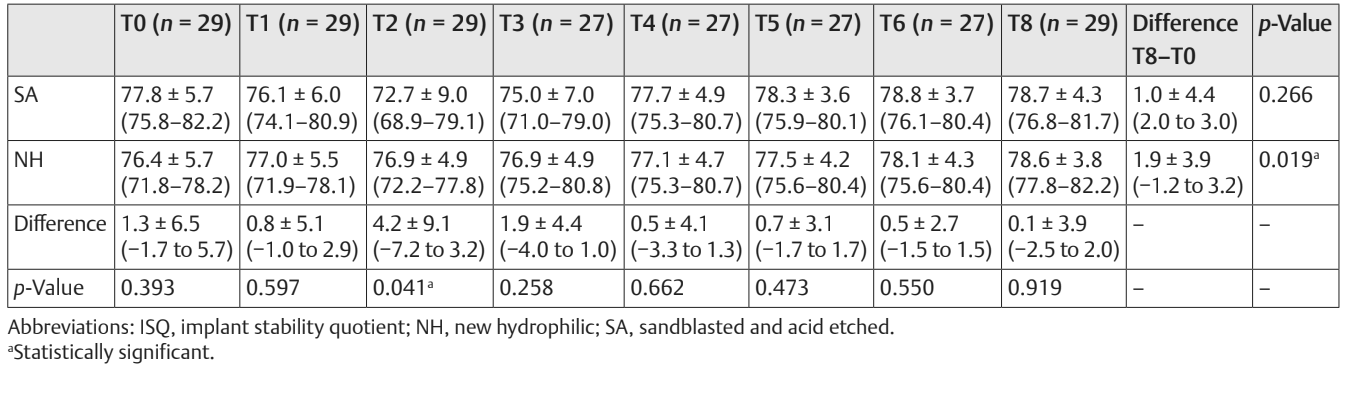
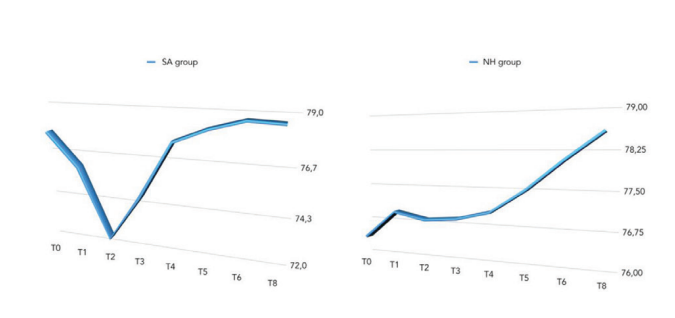
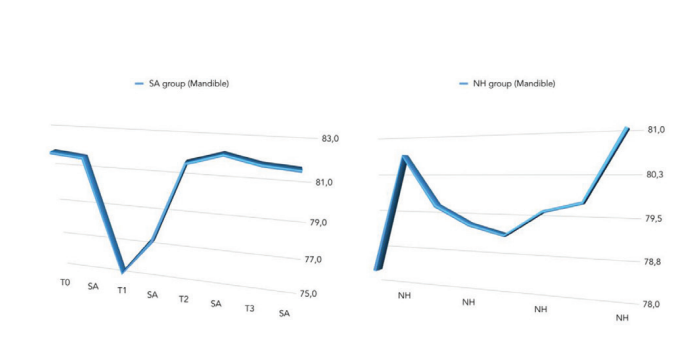
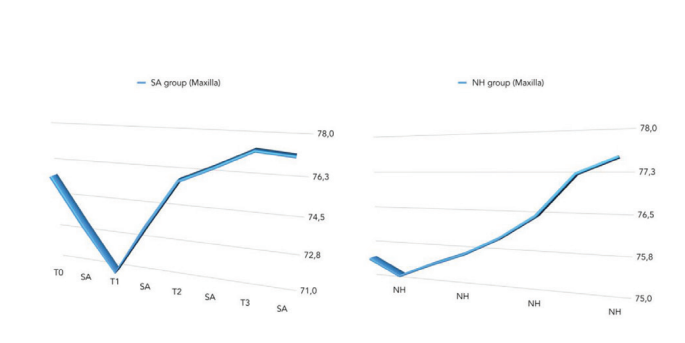
È stata riscontrata una differenza statisticamente significativa tra i gruppi nella seconda settimana dopo l'inserimento dell'impianto (T2) con valori più elevati nel gruppo NH (p = 0.041). Risultati simili sono stati trovati nella mascella superiore (p = 0.045), ma non nella mandibola (p = 0.362). Complessivamente, i valori di ISQ sono migliorati in entrambi i gruppi durante l'intero follow-up (8 settimane), con una differenza statisticamente significativa nel gruppo NH (p = 0.019), ma non nel gruppo SA (p = 0.266). È stata trovata una correlazione positiva tra la coppia di inserimento iniziale e l'ISQ con un valore più alto nel gruppo NH (0.73 vs. 0.66). La correlazione era più forte nella mandibola (SA = 0.71; NH = 0.86) rispetto alla mascella superiore (SA = 0.52; NH = 0.55).
Discussione
Ogni giorno si sta facendo un grande sforzo per migliorare l'interfaccia osso-impianto modificando la superficie degli impianti dentali per migliorare l'integrazione ossea e ridurre i tempi di questo processo per aiutare i clinici nel trattamento dei pazienti edentuli. Proprio in questo contesto è stato orientato il nostro studio; infatti, questo trial controllato randomizzato split-mouth mirava a confrontare il fallimento precoce dell'impianto e la stabilità dell'impianto degli impianti Hiossen ET III a un solo stadio con superficie NH, rispetto agli impianti Hiossen ET III con la ben nota superficie SA fino a 1 anno di follow-up. L'ipotesi nulla di nessuna differenza è stata parzialmente respinta a favore dell'ipotesi alternativa di differenza tra i gruppi.
In generale, il valore medio di ISQ è migliorato in entrambi i gruppi durante le 8 settimane di follow-up, ma i valori hanno mostrato una differenza statisticamente significativa solo nel gruppo NH (p = 0.019). La ragione è parzialmente dovuta al fatto che 2 settimane dopo il posizionamento degli impianti, il valore medio di ISQ era statisticamente significativo più alto nel gruppo NH rispetto al gruppo SA (p = 0.041). Una possibile spiegazione potrebbe essere i valori inaspettati di ISQ nel gruppo di impianti SA causati da due impianti che hanno mostrato valori <55 con una leggera mobilità dell'impianto. Di conseguenza, gli impianti sono stati lasciati a guarire sommersi per le successive 6 settimane. Tuttavia, si può quindi assumere che gli impianti con superficie idrofila (NH) sembrano ridurre le complicazioni evitando il calo di ISQ durante la fase di rimodellamento, consentendo così benefici nel carico immediato, nella scarsa qualità ossea, post-estrattiva e nel mascellare. Le principali limitazioni del presente trial controllato randomizzato sono la piccola dimensione del campione e il follow-up a breve termine. Sfortunatamente, un centro non ha partecipato allo studio, contribuendo alla piccola dimensione del campione.
Lo sforzo continuo delle aziende dentali per migliorare l'interfaccia tra osso e superficie dell'impianto per accelerare il processo di osseointegrazione è stato proposto da ricercatori e aziende di impianti dentali, e i dati sottolineati in questo documento, specialmente per la superficie NH, confermano la possibilità di ridurre i tempi nella terapia implantare. Oggi, la stabilità primaria dell'impianto e l'assenza di micromovimenti rimangono ancora due dei principali prerequisiti per ottenere una stabile osseointegrazione e il raggiungimento di alti tassi di successo a lungo termine. Al contrario, se durante il primo periodo di guarigione dell'impianto la stabilità primaria è insufficiente, può verificarsi un fallimento precoce dell'impianto.
Nello studio presente, è stata trovata una significatività statistica simile nella mascella (p = 0.045), ma non nella mandibola (p = 0.362). Per minimizzare il rischio di fallimento precoce dell'impianto, negli ultimi decenni è stato suggerito che gli impianti dovrebbero essere mantenuti senza carico durante un periodo di guarigione di 3-4 mesi nelle mandibole e 6-8 mesi nelle mascelle. Oggigiorno, più gli impianti vengono utilizzati nella routine clinica, maggiore è l'interesse clinico per gli impianti che si integrano rapidamente con l'osso per essere funzionali. Uno sforzo continuo per migliorare l'interfaccia tra osso e superficie dell'impianto per accelerare il processo di osseointegrazione è stato proposto da ricercatori e aziende di impianti dentali, modificando la rugosità e la topografia della superficie dell'impianto. Per comprendere meglio la rugosità degli impianti dentali, essa è comunemente suddivisa, a seconda delle dimensioni delle caratteristiche superficiali misurate, in rugosità macro-, micro- e nano-. Tutti questi tipi di rugosità e topografia hanno conseguenze dirette sulla risposta ossea durante il periodo di guarigione dei tessuti attorno agli impianti dentali. Oggigiorno, è ben noto che la rugosità dell'impianto migliora l'osseointegrazione e la maggior parte dei tipi di impianti sono sabbiati e/o acidificati per aumentare la loro texture superficiale. Inoltre, la rugosità a livello nanometrico ha un ruolo principale nell'assorbimento delle proteine, nell'adesione delle cellule osteoblastiche e quindi nel tasso di osseointegrazione. Inoltre, Schwarz et al hanno dimostrato che le superfici idrofile migliorano il processo di angiogenesi quando si verificano le fasi iniziali dell'osseointegrazione. In effetti, una rapida vascolarizzazione sembra essere benefica per la formazione ossea poiché è stato osservato che le cellule osteogeniche derivano dai periciti adiacenti ai piccoli vasi sanguigni. In una revisione di Wennerberg et al, sono state trovate poche evidenze cliniche per affermare chiaramente una preferenza per SLActive rispetto all'impianto SLA. Al follow-up di 1 anno, c'era un alto tasso di sopravvivenza (100% per SLActive contro 96% per gli impianti SLA) e una bassa perdita ossea crestal <0.4 mm in entrambi i gruppi senza differenze significative.
La letteratura recente suggerisce che una coppia di inserimento ottimale potrebbe essere attorno ai 30 Ncm per ottenere un'osseointegrazione di successo e duratura, che è anche sufficiente per consentire sia il carico occlusale convenzionale che immediato degli impianti dentali. Il motivo per cui le aziende di impianti dentali e i ricercatori si concentrano sui miglioramenti del design degli impianti e sulla modifica delle superfici è per aiutare sia i clinici che i pazienti ad accelerare i tempi di intervento chirurgico e di protesizzazione; per gli stessi motivi, i ricercatori si concentrano sulla odontoiatria digitale e nello sviluppo di linee guida nell'odontoiatria implantare.
Nello studio attuale, è stata trovata una correlazione positiva tra la coppia di inserimento iniziale e l'ISQ con un valore più alto nel gruppo NH (0.73 vs. 0.66). La correlazione era più forte nella mandibola (SA = 0.71; NH = 0.86) rispetto alla mascella (SA = 0.52; NH = 0.55). L'implicazione clinica di questo trial controllato randomizzato potrebbe essere che gli impianti con modifica della superficie NH potrebbero essere un'opzione importante nel trattamento dei pazienti, specialmente quando il momento del carico è cruciale. Considerando la correlazione positiva trovata tra un'alta coppia di inserimento e un aumento del livello di ISQ, e risultati migliori nella mascella, questo trattamento superficiale potrebbe essere un'opzione di trattamento valida in caso di carico immediato, scarsa qualità ossea (come nella mascella posteriore), impianti post-estrattivi, o pazienti ad alto rischio, come pazienti immunocompromessi o forti fumatori.
Conclusioni
Considerando le limitazioni di questo studio multicentrico, split-mouth, randomizzato controllato, gli impianti NH sono un'alternativa valida alla superficie SA, poiché sembrano evitare il calo dell'ISQ durante la fase di rimodellamento. Può essere utile nel carico immediato, nella scarsa qualità ossea, negli impianti post-estrattivi, nel fumo e nell'immunosoppressione. Sono necessari ulteriori studi per migliorare il numero di pazienti e il follow-up a lungo termine.
Marco Tallarico, Nicola Baldini, Fulvio Gatti, Matteo Martinolli, Erta Xhanari, Silvio Mario Meloni, Cervino Gabriele, Lumbau Aurea Immacolata
Riferimenti
- Albrektsson T, Chrcanovic B, Östman P-O, Sennerby L. Risposte iniziali e a lungo termine dell'osso crestal agli impianti dentali moderni. Periodontol 2000 2017;73(1):41–50
- Trindade R, Albrektsson T, Tengvall P, Wennerberg A. Reazione del corpo estraneo ai biomateriali: sui meccanismi di accumulo e degradazione dell'osseointegrazione. Clin Implant Dent Relat Res 2016;18(1):192–203
- Albrektsson T, Canullo L, Cochran D, De Bruyn H. “Peri-implantite”: una complicazione di un corpo estraneo o una “malattia” creata dall'uomo. Fatti e finzione. Clin Implant Dent Relat Res 2016;18(4):840–849
- Albrektsson T, Dahlin C, Jemt T, Sennerby L, Turri A, Wennerberg A. La perdita ossea marginale attorno agli impianti orali è il risultato di una reazione provocata da un corpo estraneo? Clin Implant Dent Relat Res 2014;16(2):155–165
- Albrektsson T, Donos N; Gruppo di lavoro 1. Sopravvivenza degli impianti e complicazioni. La terza conferenza di consenso EAO 2012. Clin Oral Implants Res 2012;23(suppl 6):63–65
- Cicciu M, Bramanti E, Matacena G, Guglielmino E, Risitano G. Valutazione FEM della corona protesica a singolo dente trattenuta da cemento rispetto a quella trattenuta da vite. Int J Clin Exp Med 2014;7(4):817–825
- Bramanti E, Cervino G, Lauritano F, et al. Analisi FEM e di Von Mises sugli elementi strutturali delle corone protesiche: valutazione di diversi materiali applicati. ScientificWorldJournal 2017;2017:1029574
- Anil S, Anand PS, Alghamdi H, Jansen JA, Miglioramento della superficie degli impianti dentali e osseointegrazione. In: Turkyilmez I, ed. Implant Dentistry—A Rapidly Evolving Practice. Rijeka, Croazia: InTech; 2011 83–87
- Cicciù M, Risitano G, Maiorana C, Franceschini G. Analisi parametrica della resistenza nel sistema osseo-protesico “Toronto”. Minerva Stomatol 2009;58(1-2):9–23
- Tallarico M, Baldini N, Martinolli M, et al. Le nuove superfici idrofile hanno qualche influenza sul tasso di successo precoce e sulla stabilità dell'impianto durante il periodo di osseointegrazione? Risultati preliminari di quattro mesi da uno studio randomizzato controllato split-mouth. Eur J Dent 2019;13(1):95–101
- Tallarico M, Vaccarella A, Marzi GC. Risultati clinici e radiologici del posizionamento dell'impianto in 1 contro 2 fasi: risultati di 1 anno di uno studio clinico randomizzato. Eur J Oral Implantology 2011;4(1):13–20
- Le Guéhennec L, Soueidan A, Layrolle P, Amouriq Y. Trattamenti superficiali degli impianti dentali in titanio per una rapida osseointegrazione. Dent Mater 2007;23(7):844–854
- Chrcanovic BR, Albrektsson T, Wennerberg A. Motivi per i fallimenti degli impianti orali. J Oral Rehabil 2014;41(6):443–476
- Renvert S, Polyzois I, Claffey N. Come influenzano le caratteristiche della superficie dell'impianto le malattie peri-implantari? J Clin Periodontol 2011;38(suppl 11):214–222
- Dohan Ehrenfest DM, Coelho PG, Kang BS, Sul YT, Albrektsson T. Classificazione delle superfici degli impianti osseointegrati: materiali, chimica e topografia. Trends Biotechnol 2010;28(4): 198–206
- Xuereb M, Camilleri J, Attard NJ. Revisione sistematica dei materiali di rivestimento attuali per impianti dentali e delle nuove tecniche di rivestimento. Int J Prosthodont 2015;28(1):51–59
- Piattelli A, Cosci F, Scarano A, Trisi P. Infezione ossea suppurativa cronica localizzata come conseguenza di peri-implantite in un impianto dentale rivestito in idrossiapatite. Biomaterials 1995;16(12): 917–920
- Payne AG, Tawse-Smith A, Duncan WD, Kumara R. Carico convenzionale e precoce di impianti ITI non splintati a supporto di protesi mandibolari. Clin Oral Implants Res 2002;13(6): 603–609
- Cochran DL, Schenk RK, Lussi A, Higginbottom FL, Buser D. Risposta ossea a impianti in titanio non caricati e caricati con superficie sabbiata e acido-reattiva: uno studio istometrico nella mandibola canina. J Biomed Mater Res 1998;40(1):1–11
- Khandelwal N, Oates TW, Vargas A. Alexander PP, Schoolfield JD, Alex McMahan C. Impianti SLA convenzionali e SLA chimicamente modificati in pazienti con diabete mellito di tipo 2 scarsamente controllato: uno studio randomizzato controllato. Clin Oral Implants Res 2013;24(1):13–19
- Brånemark PI, Hansson BO, Adell R, et al. Impianti osseointegrati nel trattamento della mandibola edentula. Esperienza da un periodo di 10 anni. Scand J Plast Reconstr Surg Suppl 1977;16:1–132
- Makary C, Rebaudi A, Sammartino G, Naaman N. Stabilità primaria dell'impianto determinata dall'analisi della frequenza di risonanza: correlazione con la forza di inserimento, il volume osseo istologico e la stabilità torsionale a 6 settimane. Implant Dent 2012;21(6):474–480
- Szmukler-Moncler S, Salama H, Reingewirtz Y, Dubruille JH. Tempistica del carico e effetto del micromovimento sull'interfaccia osso-impianto dentale: revisione della letteratura sperimentale. J Biomed Mater Res 1998;43(2):192–203
- Lioubavina-Hack N, Lang NP, Karring T. Significato della stabilità primaria per l'osseointegrazione degli impianti dentali. Clin Oral Implants Res 2006;17(3):244–250
- Brånemark PI, Adell R, Breine U, Hansson BO, Lindström J, Ohlsson A. Ancoraggio intra-osseo delle protesi dentali. I. Studi sperimentali. Scand J Plast Reconstr Surg 1969;3(2):81–100
- Tallarico M, Vaccarella A, Marzi GC, Alviani A, Campana V. Uno studio clinico prospettico caso-controllo che confronta impianti Nobel Biocare TiUnite a 1 e 2 fasi: analisi della frequenza di risonanza valutata da Osstell Mentor durante l'integrazione. Quintessence Int 2011;42(8):635–644
- Junker R, Dimakis A, Thoneick M, Jansen JA. Effetti dei rivestimenti e della composizione della superficie dell'impianto sull'integrazione ossea: una revisione sistematica. Clin Oral Implants Res 2009;20(suppl 4): 185–206
- Rupp F, Liang L, Geis-Gerstorfer J. Scheideler L, Hüttig F. Caratteristiche superficiali degli impianti dentali: una revisione. Dent Mater 2018;34(1):40–57
- Heitz-Mayfield LJ. Malattie peri-implantari: diagnosi e indicatori di rischio. J Clin Periodontol 2008;35(suppl 8):292–304
- Braceras I, Alava JI, Oñate JI, et al. Migliorata osseointegrazione in impianti dentali trattati con ionizzazione. Surf Coat Tech 2002;158–159:28–32
- Schwarz F, Herten M, Sager M, Wieland M, Dard M, Becker J. Analisi istologica e immunoistochimica dell'integrazione ossea iniziale e precoce in impianti in titanio chimicamente modificati e SLA convenzionali: risultati preliminari di uno studio pilota in cani. Clin Oral Implants Res 2007;18(4):481–488
- Long MW, Robinson JA, Ashcraft EA, Mann KG. Regolazione delle cellule osteoprogenitrici derivate dal midollo osseo umano da parte di fattori di crescita osteogenici. J Clin Invest 1995;95(2):881–887
- Reilly TM, Seldes R, Luchetti W, Brighton CT. Somiglianze nell'espressione fenotipica di periciti e cellule ossee. Clin Orthop Relat Res 1998;(346):95–103
- Murphy M, Walczak MS, Thomas AG, Silikas N, Berner S, Lindsay R. Verso l'ottimizzazione delle prestazioni degli impianti dentali: caratterizzazione superficiale dei materiali per impianti Ti e TiZr. Dent Mater 2017;33(1):43–53
- Wennerberg A, Galli S, Albrektsson T. Conoscenze attuali sulla superficie SLActive idrofila e nanostrutturata. Clin Cosmet Investig Dent 2011;3:59–67
- Smeets R, Stadlinger B, Schwarz F, et al. Impatto delle modifiche della superficie degli impianti dentali sull'osseointegrazione. BioMed Res Int 2016;2016:6285620
- Faot F, Bielemann AM, Schuster AJ, et al. Influenza della forza di inserimento sugli esiti clinici e biologici prima e dopo il carico di protesi mandibolari trattenute da impianti in mandibole atrofizzate. BioMed Res Int 2019;2019: 8132520
- Herford AS, Miller M, Lauritano F, Cervino G, Signorino F, Maiorana C. L'uso della pianificazione chirurgica virtuale e della navigazione nel trattamento del trauma orbitale. Chin J Traumatol 2017;20(1):9–13
- Stacchi C, Lombardi T, Cusimano P, et al. Raschiatori ossei contro chirurgia piezoelettrica nell'antrostomia laterale per elevazione del pavimento del seno. J Craniofac Surg 2017;28(5):1191–1196
- Lo Giudice G, Cicciù M, Cervino G, Lizio A, Visco AM. Resina fluida e gap marginale su cavità mediali terzi dentali che coinvolgono smalto e cemento radicolare: una valutazione SEM di due tecniche di restauro. Indian J Dent Res 2012;23(6): 763–769
- Cervino G, Terranova A, Briguglio F, et al. Diabete: qualità della vita correlata alla salute orale e alterazioni orali. BioMed Res Int 2019;2019:5907195
- Lo Giudice G, Lipari F, Lizio A, Cervino G, Cicciù M. Tecnica di riattacco di frammenti dentali su un dente pluri-traumatizzato. J Conserv Dent 2012;15(1):80–83
- Cervino G, Fiorillo L, Herford AS, et al. Biomarcatori molecolari correlati al carcinoma orale: valutazione degli esiti di studi clinici in una revisione della letteratura. Dis Markers 2019;2019:8040361
- Pozzi A, Tallarico M, Moy PK. Carico immediato con un nuovo impianto caratterizzato da geometria a filettatura variabile, connessione conica interna e spostamento della piattaforma: risultati di tre anni da uno studio di coorte prospettico. Eur J Oral Implantol 2015;8(1):51–63
- Cervino G, Fiorillo L, Arzukanyan AV, Spagnuolo G, Cicciù M. Flusso di lavoro digitale restaurativo dentale: progettazione del sorriso digitale dall'estetica alla funzione. Dent J (Basel) 2019;7(2):28
- Lavorgna L, Cervino G, Fiorillo L, et al. Affidabilità di un progetto protesico virtuale realizzato attraverso un'acquisizione fotografica 2d e 3d: uno studio sperimentale sull'accuratezza di diversi sistemi digitali. Int J Environ Res Public Health 2019;16(24):5139
- Laino L, Cicciù M, Fiorillo L, et al. Rischio chirurgico nei pazienti con coagulopatie: linee guida per pazienti emofilici per la chirurgia oromaxillofacciale. Int J Environ Res Public Health 2019; 16(8):1386
