Rivestimento di una superficie di impianto sabbiata e acido-etch con un agente tampone pH dopo fotofunzionalizzazione a vuoto-UV
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract
La fotofunzionalizzazione ultravioletta (UV) può ripristinare l'invecchiamento biologico del titanio dopo la preparazione e la conservazione degli impianti dentali trasformando le superfici di titanio idrofobiche in superfici superidrofili. La formazione di un coagulo di sangue attorno all'impianto può iniziare e promuovere il processo di guarigione all'interfaccia osso-impianto. L'obiettivo di questo studio è valutare e confrontare le capacità di bagnabilità superficiale e coagulazione del sangue di impianti con una superficie convenzionale sabbiata e acido-reattata (SA), una superficie sabbiata e acido-reattata con trattamento a vuoto-UV (SA + VUV), e una superficie sabbiata e acido-reattata rivestita con un agente tampone di pH dopo il trattamento a vuoto-UV (SA + VUV + BS). Test statici e dinamici per la bagnabilità superficiale e la coagulazione del sangue sono stati eseguiti in vitro per SA + VUV e SA + VUV + BS (n = 5), mentre l'emostasi risultante dalla coagulazione del sangue è stata valutata in vivo per SA, SA + VUV e SA + VUV + BS (n = 4). Un test di Kruskal-Wallis ha mostrato differenze statisticamente significative (p < 0.05) in tutti i test, ad eccezione del test in vitro di coagulazione del sangue statico. Il trattamento VUV è quindi efficace nel rendere una superficie SA superidrofila come alternativa alla radiazione UV-C di routine. L'aggiunta di un agente tampone di pH a SA + VUV ha anche migliorato la bagnabilità superficiale e la coagulazione del sangue, che sono cruciali per una corretta osseointegrazione.
Introduzione
Il titanio è stato ampiamente utilizzato per la restaurazione e la ricostruzione dentale e ortopedica grazie alla sua biocompatibilità, resistenza alla corrosione e proprietà meccaniche. Il titanio si ossida facilmente, formando uno strato sottile (1–5 nm), stabile e passivo che è auto-limitante e protegge la superficie del metallo da ulteriori ossidazioni. Questo strato superficiale di biossido di titanio (TiO2) è considerato responsabile delle sue prestazioni biologiche efficaci grazie al trasferimento di ioni di calcio e fosforo dalla matrice ossea all'interno dello strato di TiO2. Tuttavia, nel tempo si verificano significative riduzioni nell'osseointegrazione e in altre capacità biologiche del titanio poiché il carbonio superficiale aumenta a causa di un'inevitabile deposizione di carbonio dall'atmosfera sullo strato di TiO2 sotto forma di idrocarburi. Questo fenomeno è definito come l'invecchiamento biologico del titanio, e la capacità delle superfici di titanio di attrarre proteine e cellule osteogeniche diminuisce in modo dipendente dal tempo. Un altro cambiamento notevole nelle superfici di titanio nel tempo è la scomparsa dell'idrofilicità. Immediatamente dopo la lavorazione, le superfici di titanio mostrano un angolo di contatto dell'acqua di 0 o meno di 5 gradi, e tali superfici sono definite superidrofili. Questa caratteristica si attenua gradualmente e diventa idrofobica in 2 e 4 settimane, con un angolo di contatto superiore a 40 e 60 gradi, rispettivamente.
Il trattamento della superficie è utilizzato per modificare la topografia e l'energia della superficie degli impianti dentali, risultando in una migliore bagnabilità, un aumento della proliferazione e crescita cellulare e un'accelerazione dell'osseointegrazione. Il trattamento della superficie può essere ottenuto tramite una tecnica additiva o sottrattiva. La tecnica sottrattiva rimuove o rughe una strato di materiale di base, come esemplificato da una superficie sabbiata e acido-etch (SA). Nella tecnica additiva, altri materiali o agenti chimici vengono aggiunti superficialmente alla superficie del titanio tramite rivestimento, come la spruzzatura di plasma di titanio, il rivestimento in idrossiapatite, il rivestimento in fosfato di calcio e altri rivestimenti biomimetici. La perforazione prima del posizionamento dell'impianto provoca un trauma ai tessuti ossei simile a una frattura. Il sito diventa relativamente ipossico e il pH extracellulare diventa acido. In tali condizioni, le cellule stromali del midollo osseo mostrano un'attività ridotta della fosfatasi alcalina (ALP) e sintesi di collagene, entrambi importanti nella formazione ossea e nell'osseointegrazione. Anche la glicolisi e la sintesi del DNA degli osteoblasti risultano influenzate da condizioni acide. L'aggregazione piastrinica, che è un passo critico nella formazione del coagulo di sangue o trombogenesi, è anch'essa ridotta dall'acidosi extracellulare, mediata dal percorso di ingresso degli ioni di calcio. La formazione di un coagulo di sangue sufficiente offre un collegamento diretto e stabile all'interfaccia osso-impianto e gioca un ruolo importante nelle risposte trombogeniche e nell'osseointegrazione. Inoltre, è stata trovata una relazione tra varie superfici di impianto e l'estensione del coagulo di fibrina.
Nel nostro studio precedente, è stata introdotta una nuova superficie SA rivestita con un agente tampone di pH dopo il trattamento con UV-Vacuum (VUV). Questa superficie era strettamente associata a una maggiore affinità per le proteine, le cellule e le piastrine, che promuovevano una coagulazione del sangue rapida e stabile, trombogenesi e osseointegrazione. Lo scopo del presente studio era di valutare e confrontare la bagnabilità della superficie e le capacità di coagulazione del sangue di varie superfici di impianto, inclusa una superficie SA convenzionale (SA), una superficie SA con trattamento VUV (SA + VUV) e una superficie SA rivestita con un agente tampone di pH dopo il trattamento VUV (SA + VUV + BS), attraverso analisi in vitro e in vivo.
Materiali e Metodi
2.1. Preparazione dei Fissaggi per Impianti
I fissaggi per impianti in titanio commercialmente puro (grado IV) sono stati preparati come SA, SA + VUV (TS III SA, Osstem, Seoul, Corea) e SA + VUV + BS (TS III SOI, Osstem) per l'uso in questo studio. Come mostrato nelle Figure 1a,b, la rugosità superficiale dei fissaggi per impianti è stata misurata in 2.5 ± 0.5 µm di valore Ra, e il trattamento VUV per la fotofunzionalizzazione è stato ottenuto esponendo un fissaggio per impianti a lampade ad arco di mercurio a bassa pressione che emettono UV-C e VUV in un pulitore a ozono UV per 1 ora. Il rivestimento della superficie dell'impianto con un agente tampone di pH, composto da gruppi ionici sia positivi che negativi, con un valore di pKa di 7.31 a 37°C, è stato integrato per una migliore superidrofobicità (Figura 1c).
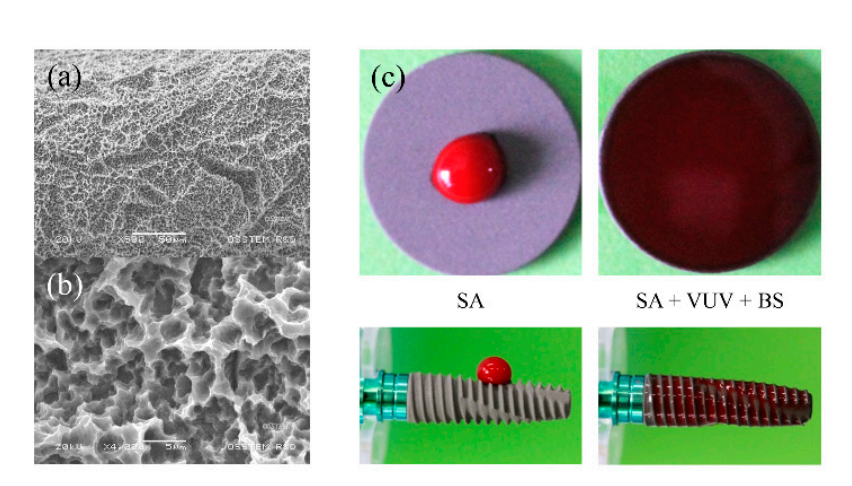
2.2. Test In Vitro
2.2.1. Bagnabilità Superficiale Statica
Il sangue di pecora eparinizzato è stato versato in una piastra di 3,5 cm di diametro fino a una profondità di 2-3 cm. I dispositivi impiantari di SA + VUV e SA + VUV + BS (n = 5, rispettivamente) sono stati immersi nel sangue fino alla discontinuità superiore dei fili apicali, e il tempo necessario per raggiungere la parte superiore del dispositivo impiantare è stato registrato per calcolare la velocità di bagnamento. Il tempo non è stato conteggiato dall'apice del dispositivo impiantare, poiché la presenza della discontinuità dei fili apicali ha causato un'improvvisa interruzione dell'assorbimento del sangue.
2.2.2. Bagnabilità Superficiale Dinamica
Per simulare le situazioni cliniche di installazione del dispositivo impiantare, sono stati praticati dei fori in una piastra di acrilico trasparente per garantire visibilità, secondo il protocollo di perforazione del produttore per la densità ossea dura utilizzando un Kit 122 Taper (Osstem). Un campione di sangue di pecora defibrinato di 130 µM è stato posto in ciascun foro della piastra di acrilico, e i dispositivi impiantari di SA + VUV e SA + VUV + BS (n = 5, rispettivamente) sono stati immersi nel foro mediante un manometro a spinta-tiraggio (MX-500N, Imada Co., Tokyo, Giappone) a una velocità di 50 mm/min, e i tempi in cui il sangue ha raggiunto i punti di 2 mm e 4 mm dell'asse centrale del dispositivo sopra la piastra orizzontale, rispettivamente, sono stati registrati (Figura 2).

2.2.3. Coagulazione del Sangue Statica
I dispositivi di impianto di SA + VUV e SA + VUV + BS, lunghi 11,5 mm con diametro di 4,5 mm (n = 5, rispettivamente), sono stati immersi fino alle estremità in un piatto di 3,5 cm di diametro riempito con 3 mL di sangue di pecora non eparinizzato. Il peso (g) del coagulo di sangue attorno al dispositivo di impianto è stato misurato a 5 min, 7,5 min, 10 min e 12,5 min, rispettivamente.
2.2.4. Coagulazione del Sangue Dinamica
Questo modello per la coagulazione attiva del sangue è stato progettato per simulare un apporto continuo di sangue da parte dei capillari. I dispositivi impiantabili SA + VUV e SA + VUV + BS, che erano lunghi 10 mm con un diametro di 4,0 mm (n = 5), sono stati inseriti con una coppia di inserimento preimpostata di 5 N cm in un tubo Eppendorf modificato, che era collegato a una pompa a siringa che infondeva sangue di pecora, mescolato con 1 IU/mL di eparina, sul fondo a 37°C. Dopo 30 minuti di apporto di sangue a una velocità di infusione di 0,05 mL/min, sono stati misurati il tempo (min) fino a quando il sangue ha smesso di gocciolare a causa della formazione di coaguli di sangue attorno al dispositivo impiantabile e il volume (mL) di sangue, che è stato raccolto nel tubo sottostante da 15 mL sotto il tubo Eppendorf.
2.3. Test In Vivo
È stato utilizzato un modello di mandibola di cane beagle. Tutte le procedure sono state condotte con l'approvazione del Comitato Etico per la Sperimentazione Animale del Comitato Istituzionale per la Cura e l'Uso degli Animali (CRONEX-IACUC 20191002; Cronex, Hwasung, Corea) secondo le linee guida della Ricerca Animale: Reporting in Vivo Experiments (ARRIVE).
Quattro beagle femmine di 18 mesi sono state sottoposte a estrazione bilaterale dei premolari mandibolari e del primo molare in anestesia generale. Il protocollo anestetico per tutte le procedure chirurgiche includeva un'iniezione intramuscolare di 1 mL con una dose di 15 mg/kg di tiletamina/zolazepam (Zoletil 50, Virbac, Seoul, Corea) e 5 mg/kg di xilazina (Rompun, Bayer Corea, Seoul, Corea). Dopo l'anestesia locale, è stata sollevata una flap mucoperiostale a tutto spessore adiacente ai premolari e molari mandibolari (Figura 3). I denti sono stati emisezionati sotto abbondante irrigazione con una piccola fresa a fessura. Le estrazioni sono state eseguite con elevatori e pinze. Le flap sono state chiuse con punti singoli interrotti. Il protocollo di cura post-operatoria includeva antibiotici e controllo del dolore. Durante questo intervallo, tutti i cani sono stati mantenuti su una dieta morbida e acqua ad libitum.
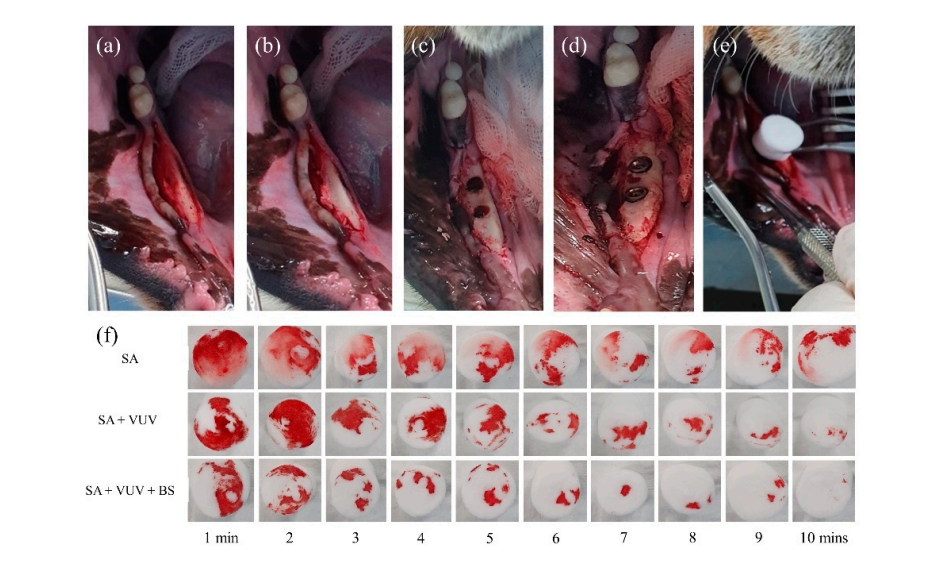
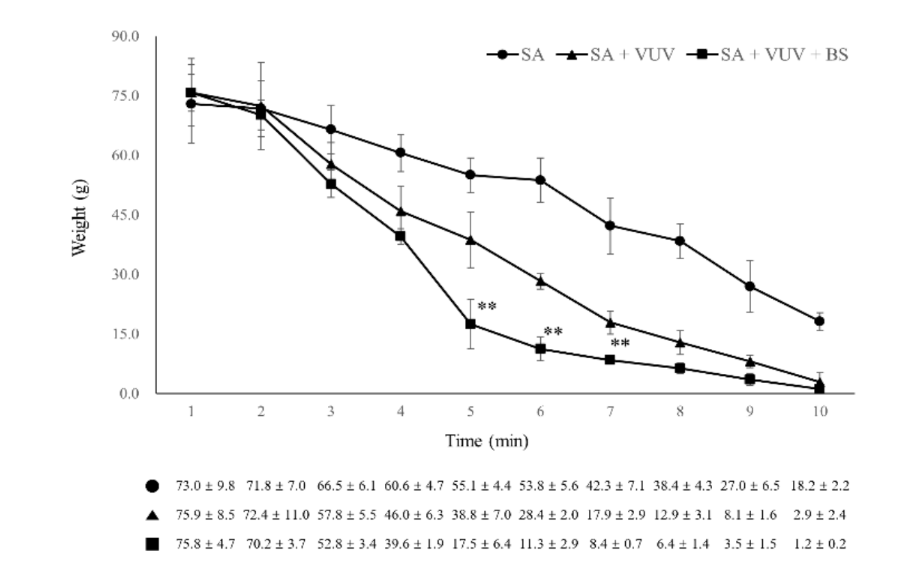
Tre mesi dopo le estrazioni, è stata eseguita la posizionamento chirurgico degli impianti dentali nei siti di estrazione guariti in condizioni sterili. Dopo anestesia locale, è stato sollevato un lembo a tutto spessore per esporre la cresta alveolare, e la cresta alveolare irregolare è stata appiattita. Sono state eseguite perforazioni sequenziali per i siti di impianto consecutivi, che erano più grandi del corpo dell'impianto, utilizzando un trapano guida, un trapano a spirale da 2,2 mm, un trapano conico da 3,0 mm, un trapano conico da 4,0 mm e un trapano ultra-conico da 6,0 mm. Un totale di 12 corpi di impianto di SA, SA + VUV e SA + VUV + BS, lunghi 8,5 mm con un diametro di 3,5 mm, sono stati posizionati bilateralmente con una coppia di inserzione preimpostata di 35 N cm. Il sangue intero dal gap tra il foro e il corpo dell'impianto è stato assorbito in una pallina di cotone fino a 10 minuti dopo il posizionamento dell'impianto, e il peso (g) della pallina di cotone è stato misurato ogni minuto per valutare il potenziale di coagulazione del sangue dei corpi degli impianti. Tutti gli animali sperimentali sono stati sacrificati dopo l'intervento chirurgico mediante un'overdose endovenosa di cloruro di potassio.
2.4. Analisi Statistica
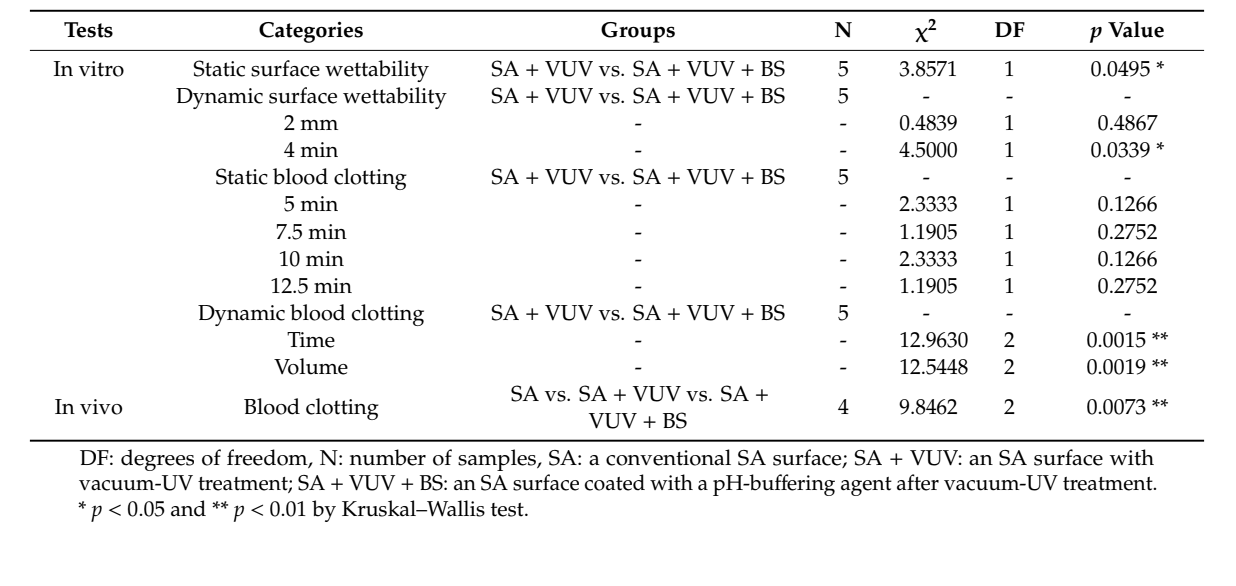
Data la piccola dimensione del campione, abbiamo eseguito un test di Kruskal–Wallis, che è un confronto non parametrico della differenza delle medie senza un'assunzione di normalità, per esaminare le differenze tra SA + VUV e S + VUV + BS in vitro e tra SA, SA + VUV e SA + VUV + BS in vivo, con una significatività statistica di p < 0.05 a α = 0.05. Tutte le analisi statistiche sono state eseguite utilizzando SAS, versione 9.4 (SAS Inc., Cary, NC, USA).
Risultati
3.1. Test In Vitro
3.1.1. Bagnabilità della Superficie Statica
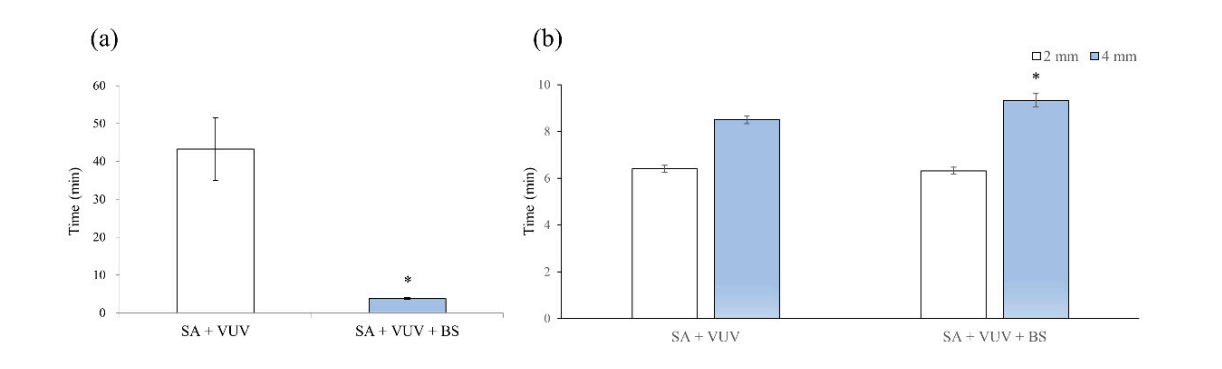
I tempi necessari prima che il sangue raggiungesse la parte superiore del dispositivo impiantare erano di 43.3 ± 8.3 min e 3.8 ± 0.3 min in SA + VUV e SA + VUV + BS, rispettivamente, e una differenza statisticamente significativa (p < 0.05) tra i due era evidente (Figura 4a).
3.1.2. Bagnabilità della Superficie Dinamica
I tempi necessari prima che il sangue raggiungesse 2 mm sopra la piastra orizzontale erano di 6.4 ± 0.1 min e 6.3 ± 0.2 min, e per 4 mm sopra la piastra orizzontale, erano di 8.5 ± 0.2 min e 9.3 ± 0.3 min in SA + VUV e SA + VUV + BS, rispettivamente. Una differenza statisticamente significativa (p < 0.05) tra SA + VUV e SA + VUV + BS è stata trovata solo per il tempo prima che il sangue raggiungesse 4 mm sopra la piastra orizzontale (Figura 4b).
3.1.3. Coagulazione del Sangue Statica
In SA + VUV, i pesi del coagulo di sangue formato attorno al fissaggio dell'impianto, misurati a 5 min, 7.5 min, 10 min e 12.5 min dopo aver immerso il fissaggio dell'impianto nel sangue, erano 0.04 ± 0.01 g, 0.09 ± 0.03 g, 0.23 ± 0.06 g e 0.39 ± 0.16 g, rispettivamente. In SA + VUV + BS, i pesi erano 0.07 ± 0.03 g, 0.12 ± 0.02 g, 0.39 ± 0.20 g e 0.61 ± 0.18 g, rispettivamente, e non sono state misurate differenze statisticamente significative tra SA + VUV e SA + VUV + BS in nessun momento (p > 0.05).
3.1.4. Coagulazione del Sangue Dinamica
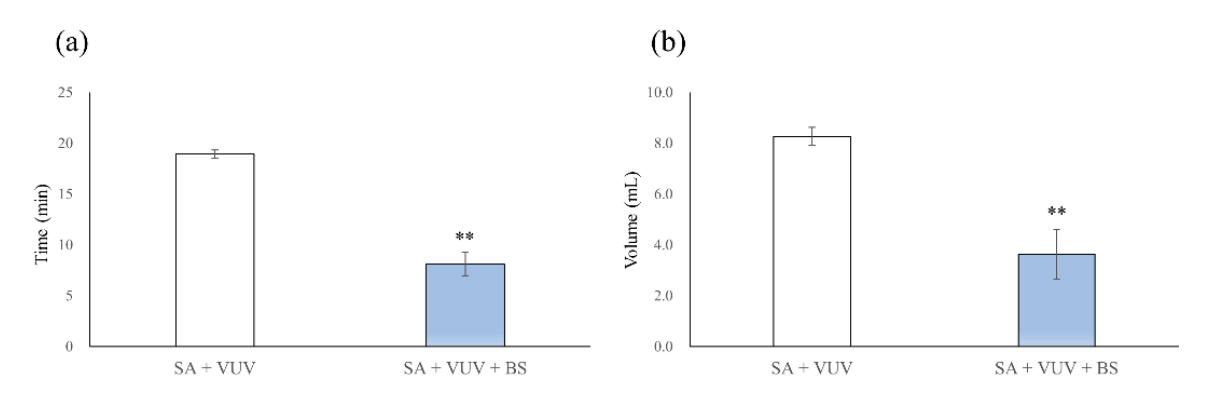
I tempi per emostasi completa erano 19.0 ± 0.4 min e 8.1 ± 1.2 min in SA + VUV e SA + VUV + BS, rispettivamente, e c'era una differenza statisticamente significativa tra SA + VUV e SA + VUV + BS (p < 0.01, Figura 5a). Inoltre, i volumi di sangue raccolti nel tubo sottostante erano 8.27 ± 0.36 mL e 3.64 ± 0.99 mL in SA + VUV e SA + VUV + BS, rispettivamente, con una differenza statisticamente significativa (p < 0.01, Figura 5b) evidente tra SA + VUV e SA + VUV + BS.
3.2. Test In Vivo
Tra SA, SA + VUV e SA + VUV + BS, ci sono state differenze statisticamente significative nei pesi del sangue intero assorbito nel pellet di cotone misurati a 5 min, 6 min e 7 min (p < 0.01, Figura 6). Le statistiche riassuntive di questo studio sono mostrate nella Tabella 1.
Discussione
La fotofunzionalizzazione UV, un metodo di modifica delle superfici in titanio dopo il trattamento UV che include la modifica delle proprietà fisico-chimiche e il miglioramento delle biocompatibilità, è stata proposta per resettare l'invecchiamento biologico del titanio. Dopo il trattamento con radiazioni UV, lo strato di TiO2 di una superficie in titanio incorporata con idrocarburi è diventato notevolmente idrofila o superidrofila. La quantità di carbonio superficiale è nota per variare a seconda dell'età della superficie e si riporta che può aumentare fino a circa il 60% - 70% dei componenti atomici superficiali. Il trattamento UV pulisce tali superfici in titanio contaminate da carbonio, riducendo la percentuale di carbonio a meno del 20% e aumentando contemporaneamente il livello di osseointegrazione. Nello spettro UV, sia l'UV-A che l'UV-C convertono le superfici in titanio biologicamente invecchiate da idrofobiche a superidrofobiche, ma solo l'UV-C (200–280 nm) è noto per ridurre efficacemente il carbonio superficiale a un livello equivalente a una nuova superficie e migliorare la bioattività. L'UV-C è in grado di rimuovere idrocarburi da uno strato di TiO2 di titanio mediante fotodecomposizione diretta, che è più efficace della fotocatalisi da UV-A. Nel nostro studio, tutti i dispositivi impiantabili sono stati fotofunzionalizzati da UV-C e VUV (100–200 nm), e la rimozione radicale di idrocarburi dallo strato di TiO2 di titanio potrebbe fornire maggiore superidrofobicità. Il VUV è rapidamente assorbito dall'acqua nell'atmosfera e quindi è in grado di generare varie specie reattive di ossigeno rompendo i legami idrogeno nelle molecole d'acqua tramite idrolisi. L'idrolisi iniziata da VUV è un metodo efficiente per ottenere gruppi idrossido o idrossile su uno strato di TiO2 che fornisce una superidrofobicità persistente. Poiché il trattamento VUV tende a generare più ozono nell'atmosfera e radicali idrossilici nell'acqua, dovrebbe essere rigorosamente limitato solo a impostazioni di laboratorio o fabbrica, non cliniche.
Per accelerare la guarigione ossea e migliorare l'ancoraggio osseo a un impianto, l'interfaccia osso/impianto può essere migliorata topograficamente e biochimicamente incorporando fasi inorganiche, come il fosfato di calcio, e molecole organiche, come proteine, enzimi o peptidi, su o in uno strato di TiO2. Le superfici degli impianti nanostrutturate, che hanno un'ampia area superficiale, alta energia libera superficiale e bagnabilità, sembrano capaci di modificare la risposta del tessuto ospite. Le superfici degli impianti SA hanno dimostrato risultati clinici prevedibili e sono considerate superfici standard per impianti. La superidrofobicità di SA + VUV + BS, che era stata precedentemente riscontrata sulla superficie piatta dei dischi, è stata confermata nel nostro test di bagnabilità superficiale statica. Poiché la capacità di attrarre sangue vicino alla parte superiore del fissaggio dell'impianto (circa 4 mm sopra la piastra orizzontale nel nostro studio) è ciò che la maggior parte dei clinici preferisce controllare in un contesto clinico, abbiamo aggiunto un nuovo test dinamico di bagnabilità superficiale per confrontare le velocità di bagnamento di SA + VUV e SA + VUV + BS in modo più dettagliato. Poiché SA è una superficie secca che non è stata a contatto con alcun liquido, la bagnabilità superficiale di SA + VUV + BS potrebbe essere significativamente superiore a quella di SA esclusivamente per effetto dell'agente tampone del pH di SA + VUV + BS stesso. Tuttavia, dato che i fissaggi degli impianti vengono posizionati con superfici secche o senza alcuna idratazione aggiuntiva in situazioni cliniche reali, abbiamo scelto un SA naïve, piuttosto che un SA idratato in soluzione, come controllo. Una superficie più idrofila è stata precedentemente trovata essere strettamente correlata a un'osseointegrazione superiore e più rapida. Inoltre, è noto che la bagnabilità superficiale altera le risposte biologiche delle superfici degli impianti rispetto all'adesione di proteine e altre molecole, così come le interazioni cellulari.
Poiché la formazione di coaguli di sangue segna l'inizio del processo di guarigione, l'interazione tra un impianto e il sangue è considerata importante per il successo dell'osseointegrazione degli impianti in titanio dopo l'impianto. La formazione di coaguli di sangue su superfici in titanio ruvide può indurre il reclutamento cellulare e stimolare la guarigione delle ferite, ed è stato rivelato che sia i preosteoblasti che gli osteoblasti possono attaccarsi a una superficie dell'impianto coperta da piastrine e fibrina, dove si differenziano sotto la stimolazione di fattori osteogenici e citochine rilasciate dal coagulo di sangue peri-impianto. La formazione di coaguli di sangue sull'impianto con varie superfici impiantari è ritenuta un fattore cruciale per una efficace ritenzione della fibrina e può influenzare criticamente la guarigione ossea e l'osseointegrazione influenzando il trasporto di macromolecole, il comportamento cellulare e l'osteogenesi a contatto/distanza. In un test di coagulazione statica del sangue, il SA + VUV + BS ha mostrato una superiore assorbimento del sangue attorno ai dispositivi impiantari rispetto a SA + VUV, ma non in modo statisticamente significativo. Questo indica che una superficie SA fotofunzionalizzata con VUV ha almeno un'uguale capacità di coagulazione del sangue. Abbiamo progettato nuovi esperimenti per confermare la coagulazione del sangue mediante emostasi di sanguinamenti capillari continui per simulare le situazioni cliniche reali il più accuratamente possibile. In un test di coagulazione dinamica del sangue in vitro, i coaguli si sono formati significativamente più velocemente, e il volume totale di sangue raccolto attraverso il gap tra i fori e il dispositivo impiantare fino all'emostasi era significativamente minore in SA + VUV + BS rispetto a SA + VUV. Un test in vivo ha anche mostrato una differenza significativa nel peso totale del sanguinamento tra il foro sovrapreparato e un dispositivo impiantare tra SA, SA + VUV e SA + VUV + BS. Questo suggerisce che SA + VUV + BS può indurre una formazione di coaguli di sangue più rapida attorno alla superficie dell'impianto, portando a un'interazione più efficace dell'interfaccia osso-impianto per l'osseointegrazione. In un contesto clinico, queste caratteristiche di SA + VUV + BS sono importanti per visualizzare il sito chirurgico e la rigenerazione ossea guidata simultanea, che è frequentemente indicata per la quantità e qualità adeguate dei tessuti peri-impiantari per risultati più estetici e funzionali, poiché la rapida coagulazione del sangue è strettamente associata alla stabilizzazione del materiale di innesto e della membrana barriera. Infine, SA + VUV potrebbe essere un'alternativa a SA + VUV + BS rispetto al potenziale di formazione di coaguli di sangue sulle superfici impiantari.
Durante la perforazione dell'impianto nell'osso, che produce una condizione debolmente acida, un tampone di pH può aiutare a mantenere il pH costante. Come materiale di rivestimento, l'agente tampone di pH sembra controllare il rilascio dei mediatori infiammatori e migliorare le condizioni per l'attività degli osteoblasti mantenendo il pH costante o almeno prevenendo cambiamenti significativi. L'attività delle piastrine nella coagulazione del sangue e sia l'attività degli osteoblasti che il livello di ALP per la formazione ossea sono anch'essi inibiti dall'acidosi extracellulare. SA + VUV + BS potrebbe massimizzare l'attività delle piastrine, la trombogenesi, l'attività degli osteoblasti e il livello di ALP in un'interfaccia osso-impianto attraverso un effetto tampone di pH. Saranno necessari ulteriori studi per indagare SA + VUV + BS rispetto alla sua sicurezza ed efficacia in contesti clinici. Dovrebbero essere seguiti anche studi controllati randomizzati per confermare la sua fattibilità in varie condizioni cliniche, come il posizionamento dell'impianto immediatamente dopo l'estrazione del dente o con un'adeguata augmentazione ossea simultanea.
Chang-Joo Park, Jae Hyung Lim, Marco Tallarico, Kyung-Gyun Hwang, Hyook Choi, Gyu-Jang Cho, Chang Kim, Il-Seok Jang, Ju-Dong Song, Amy M. Kwon, Sang Ho Jeon e Hyun-Kyung Park
Riferimenti
- Özcan, M.; Hämmerle, C. Il titanio come materiale di ricostruzione e impianto in odontoiatria: Vantaggi e insidie. Materials 2012, 5, 1528–1545. [CrossRef]
- Ehrenfest, D.M.D.; Coelho, P.G.; Kang, B.S.; Sul, Y.T.; Albrektsson, T. Classificazione delle superfici degli impianti osseointegrati: Materiali, chimica e topografia. Trends Biotechnol. 2010, 28, 198–206. [CrossRef]
- Milošev, I.; Metikoš-Hukovic´, M.; Strehblow, H.H. Film passivo su lega di TiAlV ortopedica formata in soluzione fisiologica indagata tramite spettroscopia fotoelettronica a raggi X. Biomaterials 2000, 21, 2103–2113. [CrossRef]
- Lee, J.H.; Ogawa, T. L'invecchiamento biologico degli impianti in titanio. Implant Dent. 2012, 21, 415–421. [CrossRef]
- Hori, N.; Att, W.; Ueno, T.; Sato, N.; Yamada, M.; Saruwatari, L.; Suzuki, T.; Ogawa, T. Degradazione dipendente dall'età della capacità di adsorbimento delle proteine del titanio. J. Dent. Res. 2009, 88, 663–667. [CrossRef]
- Hori, N.; Ueno, T.; Suzuki, T.; Iwasa, F.; Yamada, M.; Att, W.; Okada, S.; Ohno, A.; Aita, H.; Kimoto, K. Trattamento con luce ultravioletta per il ripristino della degradazione legata all'età della bioattività del titanio. Int. J. Oral Maxillofac. Implant. 2010, 25, 49–62.
- Ogawa, T. Fotofunzionalizzazione ultravioletta degli impianti in titanio. Int. J. Oral Maxillofac. Implant. 2014, 29, e95–e102. [CrossRef] [PubMed]
- Rosales-Leal, J.; Rodríguez-Valverde, M.; Mazzaglia, G.; Ramón-Torregrosa, P.; Díaz-Rodríguez, L.; García-Martínez, O.; Vallecillo-Capilla, M.; Ruiz, C.; Cabrerizo-Vílchez, M. Effetto della rugosità, bagnabilità e morfologia delle superfici di titanio ingegnerizzate sull'adesione delle cellule simili agli osteoblasti. Colloids Surf. Physicochem. Eng. Aspects 2010, 365, 222–229. [CrossRef]
- Cicciù, M.; Fiorillo, L.; Herford, A.S.; Crimi, S.; Bianchi, A.; D’Amico, C.; Laino, L.; Cervino, G. Superfici di titanio bioattive: Interazioni di cellule eucariotiche e procariotiche di dispositivi nano applicati alla pratica odontoiatrica. Biomedicines 2019, 7, 12. [CrossRef]
- Li, D.; Ferguson, S.J.; Beutler, T.; Cochran, D.L.; Sittig, C.; Hirt, H.P.; Buser, D. Confronto biomeccanico della superficie in titanio sabbiata e acido-etchata e quella lavorata e acido-etchata per impianti dentali. J. Biomed. Mater. Res. 2002, 60, 325–332. [CrossRef]
- Kaysinger, K.K.; Ramp, W.K. Il pH extracellulare modula l'attività degli osteoblasti umani coltivati. J. Cell. Biochem. 1998, 68, 83–89. [CrossRef]
- Marumo, M.; Suehiro, A.; Kakishita, E.; Groschner, K.; Wakabayashi, I. Il pH extracellulare influisce sull'aggregazione piastrinica associata alla modulazione dell'ingresso di Ca2+ attivato da riserva. Thromb. Res. 2001, 104, 353–360. [CrossRef]
- Hong, J.; Kurt, S.; Thor, A. Una superficie di impianto dentale idrofila mostra proprietà trombogeniche in vitro. Clin. Implant Dent. Relat. Res. 2013, 15, 105–112. [CrossRef]
- Di Iorio, D.; Traini, T.; Degidi, M.; Caputi, S.; Neugebauer, J.; Piattelli, A. Valutazione quantitativa dell'estensione del coagulo di fibrina su diverse superfici di impianto: Uno studio in vitro. J. Biomed. Mater. Res. 2005, 74, 636–642. [CrossRef]
- Pae, H.C.; Kim, S.K.; Park, J.Y.; Song, Y.W.; Cha, J.K.; Paik, J.W.; Choi, S.H. Caratteristiche bioattive di una superficie di impianto rivestita con un agente tampone di pH: Uno studio in vitro. J. Periodontal Implant. Sci. 2019, 49, 366–381. [CrossRef]
- Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Analisi comparativa radiologica tra riempimento con soluzione salina e fibrina ricca di piastrine dopo sollevamento del seno transcrestale idraulico senza innesto osseo aggiuntivo: Uno studio controllato randomizzato. Clin. Oral Implant. Res. 2020. [CrossRef] [PubMed]
- Att, W.; Hori, N.; Iwasa, F.; Yamada, M.; Ueno, T.; Ogawa, T. L'effetto della fotofunzionalizzazione UV sulla bioattività del titanio e delle leghe di cromo-cobalto nel tempo. Biomaterials 2009, 30, 4268–4276. [CrossRef]
- Shie, J.L.; Lee, C.H.; Chiou, C.S.; Chang, C.T.; Chang, C.C.; Chang, C.Y. Cinètica di fotodegradazione del formaldeide utilizzando fonti di luce UVA, UVC e UVLED in presenza di un fotocatalizzatore composto di ossido di titanio e argento. J. Hazard. Mater. 2008, 155, 164–172. [CrossRef]
- McGivney, E.; Carlsson, M.; Gustafsson, J.P.; Gorokhova, E. Effetti dei processi di ossidazione avanzata UV-C e Vacuum-UV TiO2 sulla mortalità acuta delle microalghe. Photochem. Photobiol. 2015, 91, 1142–1149. [CrossRef]
- Westall, J.; Hohl, H. Un confronto tra modelli elettrostatici per l'interfaccia soluzione-ossido. Adv. Colloid Interface Sci. 1980, 12, 265–294. [CrossRef]
- Tang, L.; Thevenot, P.; Hu, W. La chimica superficiale influenza la biocompatibilità degli impianti. Curr. Top. Med. Chem. 2008, 8, 270–280. [CrossRef]
- Coelho, P.G.; Granjeiro, J.M.; Romanos, G.E.; Suzuki, M.; Silva, N.R.; Cardaropoli, G.; Thompson, V.P.; Lemons, J.E. Metodi di ricerca di base e tendenze attuali delle superfici degli impianti dentali. J. Biomed. Mater. Res. 2009, 88, 579–596. [CrossRef]
- Puleo, D.; Nanci, A. Comprendere e controllare l'interfaccia osso-impianto. Biomaterials 1999, 20, 2311–2321. [CrossRef]
- Morra, M.; Cassinelli, C.; Cascardo, G.; Mazzucco, L.; Borzini, P.; Fini, M.; Giavaresi, G.; Giardino, R. Superfici di titanio rivestite di collagene I: Adesione delle cellule mesenchimali e valutazione in vivo in impianti ossei trabecolari. J. Biomed. Mater. Res. 2006, 78, 449–458. [CrossRef] [PubMed]
- Morra, M. Modifica biochimica delle superfici in titanio: Peptidi e proteine ECM. Eur. Cell. Mater. 2006, 12, 15. [CrossRef]
- Makowiecki, A.; Hadzik, J.; Błaszczyszyn, A.; Gedrange, T.; Dominiak, M. Una valutazione delle superfici superidrofili degli impianti dentali: una revisione sistematica e meta-analisi. BMC Oral Health 2019, 19, 79. [CrossRef]
- Khandelwal, N.; Oates, T.W.; Vargas, A.; Alexander, P.P.; Schoolfield, J.D.; Alex McMahan, C. Impianti SLA convenzionali e SLA chimicamente modificati in pazienti con diabete mellito di tipo 2 scarsamente controllato: Uno studio controllato randomizzato. Clin. Oral Implant. Res. 2013, 24, 13–19. [CrossRef]
- Kokovic, V.; Jung, R.; Feloutzis, A.; Todorovic, V.S.; Jurisic, M.; Hämmerle, C.H. Carico immediato vs. precoce degli impianti SLA nella mandibola posteriore: Risultati a 5 anni di uno studio clinico controllato randomizzato. Clin. Oral Implant. Res. 2014, 25, e114–e119. [CrossRef]
- Cesaretti, G.; Botticelli, D.; Renzi, A.; Rossi, M.; Rossi, R.; Lang, N.P. Valutazione radiografica di impianti caricati immediatamente a supporto di ponti fissi da 2 a 3 unità nella mascella posteriore: Uno studio clinico multicentrico prospettico controllato randomizzato a 3 anni di follow-up. Clin. Oral Implant. Res. 2016, 27, 399–405. [CrossRef]
- Buser, D.; Broggini, N.; Wieland, M.; Schenk, R.; Denzer, A.; Cochran, D.; Hoffmann, B.; Lussi, A.; Steinemann, S. Maggiore apposizione ossea a una superficie in titanio SLA chimicamente modificata. J. Dent. Res. 2004, 83, 529–533. [CrossRef]
- Lang, N.P.; Salvi, G.E.; Huynh-Ba, G.; Ivanovski, S.; Donos, N.; Bosshardt, D.D. Prima osseointegrazione a superfici di impianto idrofile e idrofobiche negli esseri umani. Clin. Oral Implant. Res. 2011, 22, 349–356. [CrossRef] [PubMed]
- Gittens, R.A.; Scheideler, L.; Rupp, F.; Hyzy, S.L.; Geis-Gerstorfer, J.; Schwartz, Z.; Boyan, B.D. Una revisione sulla bagnabilità delle superfici degli impianti dentali II: Aspetti biologici e clinici. Acta Biomater. 2014, 10, 2907–2918. [CrossRef]
- Shiu, H.T.; Goss, B.; Lutton, C.; Crawford, R.; Xiao, Y. La formazione di un coagulo di sangue su impianti biomateriali influisce sulla guarigione ossea. Tissue Eng. Part B Rev. 2014, 20, 697–712. [CrossRef]
- Yang, J.; Zhou, Y.; Wei, F.; Xiao, Y. Il coagulo di sangue formato su una superficie di titanio ruvida induce un precoce reclutamento cellulare. Clin. Oral Implant. Res. 2016, 27, 1031–1038. [CrossRef]
- Gassling, V.; Hedderich, J.; Açil, Y.; Purcz, N.; Wiltfang, J.; Douglas, T. Confronto tra fibrina ricca di piastrine e collagene come impalcature seminate di osteoblasti per applicazioni di ingegneria dei tessuti ossei. Clin. Oral Implant. Res. 2013, 24, 320–328. [CrossRef]
