Effetto dell'Impianto Immediato Simultaneo e Ricostruzione Ossea Guidata con Membrane in Rete di Titanio Ultra-Fine sui Parametri Radiografici e Clinici dopo 18 Mesi di Carico
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract
Background: L'obiettivo del presente studio prospettico di casi è stato quello di valutare i tassi di sopravvivenza degli impianti e delle protesi, le complicazioni e la perdita ossea marginale utilizzando una membrana in rete di titanio ultra-fine con posizionamento simultaneo dell'impianto, per fornire il mantenimento dello spazio necessario per la ricostruzione ossea guidata dei difetti ossei alveolari.
Materials and Methods: i pazienti sono stati reclutati e trattati in una clinica privata a Roma, Italia, tra marzo 2016 e ottobre 2017. Gli impianti conici autoperforanti sono stati posizionati attraverso un approccio assistito da template guidato da computer. L'osso autologo è stato posizionato da solo sulla superficie esposta dell'impianto, quindi mescolato con materiale osseo bovino inorganico. Infine, la membrana è stata collegata e modellata per racchiudere in modo sicuro l'area del innesto, e il cappuccio di guarigione è stato collegato e avvitato sul connettore di altezza. Le misure di esito erano: fallimento dell'impianto e della protesi, complicazioni biologiche e meccaniche, cambiamenti del livello osseo marginale e volumetrico, valutazione estetica eseguita secondo il punteggio estetico rosa (PES).
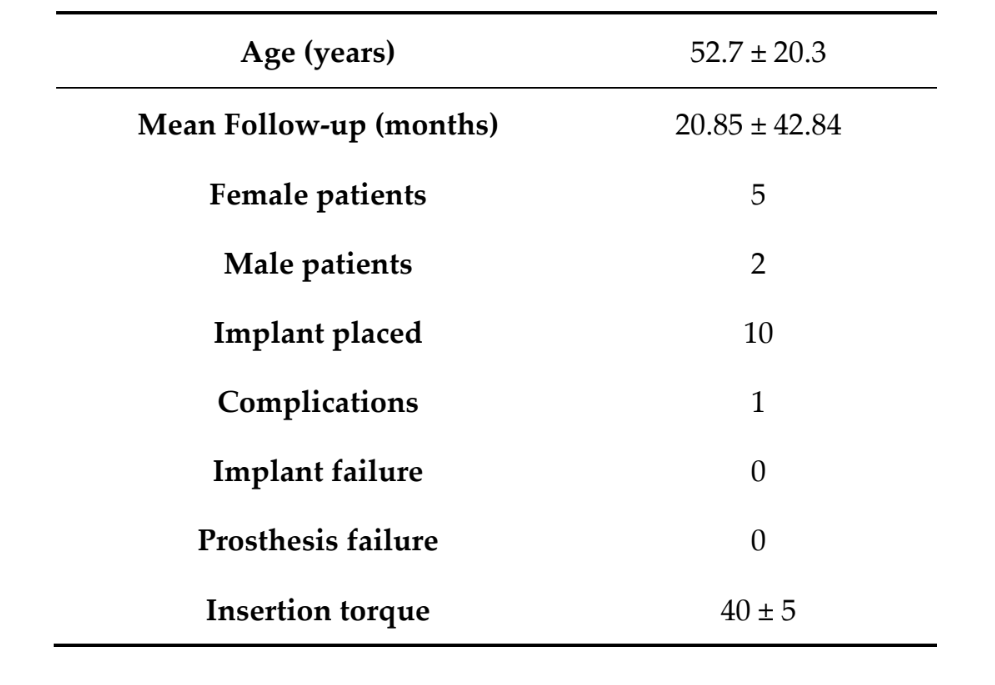
Risultati: in totale, sette pazienti (cinque donne, due uomini) con un'età media di 52,7 ± 20,3 anni (intervallo: 27–71) hanno ricevuto 10 impianti conici auto-filettanti e rigenerazione ossea guidata simultanea con membrane in titanio ultra-sottili. Nessun impianto e nessuna protesi sono falliti durante l'intero periodo di follow-up. È stata osservata una leggera esposizione della membrana un mese dopo il posizionamento dell'impianto in un paziente. La perdita ossea marginale media (MBL) al carico dell'impianto era di 0,13 ± 0,09 mm (95 % CI 0,08–0,19). All'esame di follow-up a 18 mesi, la MBL media era di 0,28 ± 0,33 mm (95 % CI 0,07–0,50). La differenza non era statisticamente significativa (0,15 ± 0,31; 95% CI 0,05–0,35; P = 0,1888). La larghezza media dell'arcata alveolare orizzontale era di 3,72 ± 1,08 mm (95% CI 3,22–4,22 mm). Durante la chirurgia di II fase, la larghezza ossea media era di 8,79 ± 0,98 mm (95% CI 8,51–9,07 mm). Il guadagno osseo medio era di 5,06 ± 1,13 mm (95% CI 4,68–5,44 mm; P = 0,000). Il volume medio dell'osso innestato calcolato utilizzando la tecnica di sovrapposizione era di 0,99 ± 0,38 CC (95% CI 0,75–1,23 CC). La PES media al carico dell'impianto era di 8,2 ± 0,8 mm (95 % CI 7,7–8,7). All'esame di follow-up a 18 mesi, la PES media era di 12,0 ± 0,7 mm (95 % CI 11,5–12,5). La differenza era statisticamente significativa (3,8 ± 0,4; 95 % CI 3,5–4,1; P = 0,0000).
Conclusione: con la limitazione del presente studio prospettico, la ricostruzione ossea guidata utilizzando una membrana in rete di titanio ultra-fine con posizionamento simultaneo dell'impianto sembra fornire risultati buoni e stabili nel successo impianto/protesi. Ulteriori ricerche con un follow-up più lungo e un campione più ampio sono necessarie per confermare i risultati di questo rapporto preliminare.
Introduzione
L'atrofia ossea alveolare è una situazione clinica cronica e progressiva caratterizzata da una perdita moderata a severa di volume osseo a causa della perdita o dell'estrazione dei denti. Inoltre, condizioni o malattie locali, come l'estrazione traumatica, la malattia parodontale e il trauma, potrebbero amplificare questa condizione patologica, rendendo difficile o sfavorevole il posizionamento degli impianti dentali sia da un punto di vista funzionale che estetico. Per superare questi possibili svantaggi, sono state introdotte tecniche di ricostruzione ossea. Tra queste, la rigenerazione ossea guidata (GBR) è una procedura chirurgica che utilizza un materiale di innesto come impalcatura isolata e protetta con una membrana, dalle cellule non osteogeniche, derivate dal tessuto connettivo adiacente. Pertanto, l'effetto barriera della membrana dovrebbe consentire solo alle cellule osteogeniche, derivate dall'osso e dai vasi circostanti, di muoversi nel difetto osseo permettendo la formazione ossea attraverso la presenza di segnali stimolanti.
Sia le membrane riassorbibili che quelle non riassorbibili sono state utilizzate per isolare e mantenere un'impalcatura biologica corretta e pianificata, necessaria per la formazione di nuovo tessuto osseo. Data la natura della loro funzione, la membrana non riassorbibile dovrebbe essere più prevedibile e sicura da usare. Tuttavia, la principale limitazione è che è necessaria un'intervento chirurgico aggiuntivo per rimuovere la membrana. Tuttavia, la ricostruzione ossea guidata viene solitamente eseguita in due fasi o con un protocollo di impianto sommerso quando eseguita in un'unica fase. Quindi, la membrana potrebbe essere rimossa al momento dell'inserimento dell'impianto o nella seconda fase se la GBR è stata eseguita contemporaneamente all'impianto.
Nella pratica quotidiana, le membrane non riassorbibili in politetrafluoroetilene espanso (e-PTFE) potrebbero essere considerate come la prima scelta nelle ricostruzioni di difetti ossei orizzontali e verticali. Tuttavia, sin dagli anni '90, vari ricercatori hanno studiato l'uso clinico della rete di titanio ultra-fine (Ti-mesh) per la ricostruzione della mandibola e del mascellare atrofici. Il titanio è più resistente al collasso rispetto alle membrane e-PTFE e riassorbibili. Pertanto, la rigidità del titanio può funzionare come un'impalcatura, mantenendo lo spazio necessario per la rigenerazione ossea, anche nei casi di un grande difetto osseo, come la ricostruzione ossea verticale.
La porosità delle reti in Ti può essere modificata per ottenere una migliore integrazione e formazione dei tessuti. Variare la porosità delle reti in Ti consente ai fluidi e ai nutrienti di passare attraverso la membrana evitando le cellule infiltranti.
Oggigiorno, sono state proposte diverse forme di membrana in Ti-mesh per massimizzare la formazione di nuovo osso, stabilizzare i materiali di innesto sotto la membrana e ridurre il rischio di esposizione della membrana, che può causare collasso e/o crescita dei tessuti molli adiacenti.
Lo scopo del presente studio prospettico di casi era valutare i tassi di sopravvivenza dell'impianto e protesici, le complicazioni, la perdita ossea marginale, utilizzando una membrana in rete di titanio ultra-fine e il posizionamento simultaneo dell'impianto, per fornire il mantenimento dello spazio necessario per l'aumento osseo dei difetti ossei alveolari. Questo studio ha seguito le disposizioni della dichiarazione Strengthening the Reporting of Observational Studies in Epidemiology (STROBE).
Materiali e Metodi
Questa ricerca è stata progettata come uno studio di casi per valutare i risultati clinici e radiografici della ricostruzione ossea guidata simultanea e del posizionamento dell'impianto con membrana in rete di titanio ultra-fine. I pazienti sono stati reclutati e trattati in una clinica privata a Roma, Italia, tra marzo 2016 e ottobre 2017. Le procedure chirurgiche sono state eseguite da un clinico esperto (MT) certificato in terapia basata su impianti presso l'associazione europea per l'osseointegrazione nel 2013. Tutti i pazienti sono stati informati sulla natura dello studio e hanno dato il loro consenso scritto per le procedure chirurgiche e protesiche e per l'uso dei dati radiologici e clinici per la pubblicazione. I principi contenuti nella Dichiarazione di Helsinki del 2013 sono stati seguiti rigorosamente. Inoltre, il protocollo radiologico è stato approvato dal Comitato Scientifico Tecnico ed Etico dell'Università di Sassari (2069/CE).
Qualsiasi paziente consecutivo di età pari o superiore a 18 anni che presentava edentulismo parziale della mascella o della mandibola, in grado di comprendere e firmare un consenso informato, e che necessitava di una riabilitazione supportata da impianti, è stato considerato idoneo per l'inclusione in questo studio. I pazienti sono stati infine inclusi se presentavano un'atrofia di classe IV a VI di Cawood e Howell del cresta alveolare residua all'esame con tomografia computerizzata a fascio conico. I pazienti sono stati esclusi se presentavano controindicazioni generali alla chirurgia implantare (come irradiazione dell'area della testa e del collo nei cinque anni precedenti all'impianto, o diabete non controllato); gravidanza o allattamento; abuso di sostanze; terapia psichiatrica o aspettative irrealistiche; trattamento precedente o in corso con bisfosfonati endovenosi; parodontite non trattata o scarsa igiene orale (sanguinamento alla sondaggio e/o indice di placca ≥ 25%); forti fumatori (≥11 sigarette/giorno); siti post-estrattivi.
Prima della chirurgia implantare, è stata eseguita una scansione CBCT (CBCT, CRANEX 3D; Soredex, Tuusula, Finlandia) e un'impronta digitale intraorale (scanner intraorale CS 3600, Carestream Dental, Atlanta, GA, USA). La scansione CBCT è stata impostata con un campo visivo di 80 mm× 150 mm; dimensione del voxel di 0.3 µm; 90 KV; 6.3–10 mA per 4.5 s, risultando in un prodotto dose-area di 579.7–920.2 (mGycm2). I dati STL e DICOM (Digital Imaging and COmmunications in Medicine) sono stati importati in un software dedicato per la diagnosi e la pianificazione implantare (3Diagnosys versione 4.2, 3DIEMME srl, Cantù, Italia). Successivamente, gli impianti guidati protesicamente sono stati pianificati virtualmente.
Un'ora prima dell'intervento, è stata somministrata una singola dose di antibiotici (2 g di amoxicillina e acido clavulanico, o 600 mg di clindamicina in caso di allergia alla penicillina) a scopo profilattico. Un collutorio a base di digluconato di clorexidina allo 0,2% è stato somministrato per due minuti prima dell'intervento.
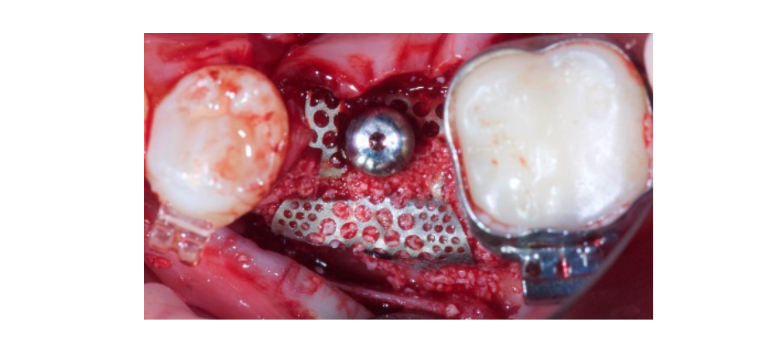
Tutti i pazienti sono stati trattati sotto sedazione orale con diazepam 10 mg (Valium, Roche S.p.A., Monza, Italia). È stata somministrata anestesia locale utilizzando articaine con adrenalina 1:100.000. È stata effettuata un'incisione midcrestale nel tessuto cheratinizzato utilizzando una lama di bisturi chirurgico n. 15C. È stato sollevato un lembo a tutto spessore oltre il giunzione mucogengivale. Successivamente, sono state effettuate due incisioni verticali a una distanza di un dente dal difetto osseo, o almeno 5 mm di distanza in caso di area edentula. Poi, il sito ricevente è stato pulito rimuovendo tutti i residui di tessuto molle. L'impianto TSIII autoperforante conico (Osstem Implant, Seoul, Corea) è stato posizionato attraverso un approccio assistito da template guidato dal computer, a livello osseo o 1 mm più in profondità, secondo il protocollo di perforazione suggerito dal produttore. Tutti i template chirurgici erano supportati dai denti e sono stati realizzati senza maniche metalliche. La caratteristica principale della membrana OssBuilder è che è fissata direttamente all'impianto in un approccio a una sola fase. Per garantire la membrana sull'impianto, deve essere utilizzato uno strumento speciale chiamato connettore di altezza (Osstem Implant). Questo strumento è disponibile in diverse altezze per collegare la membrana all'impianto a diversi livelli a seconda dell'osso residuo e della profondità dell'impianto. Utilizzando un driver esagonale da 1.2, il connettore di altezza è stato avvitato al fixture a 5-8 N·cm. Successivamente, è stato prelevato osso autologo dall'area adiacente, utilizzando un collettore di osso corticale minimamente invasivo (Micross, Meta, Italia). L'osso è stato prelevato nell'area mesiale o distale vicino al difetto. Successivamente, il difetto osseo è stato misurato per determinare la forma e la dimensione appropriate della membrana in rete di titanio (OssBuilder, Osstem Implant). Tutte le membrane utilizzate erano in titanio puro grado 2 e progettate con pori di diametro da 0,6 a 1 mm.
Il osso autologo è stato posizionato da solo sulla superficie dell'impianto esposta. Poi, è stato utilizzato uno strato secondario composto da osso autologo mescolato con materiale osseo bovino anorganico (Bio-OSS, Geistlich Biomaterials Italia S.r.l.) in un rapporto 1:1, per innestare il difetto rimanente. L'innesto osseo è stato sovra-contornato per compensare la resorbimento finale dell'innesto. Infine, la membrana è stata collegata al connettore di altezza e modellata per racchiudere in modo sicuro l'area dell'innesto, e il cappuccio di guarigione è stato collegato e avvitato sul connettore di altezza utilizzando il driver del cappuccio di copertura a 5-8 N·cm. È stata effettuata un'incisione periostale per consentire un'adattamento passivo, senza tensione e la chiusura del lembo. La ferita è stata suturata in due strati con una sutura in poliglecaprone 910 4-0 (Vicryl V271; Ethicon, West Somerville, NJ, USA) (Figure 1–3). È stata somministrata una copertura antibiotica per sette giorni (1 g di amoxicillina e acido clavulanico o 300 mg di clindamicina due volte al giorno) dopo l'intervento. È stato prescritto un collutorio a base di digluconato di clorexidina allo 0,2% per un minuto, due volte al giorno, per tre settimane, e una dieta morbida è stata raccomandata per quattro settimane. Ibuprofene 400 mg (o paracetamolo 1 g) doveva essere assunto in caso di dolore.
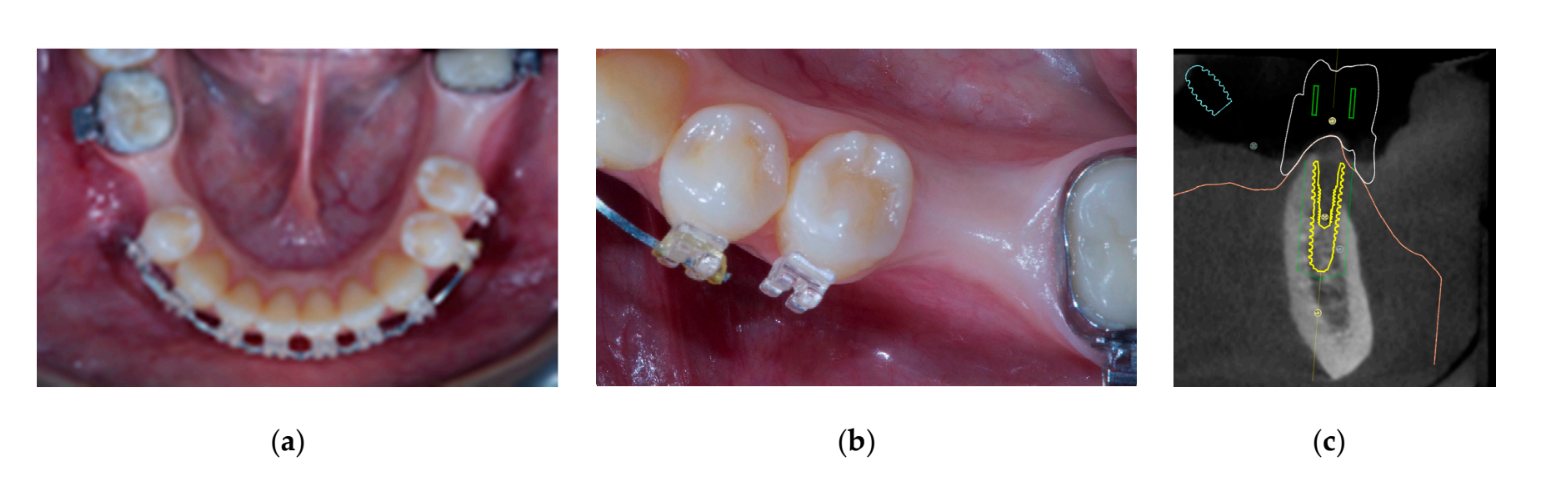
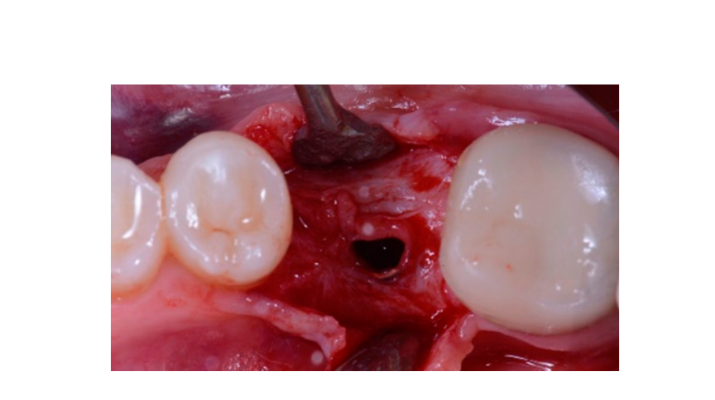
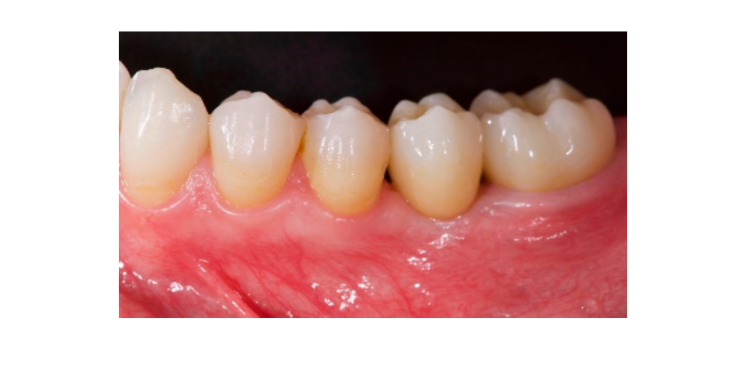
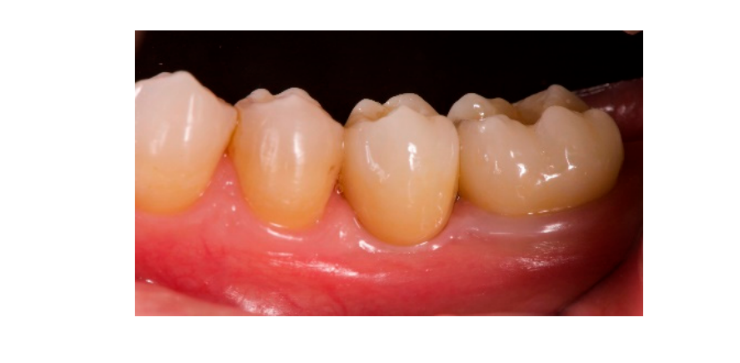
Sette otto mesi dopo il posizionamento dell'impianto, il paziente ha subito una seconda scansione CBCT per valutare la ricostruzione ossea. La scansione CBCT è stata impostata con un campo visivo di 60 mm × 80 mm; dimensione del voxel di 0,3 µm; 90 kV; 4–6,3 mA per 2,3 s, risultando in un prodotto dose-area di 192,4–307,8 (mGycm2). Successivamente, è stata eseguita una procedura chirurgica di secondo stadio, assicurandosi di preservare il tessuto cheratinizzato attorno all'impianto dentale. La rete di titanio ultra-fine è stata rimossa con cura e un abutment di guarigione è stato avvitato sul fissaggio (Figura 4). Una membrana di fibrina ricca di piastrine (PRF) è stata quindi adattata sopra l'osso ricostruito e il lembo è stato tirato coronariamente e suturato. Due settimane dopo, è stata fornita una restaurazione provvisoria. Tre o quattro mesi dopo, è stata consegnata una restaurazione in zirconia trattenuta da vite CAD/CAM (Figure 5 e 6). L'occlusione è stata regolata per evitare contatti prematuri. Sono state effettuate radiografie periapicali e fotografie cliniche. Le visite di follow-up sono state programmate ogni tre mesi dopo il posizionamento dell'impianto (Figure 7 e 8).
Misure degli esiti inclusi:
- Percentuale di sopravvivenza degli impianti: un impianto è stato considerato un fallimento se presentava qualsiasi mobilità, frattura dell'impianto o un'infezione che richiedeva la rimozione dell'impianto.
- Una ricostruzione è stata considerata fallita se doveva essere sostituita da un'alternativa di ricostruzione.
- Presenza di complicazioni biologiche (dolore, gonfiore, suppurazione, ecc.) o meccaniche (allentamento della vite o frattura della struttura e/o del materiale di rivestimento, ecc.).
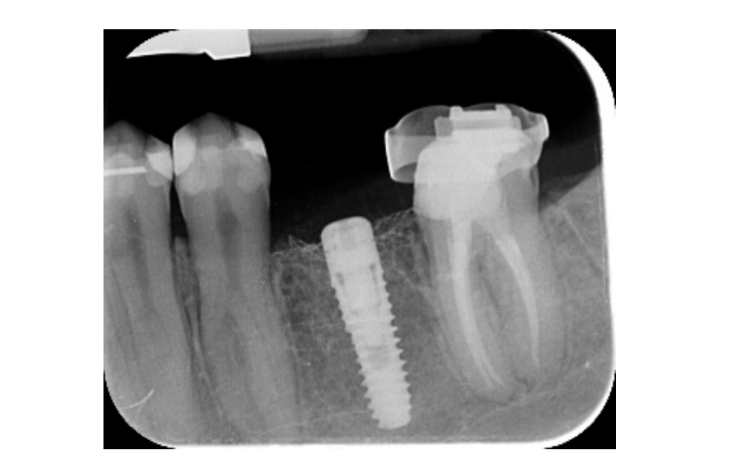
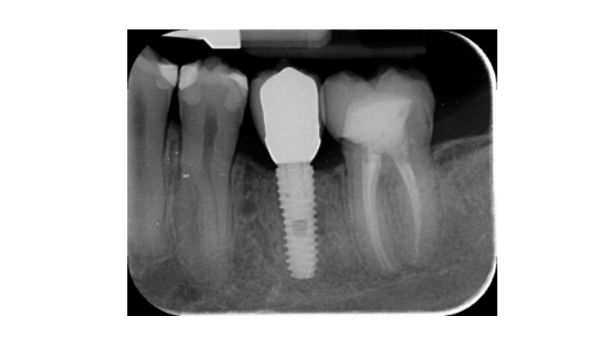
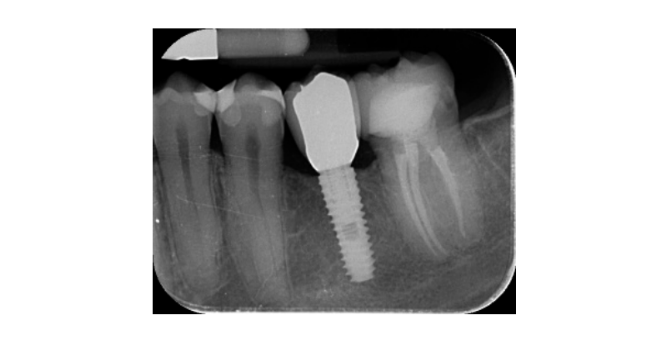
- Le variazioni del livello osseo marginale sono state valutate mediante radiografie periapicali digitali (Digora Optime; Soredex, Tuusula, Finlandia) utilizzando la tecnica parallela e supporti per film commercialmente disponibili. Sono stati valutati tre punti temporali, al posizionamento dell'impianto (baseline), immediatamente dopo l'inserimento della ricostruzione e un anno dopo il carico. Le distanze medie mesiali e distali dal margine coronale più alto dell'impianto e il primo contatto osseo con l'impianto sono state misurate con una precisione di 0,01 mm e considerate come livello osseo marginale. La differenza nei livelli tra i punti temporali è stata considerata come perdita ossea marginale (MBL).
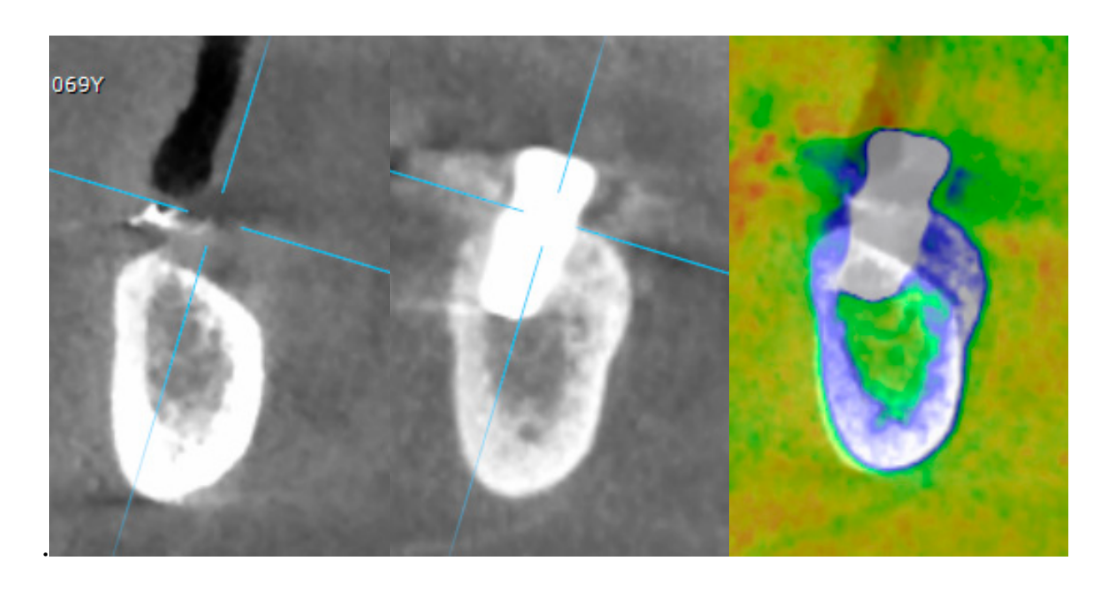
- Il rialzo osseo orizzontale è stato valutato nelle scansioni CBCT, 1 mm al di sotto della cresta ossea originale. I dati volumetrici sono stati sovrapposti utilizzando i denti adiacenti come punti di riferimento, e un nuovo set di dati DICOM generato è stato memorizzato come file separati. Le misurazioni sono state effettuate prima e dopo il trattamento, e la differenza di queste due misurazioni è stata considerata come rialzo osseo orizzontale (Figura 9).
- Le misurazioni volumetriche dell'osso ricostruito sono state eseguite automaticamente sul set di dati volumetrici CBCT fusi, utilizzando il modulo Fusion del software OnDemand 3D (Cybermed Inc., Seoul, Corea), secondo un protocollo precedentemente pubblicato [8].
- La valutazione estetica è stata effettuata secondo il punteggio estetico rosa (PES) sulle immagini vestibolari e occlusali scattate includendo almeno un dente adiacente per lato. I valori sono stati valutati a 6 e 12 mesi dopo gli esami di follow-up (follow-up di 18 mesi). Sette variabili (papilla mesiale, papilla distale, livello dei tessuti molli, contorno dei tessuti molli, carenza del processo alveolare, colore e texture dei tessuti molli) sono state valutate con un punteggio di 2-1-0 (2 è il migliore e 0 è il peggiore) dallo stesso dentista cieco.
I tassi chirurgici di impianto e protesi e le complicazioni sono stati valutati dagli stessi clinici che hanno eseguito tutti i casi (MT). La perdita ossea marginale e il punteggio estetico rosa sono stati valutati da un valutatore indipendente non precedentemente coinvolto nello studio (MM). È stata eseguita un'analisi descrittiva per media ± deviazione standard (SD), mediana e intervallo di confidenza al 95% (CI) utilizzando Numbers (Versione 5.2) per Mac OS High Sierra 10.X. I confronti tra i follow-up sono stati effettuati mediante un test t di Student accoppiato utilizzando SPSS (Versione 22.0; IBM Corporation, Armonk, NY, USA) per Mac OS High Sierra 10.X. Tutti i confronti statistici sono stati condotti a un livello di significatività di 0,05. L'unità statistica era l'impianto.
Risultati
In totale, sette pazienti (cinque donne, due uomini) con un'età media di 52,7 ± 20,3 anni (intervallo: 27–71) hanno ricevuto 10 impianti TSIII auto-filettanti a forma conica (Osstem Implant) e rigenerazione ossea guidata simultanea con membrane in titanio ultra-fini (OssBuilder; Osstem Implant). 18 mesi dopo il carico, nessun paziente ha abbandonato e non si è verificata alcuna deviazione dal protocollo originale. Il tempo medio di follow-up è stato di 20,85 ± 42,84 mesi dopo l'inserimento dell'impianto (intervallo: 18–24 mesi). Tutti gli impianti sono stati inseriti con coppie comprese tra 35 e 45 N·cm utilizzando un approccio guidato da template basato su computer (Tabella 1).
Nessun impianto e nessuna protesi è fallita durante il periodo di follow-up. È stata osservata una leggera esposizione della membrana un mese dopo il posizionamento dell'impianto in un paziente. Ai pazienti è stato istruito di spazzolare delicatamente la membrana con uno spazzolino morbido e di applicare uno spray di clorexidina due volte al giorno. La completa guarigione dei tessuti molli è stata osservata quattro settimane dopo.
Tutti gli impianti sono stati posizionati a livello osseo o 1 mm più in profondità. La perdita media di osso marginale al carico dell'impianto è stata di 0,13 ± 0,09 mm (95% CI 0,08–0,19). All'esame di follow-up a 18 mesi, la perdita media di osso marginale era di 0,28 ± 0,33 mm (95% CI 0,07–0,50). La differenza non era statisticamente significativa (0,15 ± 0,31; 95% CI 0,05–0,35; P = 0,1888) (Tabella 2).

La larghezza media dell'arcata alveolare orizzontale era di 3,72 ± 1,08 mm (IC 95% 3,22–4,22 mm). Durante la chirurgia di II fase, la larghezza media dell'osso era di 8,79 ± 0,98 mm (IC 95% 8,51–9,07 mm). Il guadagno medio di osso era di 5,06 ± 1,13 mm (IC 95% 4,68–5,44 mm; P = 0,000). Il volume medio dell'osso innestato calcolato utilizzando la tecnica di sovrapposizione era di 0,99 ± 0,38 CC (IC 95% 0,75–1,23 CC).
La PES media al carico dell'impianto era di 8,2 ± 0,8 mm (IC 95% 7,7–8,7). All'esame di follow-up a 18 mesi, la PES media era di 12,0 ± 0,7 mm (IC 95% 11,5–12,5). La differenza era statisticamente significativa (3,8 ± 0,4; IC 95% 3,5–4,1; P = 0,0000) (Tabella 2).
Discussione
La presente ricerca è stata condotta per valutare i dati clinici e radiologici, un anno dopo il carico, di una rigenerazione ossea guidata utilizzando una membrana in rete di titanio ultra-fine con posizionamento simultaneo dell'impianto, per fornire un effetto di supporto (mantenimento dello spazio) necessario per consentire la ricostruzione ossea dei difetti ossei crestali. Poiché questa ricerca è stata progettata come uno studio prospettico di casi, la sua principale limitazione è la mancanza di un gruppo di controllo. La principale limitazione del presente studio era la piccola dimensione del campione. Tuttavia, questa ricerca è stata progettata come uno studio prospettico di casi. Questa limitazione potrebbe essere risolta eseguendo ulteriori prove con dimensioni del campione più grandi, che potrebbero essere calcolate sulla base dei risultati preliminari del presente studio. Un'altra limitazione di questo studio, che potrebbe essere un fattore confondente, era che il biotipo gengivale non è stato considerato. Tuttavia, i risultati del presente studio erano in accordo con rapporti precedentemente pubblicati. Infatti, diversi ricercatori hanno sostenuto le proprietà meccaniche ideali della rete di Ti in termini di rigidità, plasticità ed elasticità. Inoltre, la rete di Ti sembra essere meno suscettibile alla contaminazione batterica, rispetto ai materiali riassorbibili. Per sottolineare questo concetto, gli autori hanno osservato solo una leggera esposizione della membrana un mese dopo il posizionamento dell'impianto. Ai pazienti è stato istruito di spazzolare delicatamente la membrana con uno spazzolino morbido e di applicare uno spray di clorexidina due volte al giorno. La completa guarigione dei tessuti molli è stata osservata quattro settimane dopo. Questa lieve complicazione suggerisce l'efficacia di questa rete di titanio. Inoltre, in questo studio prospettico nessun impianto e nessuna protesi sono falliti durante il periodo di follow-up. Grazie a questi dati è ragionevole considerare questa procedura sicura e facile per il clinico. Diverse caratteristiche delle membrane barriera sono necessarie per una riuscita ricostruzione ossea guidata, come la gestibilità clinica, la biocompatibilità, la capacità di creazione di spazio, l'esclusione cellulare e l'integrazione tissutale. Le reti di Ti sono membrane non riassorbibili, e la loro porosità può essere variata per ottenere compatibilità tissutale. Nel presente studio, è stata utilizzata una membrana in titanio puro di grado 2 ultra-fine. Lo spessore della rete di titanio era di 100 µm, mentre la porosità era di 0,6 a 1 mm di diametro. I pori di 1 mm di diametro possono fornire un apporto ottimale di sangue e diffusione di fattori di crescita, necessari per la promozione della guarigione e della rigenerazione ossea. Tuttavia, i pori di 0,6 mm di diametro possono prevenire lo spostamento o la migrazione del materiale di innesto osseo consentendo al contempo la diffusione dell'apporto di sangue. Inoltre, queste membrane presentavano alcune perforazioni laterali che dovrebbero essere in grado di mantenere un'elevata resistenza meccanica, consentendo al contempo flessibilità per la modellazione e la modifica.
Tuttavia, l'esposizione della membrana e l'infezione sono relativamente comuni. A differenza della membrana in PTFE che è relativamente spessa, circa 200 µm, e suscettibile all'intrappolamento batterico a causa della sua struttura porosa, il titanio può essere prodotto in una forma più sottile.
Recentemente, i modelli di superficie ultra-fini associati a pori, canali e altre caratteristiche nei bioscaffold sono noti per influenzare la migrazione, la proliferazione e la differenziazione cellulare. Pertanto, la tecnologia di lavorazione laser è favorevole per creare una varietà di modelli di superficie ultra-fini.
Per ottenere una buona e prevedibile rigenerazione ossea, il innesto osseo dovrebbe includere tre caratteristiche:
(1) Cellule osteoblastiche o cellule staminali mesenchimali; (2) Fattori di crescita, per garantire il progresso della rigenerazione; e (3) Uno 'scheletro' in grado di offrire supporto meccanico per l'adesione e la proliferazione cellulare.
Gli autori hanno ipotizzato che questa struttura ultra-fine, utilizzata in questo studio prospettico, consenta di minimizzare l'ingrowth dei tessuti molli nella micro perforazione e mantenga la permeabilità dei nutrienti o del fluido tissutale attraverso la membrana, il che promuoverebbe l'adesione, la migrazione e la proliferazione delle cellule derivate dal midollo osseo, portando a una maggiore rigenerazione ossea.
Negli ultimi dieci anni, studi a lungo termine hanno valutato e sottolineato che la GBR è una tecnica di successo e prevedibile per il clinico per ottenere un'augmentation verticale e orizzontale del rialzo. La GBR può essere ottenuta con due approcci diversi: l'applicazione di una membrana rinforzata in titanio in politetrafluoroetilene (PTFE) (cioè, una membrana non riassorbibile) e una rete di titanio ultra-fine o una membrana di collagene (cioè, una membrana riassorbibile). Gli impianti sono stati posizionati utilizzando un approccio assistito da template guidato da computer, a livello osseo o 1 mm più in profondità, secondo il protocollo di perforazione suggerito dal produttore. A nostro avviso, questo approccio guidato consente una migliore installazione dell'impianto guidata protesicamente e permette la rigenerazione ossea in conformità con la protesi necessaria.
I risultati del presente studio sono in accordo con la letteratura recente pubblicata sugli impianti posizionati dopo o durante la procedura di GBR.
Conclusioni
Con le limitazioni del presente studio prospettico, la ricostruzione ossea guidata utilizzando una membrana in rete di titanio ultra-fine con posizionamento simultaneo dell'impianto, per fornire il mantenimento dello spazio necessario per l'augmentation ossea dei difetti ossei alveolari sembra fornire successo impianto/protesi. Ulteriori ricerche con un campione più ampio e un follow-up più lungo sono necessarie per confermare questi risultati preliminari.
Marco Tallarico, Francesco Mattia Ceruso, Leonardo Muzzi, Silvio Mario Meloni, Yong-Jin Kim, Marco Gargari e Matteo Martinolli
Riferimenti
- Atwood, D.A. Riduzione delle creste residue: una principale entità di malattia orale. J. Prosthet. Dent. 1971, 26, 266–279.
- Chiapasco, M.; Casentini, P.; Zaniboni, M. Procedure di aumento osseo in odontoiatria implantare. Int. J. Oral Implant. 2009, 24, 237–259.
- Rakhmatia, Y.D.; Jinno, Y.; Furuhashi, A.; Koyano, K.; Ayukawa, Y. Analisi della microtomografia computerizzata della guarigione ossea in fase iniziale utilizzando una rete di titanio micro-porosa per la rigenerazione ossea guidata: esperimento preliminare in un modello canino. Odontology 2017, 8, 25–417.
- Meloni, S.M.; Jovanovic, S.A.; Pisano, M.; De Riu, G.; Baldoni, E.; Tallarico, M. Rigenerazione ossea guidata orizzontale in un'unica fase con osso autologo, osso bovino anorganico e membrane di collagene: Follow-up di uno studio prospettico 30 mesi dopo il carico. Eur. J. Oral Implantol. 2018, 11, 89–95.
- Becker, W.; Becker, B.; Mellonig, J. Uno studio prospettico multicentrico che valuta la rigenerazione parodontale per invasioni di furcazione di classe II e difetti infrabony dopo trattamento con una membrana barriera bioassorbibile: risultati a 1 anno. J. Periodontol. 1996, 67, 641–649.
- Zitzmann, N.U.; Naef, R.; Scharer, P. Membrane riassorbibili versus non riassorbibili in combinazione con Bio-Oss per la rigenerazione ossea guidata. Int. J. Oral Maxillofac. Implants 1997, 12, 844–852.
- Merli, M.; Moscatelli, M.; Mariotti, G.; Rotundo, R.; Bernardelli, F.; Nieri, M. Variazione del livello osseo dopo aumento verticale della cresta: barriere riassorbibili versus barriere rinforzate in titanio. Uno studio clinico randomizzato in doppio cieco di 6 anni. Int. J. Oral Maxillofac. Implants 2014, 29, 905–913.
- Meloni, S.M.; Jovanovic, S.A.; Urban, I.; Canullo, L.; Pisano, M.; Tallarico, M. Aumento della cresta orizzontale utilizzando GBR con una membrana di collagene nativo e un rapporto 1:1 di xenograft particolato e osso autologo: Uno studio clinico prospettico di 1 anno. Clin. Implant Dent. Relat. Res. 2017, 19, 38–45.
- Sottosanti, J.S. Solfato di calcio: un'aggiunta preziosa al complesso impianto/regenerazione ossea. Dent. Implant. Updat. 1997, 8, 25–29.
- Roccuzzo, M.; Ramieri, G.; Spada, M.C.; Bianchi, S.D.; Berrone, S. Aumento verticale della cresta alveolare mediante rete di titanio e innesti ossei autogeni. Clin. Oral Implant. 2004, 15, 73–81.
- Rakhmatia, Y.D.; Ayukawa, Y.; Furuhashi, A.; Koyano, K. Membrane barriera attuali: rete di titanio e altre membrane per la rigenerazione ossea guidata nelle applicazioni dentali. J. Prosthodont. 2013, 57, 3–14.
- Tallarico, M.; Martinolli, M.; Kim, Y.; Cocchi, F.; Meloni, S.M.; Alushi, A.; Xhanari, E. Accuratezza del posizionamento degli impianti assistito da computer utilizzando due diversi modelli chirurgici progettati con o senza maniche metalliche: uno studio controllato randomizzato. Dent. J. 2019, 7, 41.
- Tallarico, M.; Kim, Y.J.; Cocchi, F.; Martinolli, M.; Meloni, S.M. Accuratezza dei modelli progettati con maniche recentemente sviluppati per l'inserimento di impianti dentali: uno studio clinico prospettico multicentrico. Clin. Implant Dent. Relat. Res. 2019, 21, 108–113.
- Fürhauser, R.; Florescu, D.; Benesch, T.; Haas, R.; Mailath, G.; Watzek, G. Valutazione dei tessuti molli attorno alle corone di impianti singoli: il punteggio estetico rosa. Clin. Oral Implant. 2005, 16, 639–644.
- Ciocca, L.; Lizio, G.; Baldissara, P.; Sambuco, A.; Scotti, R.; Corinadesi, G. Aumento osseo guidato protesicamente CAD-CAM delle mascelle atrofizzate utilizzando rete di titanio personalizzata: risultati preliminari di uno studio prospettico aperto. J. Oral Implant. 2018, 44, 131–137.
- Schopper, C.H.; Goriwoda, W.; Moser, D. Risultati a lungo termine dopo rigenerazione ossea guidata con membrane di titanio riassorbibili e microporose. J. Oral Maxillofac. Surg. Clin. North Am. 2001, 13, 449–458.
- Scantlebury, T.V. 1982-1992: un decennio di sviluppo tecnologico per la rigenerazione tissutale guidata. J. Periodontol. 1993, 64, 1129–1137.
- A Fugazzotto, P. Tassi di successo e fallimento degli impianti osseointegrati in funzione in osso rigenerato per 72 a 133 mesi. Int. J. Oral Implant. 2005, 20, 77–83.
- Kim, Y.-K.; Yun, P.-Y.; Kim, S.-G.; Oh, D.S. Confronto in vitro della superficie interna di membrane non riassorbibili esposte e non esposte mediante microscopia elettronica a scansione. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2009, 107, e5–e11.
- Watzinger, F.; Luksch, J.; Millesi, W.; Schopper, C.; Neugebauer, J.; Moser, D.; Ewers, R. Rigenerazione ossea guidata con membrane di titanio: uno studio clinico. Br. J. Oral Surg. 2000, 38, 312–315.
- Selvig, K.A.; Kersten, B.G.; Chamberlain, A.D.H.; Wikesjö, U.M.E.; Nilvúus, R.E. Chirurgia rigenerativa dei difetti parodontali intrabony utilizzando membrane barriera in ePTFE: valutazione microscopica elettronica delle membrane recuperate rispetto alla guarigione clinica. J. Periodontol. 1992, 63, 974–978.
- Hasegawa, H.; Masui, S.; Ishihata, H.; Kaneko, T.; Ishida, D.; Endo, M.; Kanno, C.; Yamazaki, M.; Kitabatake, T.; Utsunomiya, S.; et al. Valutazione di una nuova membrana in titanio puro microperforata progettata per la rigenerazione ossea guidata. Int. J. Oral Maxillofac. Implants 2019, 34, 411–422.
- Roberts, E.W.; E Simmons, K.; Garetto, L.P.; A DeCastro, R. Fisiologia e metabolismo osseo nell'implantologia dentale: fattori di rischio per l'osteoporosi e altre malattie ossee metaboliche. Implant. Dent. 1992, 1, 11–21.
- Wessing, B.; Urban, I.; Montero, E.; Zechner, W.; Hof, M.; Chamorro, J.A.; Martin N.A.; Polizzi, G.; Meloni, S.; Sanz, M. Uno studio clinico controllato randomizzato multicentrico utilizzando una nuova membrana di collagene non incrociata riassorbibile per la rigenerazione ossea guidata in siti di impianto singolo deiscente: risultati intermedi di una procedura di aumento osseo. Clin. Oral Implants Res. 2017, 28, e218–e226, doi: 10.1111/clr.12995.
- Urban, I.; Wessing, B.; Alández, N.; Meloni, S.; González-Martin, O.; Polizzi, G.; Sanz-Sanchez, I.; Montero, E.; Zechner, W. Uno studio clinico controllato randomizzato multicentrico utilizzando una nuova membrana di collagene per la rigenerazione ossea guidata in siti di impianto singolo deiscente: Risultato alla consegna protesica e al follow-up di 1 anno. Clin. Oral Implants Res. 2019, doi: 10.1111/clr.13426.