Correzione della Deiscenza Ossea Buccale Peri-Implantare Dopo Tecnica di Aumento Sub-Periostale con Graft Xenogenico in Blocco o Particolato: Uno Studio Retrospettivo
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract
Obiettivo: Valutare l'efficacia della tecnica di Strato Augmentato Sub-periostale (SPAL) eseguita con minerale osseo bovino deproteinizzato (DBBM), fornito sia come particolato (pDBBM) che come blocco (bDBBM), nella correzione di una deiscenza ossea peri-implantare (PIBD). Sono stati esaminati anche gli impianti che presentavano una piastra ossea buccale peri-implantare (PBBP) spessa (≥ 2 mm) al momento dell'inserimento.
Materiali e Metodi: Pazienti con una PIBD ≥ 1 mm, trattati con SPAL con pDBBM (SPALparticulate) o bDBBM (SPALblock), e pazienti con un impianto che mostrava una PBBP ≥ 2 mm all'inserimento (CONTROL) sono stati inclusi. La riapertura è stata eseguita sia a 6 mesi (gruppi SPAL) che a 3 mesi (CONTROL). Il tasso di pazienti che non presentavano PIBD alla riapertura è stato l'esito primario. L'altezza della deiscenza ossea (BDH) e la larghezza (BDW), lo spessore dei tessuti buccali (BTT) e il livello osseo marginale (MBL) sono stati esiti secondari.
Risultati: Trentanove impianti in 39 pazienti (14 in SPALparticulate, 14 in SPALblock e 11 in CONTROL) sono stati analizzati. Nessuna PIBD è stata trovata in SPALparticulate mentre in SPALblock era presente una PIBD. Due pazienti in CONTROL presentavano una PIBD. È stata osservata una riduzione sia in BDH che in BDW sia in SPALparticulate (2.7 ± 1.6 mm per BDH e 3.9 ± 0.2 mm per BDW) che in SPALblock (2.5 ± 1.8 mm per BDH e 3.8 ± 1.1 mm per BDW). SPALblock ha mostrato un BTT maggiore rispetto a SPALparticulate alla riapertura (3.6 ± 1.3 mm per SPALblock e 2.6 ± 0.6 mm per SPALparticulate, p = 0.0160). Tutti i gruppi hanno mostrato un MBL simile.
Introduzione
Il posizionamento degli impianti guidato protesicamente in una dimensione ossea orizzontale ridotta spesso porta a una deiscenza ossea peri-implantare (PIBD) (Bressan et al. 2017; Pramstraller et al. 2018).
Piccole deiscenze ossee lasciate per guarigione spontanea hanno rivelato una maggiore perdita ossea verticale nell'aspetto buccale dopo l'inserimento dell'impianto e anche una maggiore perdita ossea marginale rispetto ai siti trattati con GBR (Jung et al. 2017; Monje et al. 2023). Sebbene gli impianti con piccole deiscenze ossee buccali non contenute abbiano mostrato alti tassi di sopravvivenza e tessuti peri-implantari sani a un follow-up di 7,5 anni (Waller et al. 2020), la presenza di una PIBD evidente è stata associata a una maggiore incidenza di mucosite e peri-implantite, nonché a una progressione più rapida della peri-implantite rispetto agli impianti completamente circondati da osso (Schwarz, Sahm e Becker 2012; Monje et al. 2019). Nonostante il valore prognostico di una PIBD sulla salute a lungo termine dei tessuti peri-implantari sia ancora controverso, la correzione di una deiscenza ossea buccale al momento del posizionamento dell'impianto è stata recentemente raccomandata per favorire la stabilità e le condizioni di salute dei tessuti peri-implantari nel tempo (Herrera et al. 2023; Monje et al. 2023; Song et al. 2024).
Per trattare un PIBD, sono state proposte procedure di aumento osseo o dei tessuti molli. Entrambi i trattamenti hanno dimostrato di fornire risultati clinici e radiografici stabili nel medio e lungo termine (Jensen et al. 2023; Monje et al. 2023). Tra le diverse procedure di aumento osseo laterale durante il posizionamento simultaneo dell'impianto, la Rigenerazione Ossea Guidata (GBR) e la tecnica di Strato Augmentato Sub-periostale Peri-impianto (SPAL, Trombelli et al. 2018) sono state associate a un'alta probabilità di correggere completamente un PIBD (Severi et al. 2022). In particolare, la SPAL si basa sull'uso del periostio del paziente come membrana barriera per contenere un innesto che funge da impalcatura "creatrice di spazio". Quando eseguita in combinazione con un innesto particolato di minerale osseo bovino deproteinizzato (DBBM) (pDBBM), la SPAL ha dimostrato di essere efficace nel correggere completamente fino al 90,9% dei PIBD (Trombelli et al. 2019, 2020). Uno studio retrospettivo recente ha confrontato le condizioni dei tessuti duri e molli peri-impianto in impianti presentanti un PIBD trattato con SPAL o un PBBP spesso (≥ 2 mm) al momento del posizionamento dell'impianto (Trombelli et al. 2020). Sebbene siano state riscontrate condizioni sane simili dei tessuti peri-impianto in entrambi i gruppi, è stata trovata una posizione più apicale del livello osseo marginale radiografico (MBL) nel gruppo SPAL, suggerendo un diverso modello di rimodellamento dell'innesto rispetto all'osso nativo (Trombelli et al. 2020). Questi risultati possono mettere in discussione la rilevanza delle caratteristiche fisico-chimiche dell'innesto rispetto alla stabilità del risultato ricostruttivo dopo SPAL. A questo proposito, un rapporto aneddotico ha suggerito che l'uso di un blocco di DBBM (bDBBM) potrebbe essere un'alternativa di successo in combinazione con SPAL (Trombelli et al. 2022).
Pertanto, l'obiettivo del presente studio retrospettivo era valutare l'efficacia della SPAL eseguita in combinazione con pDBBM o bDBBM nella correzione di un PIBD. Inoltre, sono state analizzate le modifiche nel tessuto duro peri-implantare che si verificano dal posizionamento dell'impianto fino al rientro per la scopertura dell'impianto. È stato esaminato anche un gruppo di controllo composto da impianti che mostrano un PBBP spesso (≥ 2 mm) al posizionamento dell'impianto.
Materiali e Metodi
2.1 Aspetti Etici
Il presente studio retrospettivo è stato approvato dal Comitato Etico dell'Area Vasta Emilia Centro, Italia (protocollo n° 523/2024/Oss/UniFe, data di approvazione 16.10.2024). Ogni paziente ha fornito un consenso informato scritto prima del trattamento chirurgico.
Tutte le procedure cliniche sono state eseguite in conformità con la Dichiarazione di Helsinki e le Linee Guida sulle Buone Pratiche Cliniche (GCP).
2.2 Popolazione dello Studio
Le cartelle cliniche dei pazienti sottoposti a riabilitazione protesica supportata da impianto nel periodo maggio 2020-settembre 2021 presso il Centro di Ricerca per lo Studio delle Malattie Parodontali e Peri-implantari, Università di Ferrara, e presso uno studio dentistico privato con sede a Ferrara sono state esaminate per determinare l'idoneità dei pazienti per lo studio. Il presente studio retrospettivo è stato condotto seguendo le linee guida/checklist della dichiarazione STROBE per studi trasversali.
In base alle condizioni della piastra ossea buccale al momento dell'inserimento dell'impianto e della gestione chirurgica, i pazienti sono stati suddivisi in 2 gruppi:
- Pazienti con almeno un impianto che presenta un PIBD ≥ 1 mm, trattati con SPAL in combinazione con pDBBM (gruppo SPALparticolato );
- Pazienti con almeno un impianto che presenta un PIBD ≥ 1 mm, trattati con SPAL in combinazione con bDBBM (gruppo SPALblocco ).
I gruppi SPAL comprendevano pazienti trattati consecutivamente per i quali erano disponibili misurazioni cliniche e radiografiche pertinenti per l'analisi dei dati. Se due o più impianti nello stesso paziente erano idonei per lo studio, solo l'impianto con il PIBD con la maggiore deiscenza ossea è stato selezionato per l'analisi. Inoltre, i pazienti con almeno un impianto che presentava uno spessore residuo di PBBP ≥ 2 mm dopo l'inserimento dell'impianto sono stati considerati come gruppo di controllo (gruppo CONTROL).
Tutti gli impianti selezionati dovevano essere posizionati in una cresta ossea guarita (impianti di tipo 4C, Gallucci et al. 2018) e dovevano mostrare stabilità primaria, come valutato dal torque di inserimento. I forti fumatori (consumo di sigarette > 10 sigarette/giorno) e i pazienti con diabete mellito al momento dell'intervento chirurgico sono stati esclusi dallo studio.
2.3 Procedure Cliniche
2.3.1 Procedure Pre-Operative
Prima dell'inserimento dell'impianto, tutti i pazienti avevano ricevuto una terapia attiva per il trattamento delle lesioni cariose e delle malattie parodontali, ed erano stati iscritti a un programma di manutenzione professionale con frequenza delle visite programmata secondo lo strumento di valutazione PerioRisk (Trombelli et al. 2009, 2017; Farina et al. 2021).
Tutte le procedure chirurgiche sono state eseguite da due operatori formati (L.T., M.S.). Ai pazienti è stata somministrata 2 g di amoxicillina + acido clavulanico (Augmentin, GlaxoSmithKline, Verona, Italia) 1 h prima dell'intervento chirurgico. L'anestesia locale è stata ottenuta utilizzando articaine con 1:100.000 di epinefrina somministrata per infiltrazione locale.
2.3.2 Procedure Chirurgiche
2.3.2.1 Gruppi SPAL.
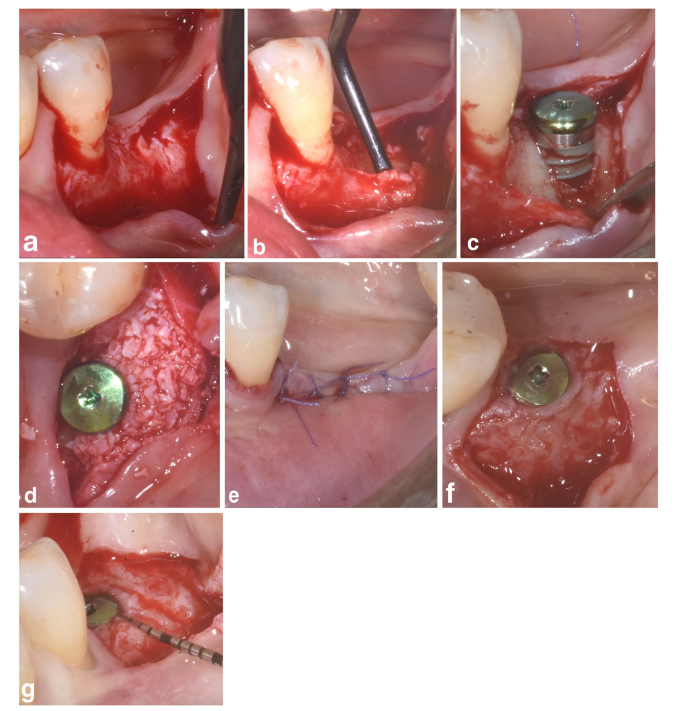
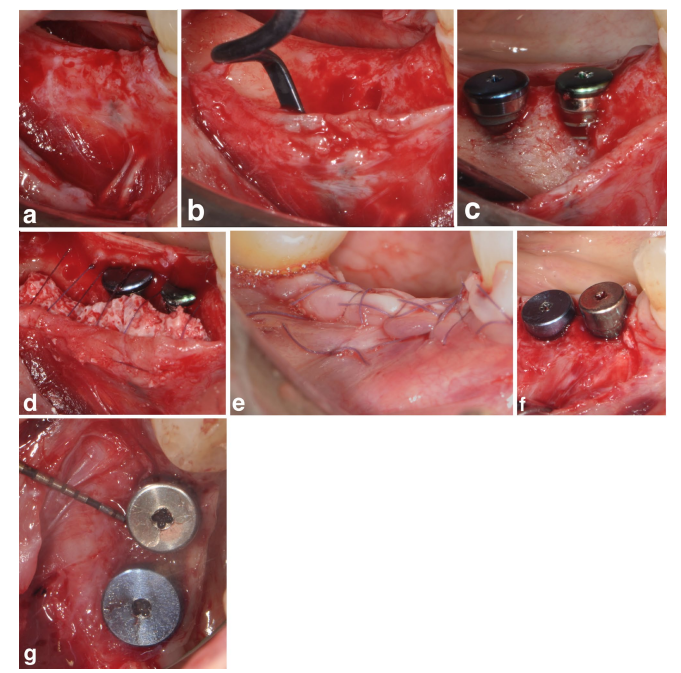
In entrambi i gruppi SPALparticolato e SPAL-blocco, l'accesso chirurgico alla cresta ossea è stato eseguito secondo una procedura precedentemente descritta (Trombelli et al. 2018). In breve, uno strato mucoso è stato sollevato sul lato buccale mediante dissezione a spessore parziale con una lama 15C (Figure 1a e 2a). Successivamente, lo strato periosteo è stato elevato dall'osso con un elevatore periosteo (PTROM, Hu-Friedy, Chicago, Illinois) e coltelli per tunneling (KPAX, TKN1X e TKN2X, Hu Friedy, Chicago, Illinois) con bordi affilati angolati variabili, creando una tasca sub-periostea che poteva ospitare un innesto (Figure 1b e 2b). Un lembo a pieno spessore è stato sollevato sul lato orale (linguale/palatale). Le fibre muscolari miloioidee sono state staccate dal lembo linguale utilizzando uno strumento smussato per consentire un avanzamento coronale. Sono state eseguite perforazioni corticali con una fresa in carburo cilindrica calibrata per aumentare l'apporto sanguigno all'area chirurgica (Majzoub et al. 1999; Acar et al. 2016).
Impianti a livello tissutale (SPI Element; Thommen Medical, Grenchen, Svizzera) sono stati posizionati con il margine coronale del collare lucido di 1 mm a livello della cresta ossea (Figure 1c e 2c).
Un xenoinnesto di origine bovina, fornito sia come particolato (granuli di Bio-Oss spongiosa, dimensione delle particelle 0,25–1,0 mm; Geistlich Pharma, AG, Wolhusen, Svizzera) (Trombelli et al. 2018) o blocco (blocco di Bio-Oss; Geistlich Pharma, AG, Wolhusen, Svizzera) (Trombelli et al. 2022), è stato utilizzato per riempire lo spazio creato chirurgicamente tra il strato periosteo e la superficie dell'impianto esposta. Il blocco è stato frammentato in pezzi più piccoli mediante una lama 15C o un trapano diamantato per adattarsi all'estensione dello spazio sub-periosteo e raggiungere il desiderato rimodellamento della piastra buccale. L'innesto è stato eseguito per correggere completamente il PIBD fino alla cresta ossea. In tutti i casi, l'innesto sub-periosteo ha fornito almeno 2 mm di spessore al collare lucido dell'impianto.
La porzione coronale dello strato periostale è stata quindi fissata al lembo orale mediante suture interne a materasso riassorbibili (Vicryl 6/0, Ethicon, Somerville NJ, USA) (Figure 1d e 2d). Successivamente, lo strato mucoso è stato avanzato coronale e suturato al lembo orale mediante suture interne a materasso orizzontali e suture interrotte per fornire una guarigione sommersa sia per il innesto che per l'impianto (Figure 1e–2e).
Al riesame chirurgico a 6 mesi per la scopertura dell'impianto, è stato dissezionato un lembo buccale a spessore parziale per posizionare l'abutment di guarigione. Per valutare la presenza/assenza di un PIBD residuo, è stata valutata la presenza di tessuto duro attorno alla superficie dell'impianto utilizzando una sonda UNC-15. Se non era presente alcuna penetrazione della sonda oltre il collare dell'impianto lucidato, l'impianto è stato classificato come “deiscenza completamente corretta”.
Per fornire dimensioni adeguate della mucosa peri-implantare cheratinizzata (KT), è stata eseguita o una posizione apicale del lembo (APF) o un innesto gengivale libero (FGG) (Trombelli et al. 2019) (Figure 1f,g e 2f). La scelta di eseguire un APF o un FGG è stata basata sulla necessità di garantire un'altezza di KT di almeno 2 mm sia negli aspetti buccali che linguali dell'impianto.
2.3.2.2 Gruppo di controllo.
È stata sollevata una flap a tutto spessore buccale e linguale/palatale per esporre la cresta ossea. Il sito dell'impianto è stato preparato secondo le istruzioni del produttore e sono stati inseriti impianti a livello tissutale (SPI Element; Thommen Medical, Grenchen, Svizzera) con il margine coronale del collare lucidato di 1 mm a livello della cresta ossea. Non è stata eseguita alcuna procedura di aumento osseo. In tutti i casi, la flap è stata suturata utilizzando suture interne a materasso e suture interrotte (Vicryl 5/0, Ethicon, Somerville NJ, USA) per garantire una guarigione sommersa.
Al riesame chirurgico a 3 mesi per la scopertura dell'impianto, è stata elevata una flap a tutto spessore buccale per avvitare l'abutment di guarigione. La flap è stata quindi rifilata e adattata all'abutment di guarigione per fornire dimensioni adeguate della mucosa cheratinizzata peri-impiantare.
2.3.2.3 Procedure postoperatorie.
È stato prescritto un farmaco anti-infiammatorio di emergenza (cioè, compresse di ibuprofene da 600 mg) immediatamente dopo l'intervento, quindi pro re nata per i giorni postoperatori successivi. Ai pazienti è stato consigliato di non indossare protesi rimovibili per evitare compressione sul sito chirurgico per almeno 4 settimane e di non masticare o spazzolare nell'area trattata per circa 2 settimane. È stato prescritto l'uso domiciliare di una soluzione di clorexidina allo 0,12% (Dentosan, Recor-dati, Milano, Italia) per il controllo chimico della placca (risciacquo di 1 minuto b.i.d. per 3 settimane). Le suture sono state rimosse 2 settimane dopo l'intervento.
2.4 Parametri dello Studio
2.4.1 Misurazioni Cliniche
Per valutare l'effetto del trattamento su PIBD, sono state recuperate le seguenti misurazioni cliniche dalle cartelle cliniche:
- Altezza della deiscenza ossea (BDH): misurata nell'aspetto medio-buccale dell'impianto come la distanza tra il margine apicale del collare lucidato dell'impianto e il primo contatto osseo con l'impianto;
- Larghezza della deiscenza ossea (BDW): misurata nell'aspetto buccale dell'impianto come la porzione più ampia della superficie ruvida dell'impianto esposta.
In tutti i gruppi, BDH e BDW erano stati valutati immediatamente dopo il posizionamento dell'impianto e al rientro per la scopertura dell'impianto.
Inoltre, lo spessore dei tessuti buccali (BTT) era stato misurato come la distanza tra il contorno buccale del collare lucidato e l'aspetto esterno dell'area innestata (gruppi SPAL) o della cresta ossea nativa (gruppo CONTROL) nell'aspetto medio-buccale dell'impianto. Il BTT di base era stato registrato:
- Immediatamente dopo il posizionamento dell'impianto per il gruppo CONTROL;
- Immediatamente dopo l'innesto per entrambi i gruppi SPAL; BTT è stato registrato nuovamente al rientro chirurgico per tutti i gruppi.
Tutte le misurazioni sono state effettuate utilizzando una sonda parodontale UNC-15 e arrotondate al millimetro più vicino.
2.4.2 Misurazioni Radiografiche
Le radiografie periapicali, eseguite con la tecnica parallela a cono lungo immediatamente dopo l'intervento chirurgico e al rientro per tutti i gruppi, sono state digitalizzate e analizzate utilizzando un software appositamente progettato (NIS elements v4.2; Nikon Instruments, Campi Bisenzio, Firenze, Italia). Il livello osseo marginale (MBL) è stato misurato come la distanza (approssimata al millimetro più vicino) tra il margine apicale più basso del collare dell'impianto lucidato e la cresta ossea nell'aspetto mesiale (mMBL) e distale (dMBL) di ciascun impianto utilizzando un ingrandimento di 10×–15×. L'MBL è stato registrato come negativo o positivo quando il margine apicale del collare lucidato si trovava rispettivamente apicalmente o coronariamente rispetto alla cresta ossea.
Un segno di riferimento alto 1 mm presente nella radiografia digitale è stato utilizzato per la calibrazione.
Due esaminatori (C.F. e M.S.) hanno effettuato le misurazioni radiografiche. Gli esaminatori sono stati coinvolti in una sessione di calibrazione su un campione di radiografie ottenute da pazienti non selezionati per il presente studio. La sessione di calibrazione consisteva in due sessioni di misurazioni MBL, effettuate a intervalli di 7 giorni, e ha permesso di raggiungere un'eccellente concordanza inter- e intra-esaminatore (k-score 0.87).
Analisi Statistica
Il tasso di pazienti con la superficie dell'impianto ruvida coperta fino alla parte apicale del collare lucidato (cioè, nessun PIBD) al rientro è stato considerato come l'esito primario. I valori e le variazioni in BDH, BDW, BTT e MBL erano variabili di esito secondario.
La dimensione del campione è stata calcolata utilizzando dati derivati da uno studio precedente (Benic et al. 2019) dove il tasso di pazienti con la superficie dell'impianto ruvida coperta fino alla spalla dell'impianto al rientro era del 91,7% nei gruppi di blocchi DBBM e del 25,0% nel gruppo particolato DBBM, rispettivamente. Il test Z ha stimato che erano necessari almeno 11 pazienti per ciascuno dei due gruppi SPAL indipendenti per raggiungere il 95% di potenza statistica con un errore alfa di 0.05.
Il paziente è stato considerato come l'unità statistica. I dati sono stati descritti utilizzando media, deviazione standard, mediana, intervallo interquartile (IR) e valori minimo-massimo per variabili quantitative, e proporzioni percentuali per variabili categoriali.
I confronti intra-gruppo per variabili continue/ordinali sono stati eseguiti utilizzando il test dei ranghi firmati di Wilcoxon per dati appaiati. I confronti inter-gruppo per variabili continue/ordinali sono stati eseguiti utilizzando l'ANOVA di Kruskal-Wallis. In caso di significatività al test di Kruskal-Wallis, sono stati calcolati confronti multipli (post hoc) dei ranghi medi; valori z normali sono stati calcolati per ciascun confronto, così come le probabilità post hoc (corrette per il numero di confronti) per un test di significatività a due lati. I confronti inter-gruppo per variabili binarie sono stati eseguiti utilizzando test del chi-quadro di massima verosimiglianza con correzione di Yate. Il cambiamento nelle variabili di esito secondario è stato valutato statisticamente utilizzando modelli lineari generalizzati (GLZ) aggiustati per i confondenti significativi, seguiti da ANOVA per misure ripetute per confronti inter-gruppo e con test HSD post hoc con N disuguali.
Risultati
4.1 Popolazione dello Studio
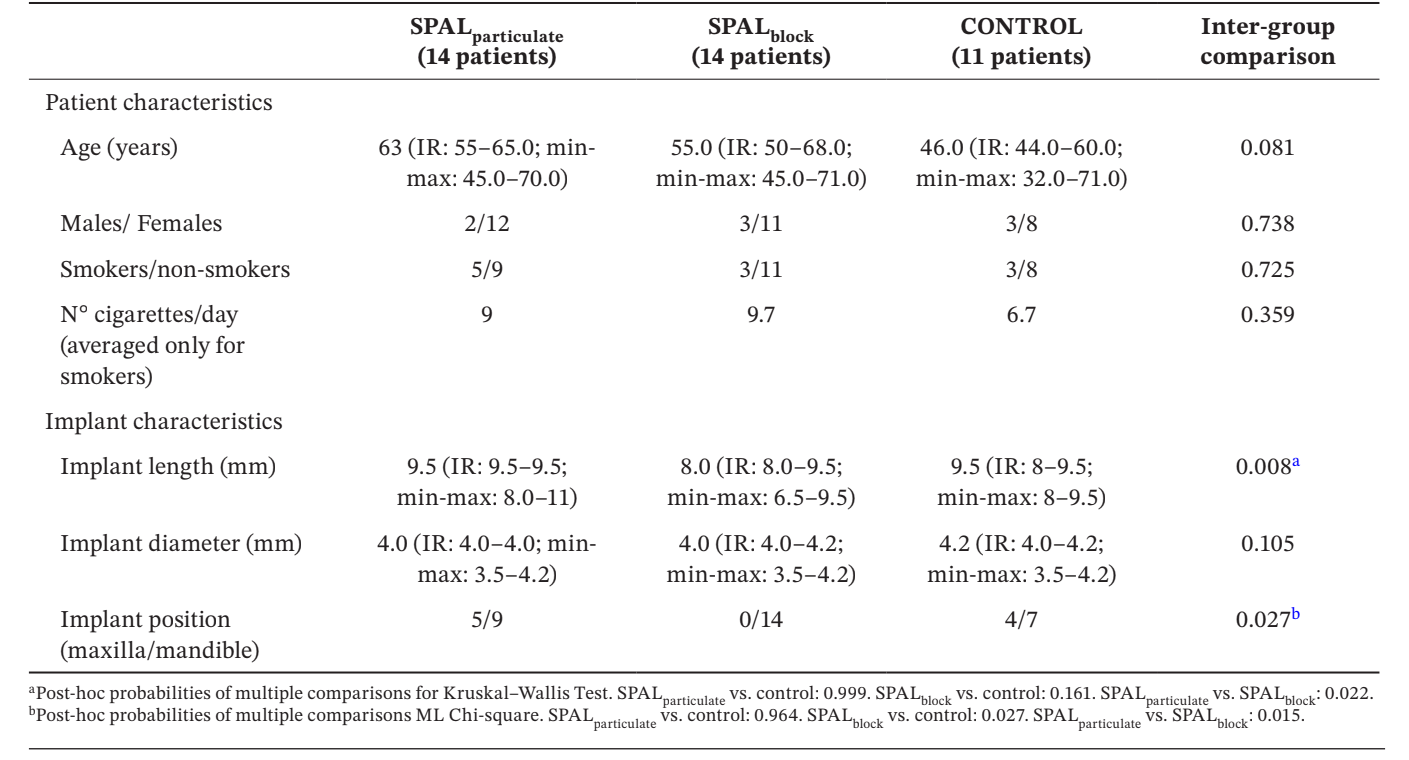
Trentanove impianti in 39 pazienti (14 nel gruppo SPALparticolato, 14 nel gruppo SPALblocco e 11 nel gruppo CONTROLLO) sono stati selezionati per l'analisi (Tabella 1). Non sono state osservate differenze in età, sesso e stato di fumatore tra i gruppi, la stragrande maggioranza dei pazienti essendo non fumatori. Nei gruppi SPALparticolato e CONTROLLO un terzo degli impianti era situato nell'arcata superiore, mentre tutti gli impianti erano situati nell'arcata inferiore nel gruppo SPALblocco. Questa differenza era statisticamente significativa (p = 0.027). Gli impianti posizionati nel gruppo SPALblocco erano significativamente più corti rispetto a quelli posizionati nei gruppi SPALparticolato e CONTROLLO (p = 0.008).
4.1.1 Guarigione Post-Operatoria
In entrambi i gruppi SPALparticolato e CONTROL, la guarigione precoce è stata senza eventi avversi in tutti i pazienti.
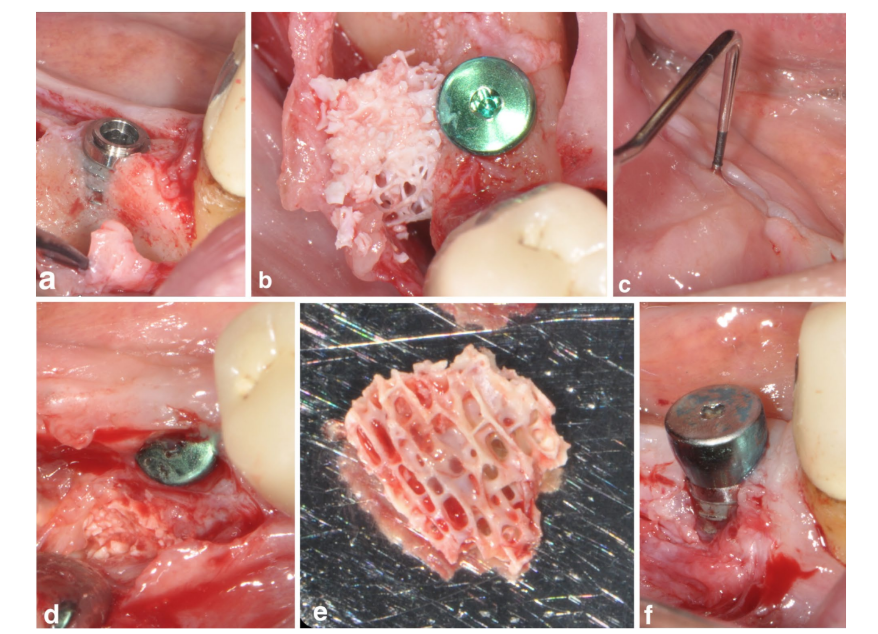
Un paziente nel gruppo SPALblocco ha sperimentato un'infezione post-operatoria a 4 settimane dopo l'intervento chirurgico. Il paziente ha riferito gonfiore e dolore nell'area trattata chirurgicamente, e una fistola che drenava un essudato purulento era evidente (Figura 3a–f). Dopo l'elevazione del lembo a spessore parziale, il innesto di blocco DBBM è stato trovato incorporato nel tessuto di granulazione e quindi rimosso.
4.2 Risultati dello Studio
4.2.1 Risultato Primario
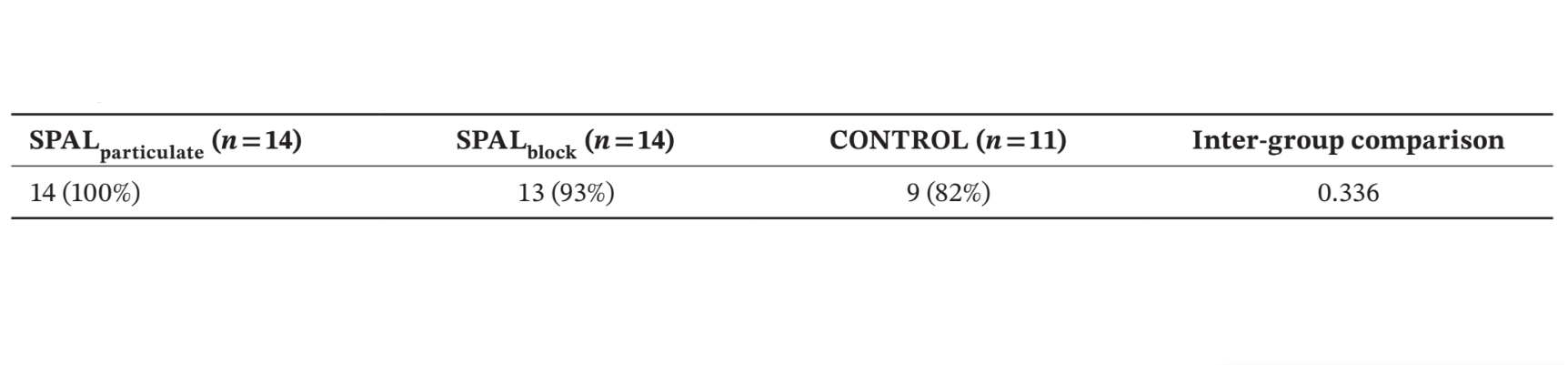
Numero e % di pazienti che presentano la superficie dell'impianto ruvida coperta fino alla parte apicale del collare lucido al riesame (cioè, nessun PIBD) sono mostrati nella Tabella 2. Nessun difetto residuo è stato trovato nel gruppo SPALparticulate mentre nel gruppo SPALblock il paziente che aveva sperimentato l'infezione del innesto post-operatorio presentava un PIBD residuo. Due pazienti nel gruppo CONTROL hanno presentato un incidente PIBD al riesame (Tabella 2). Le differenze tra i gruppi non erano statisticamente significative.
4.2.2 Risultati Secondari
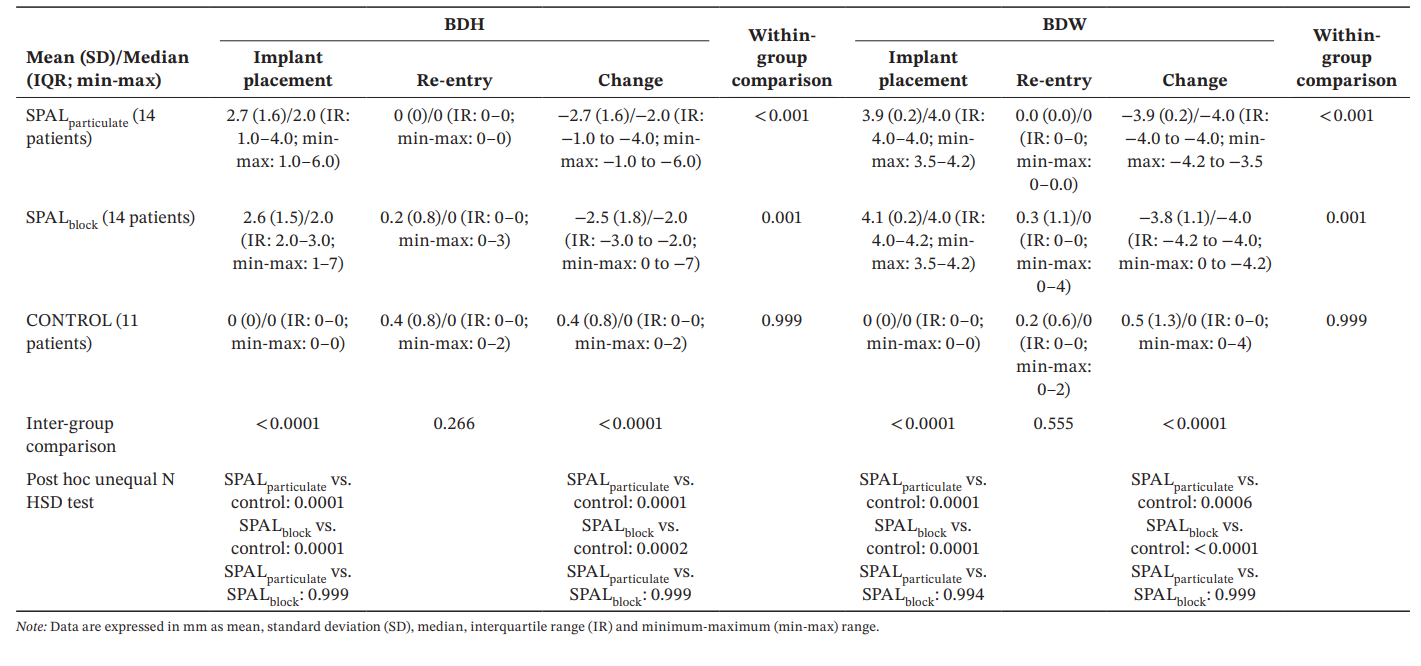
Il modello GLZ aggiustato per i fattori di confondimento identificati (lunghezza e posizione dell'impianto) ha mostrato che sia il trattamento che il tempo erano predittori significativi sia per BDH che per BDW (tempo, p < 0.0001 per entrambi; trattamento, p < 0.001 per entrambi). I confronti intra- e inter-gruppo per BDH e BDW sono riportati nella Tabella 3. Il test di Wilcoxon per dati appaiati ha mostrato una riduzione significativa nel tempo sia per i gruppi SPALparticulate (p < 0.001 per entrambi BDH e BDW) che per i gruppi SPALblock (p = 0.001 per entrambi BDH e BDW). Al momento dell'inserimento dell'impianto, i gruppi SPAL erano entrambi significativamente diversi dal gruppo CONTROL (p = 0.0001 per entrambi BDH e BDW). Tuttavia, non sono state rilevate differenze significative tra i gruppi al riesame per BDH e BDW. Nel gruppo SPALblock il paziente con il PIBD residuo ha mostrato un BDH di 3 mm e un BDW di 4 mm. Nel gruppo CONTROL i due pazienti con un incidente PIBD al riesame hanno mostrato un BDH di 2 mm e un BDW di 2 mm e un BDH di 2 mm e un BDW di 4 mm, rispettivamente.
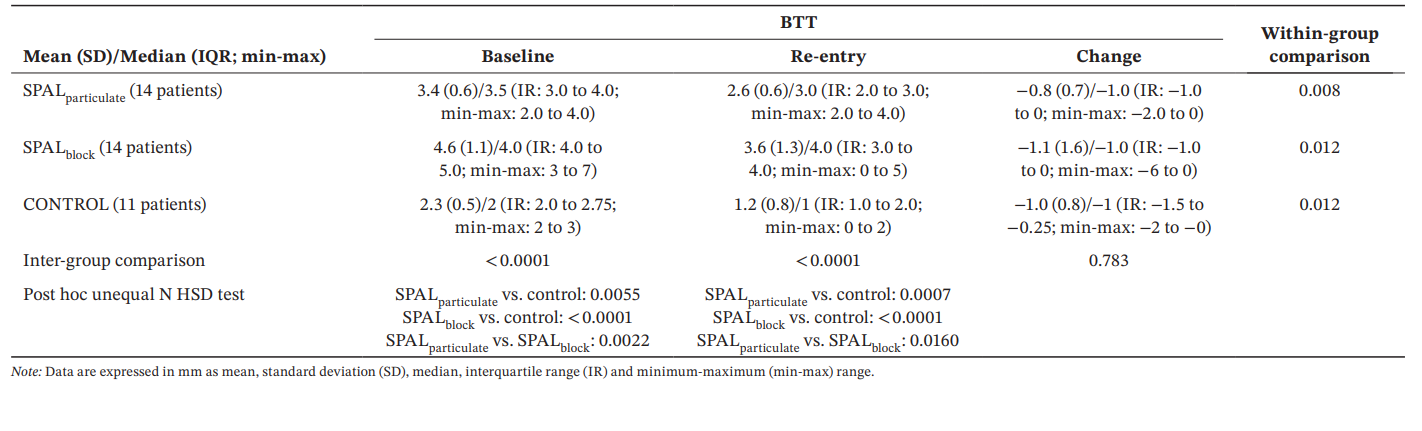
Per BTT, il modello GLZ aggiustato per i fattori confondenti identificati ha mostrato che sia il trattamento che il tempo erano predittori significativi (p < 0.0001 per entrambi i fattori). I confronti intra- e inter-gruppo per BDH e BDW sono riportati nella Tabella 4. È stata osservata una differenza significativa tra i gruppi sia al basale che al reinserimento (p < 0.0001). In particolare, il gruppo SPALblock ha mostrato valori significativamente maggiori rispetto a SPALparticulate sia al basale (p = 0.0022) che al reinserimento (p = 0.0160). I confronti intra-gruppo hanno mostrato una significativa riduzione di BTT nel tempo per tutti i gruppi, la magnitudine di questa riduzione essendo simile tra i gruppi.
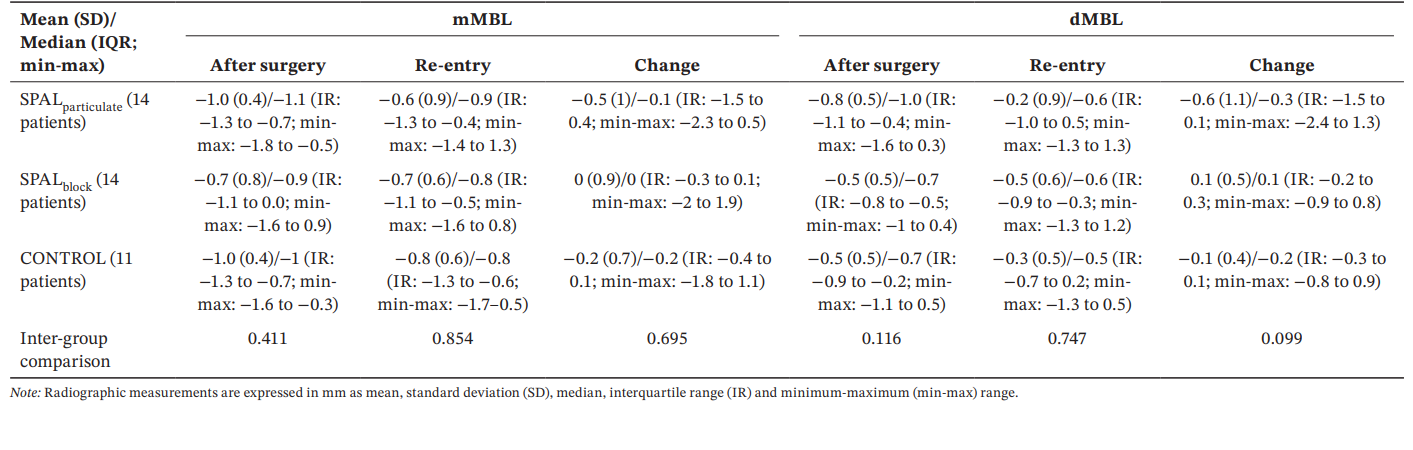
Tutti i gruppi hanno mostrato valori simili di mMBL e dMBL dopo l'intervento chirurgico e al rientro, così come cambiamenti nel tempo (Tabella 5).
Discussione
Lo scopo del presente studio retrospettivo era valutare l'efficacia della tecnica SPAL eseguita in combinazione con DBBM sotto forma di particelle o blocchi per correggere completamente un PIBD al momento dell'inserimento dell'impianto. I gruppi SPAL sono stati anche confrontati con un gruppo di pazienti che mostrava una piastra ossea buccale peri-implantare di almeno 2 mm dopo l'inserimento dell'impianto. I risultati hanno mostrato che, indipendentemente dalla forma di DBBM, gli impianti trattati con la tecnica SPAL hanno mostrato un tasso altrettanto elevato di pazienti che presentavano una correzione completa del difetto a 6 mesi dal re-inserimento. Il gruppo SPALblock ha mostrato un BTT significativamente maggiore sia al basale che al re-inserimento. Tuttavia, l'estensione del rimodellamento del innesto/osso era simile tra i gruppi.
La scelta di utilizzare il tasso di correzione completa della deiscenza come esito primario è stata dovuta al fatto che un PIBD non trattato o parzialmente corretto può (i) favorire l'insorgenza di una complicazione biologica (Monje et al. 2019; Schwarz, Sahm e Becker 2012) e (ii) portare a una maggiore perdita ossea peri-implantare interprossimale (Jung et al. 2017). Il gruppo CONTROL è stato incluso per valutare l'estensione del rimodellamento dei due biomateriali per innesto rispetto all'osso nativo.
L'efficacia della SPAL eseguita in combinazione con un pDBBM per il trattamento di un PIBD è stata coerente con quella riportata in precedenti studi clinici in cui è stato utilizzato lo stesso particolato di innesto, mostrando un tasso di copertura completa della deiscenza che varia dall'80% al 91% (Trombelli et al. 2019, 2020). Questi risultati potrebbero essere in parte attribuiti a aspetti biologici e tecnici specifici della procedura rigenerativa. Nella tecnica SPAL, lo strato periosteo rappresenta una fonte di cellule osteogeniche che possono (i) contribuire favorevolmente alla formazione di nuovo osso (Ceccarelli, et al., 2016) e (ii) agire come induttore neo-angiogenico fornendo così la precoce vascolarizzazione dell'innesto DBBM (Nobuto et al. 2005). Inoltre, la creazione di uno spazio sub-periosteo isolato può consentire un'adeguata sistemazione e stabilizzazione dell'innesto nella porzione più coronale dell'impianto (Trombelli et al. 2018, 2019, 2020). La stabilità dell'innesto per supportare l'attività osteoconduttiva dell'innesto è anche migliorata mediante suture interne a materasso che fissano la porzione coronale dello strato periosteo al lembo orale. Coerentemente, un'analisi di rete meta che confronta diverse opzioni di trattamento per correggere completamente un PIBD ha mostrato che la SPAL con un pDBBM ha la massima probabilità di successo tra le procedure incluse (Severi et al. 2022).
Recentemente, l'uso di un bDBBM in combinazione con SPAL è stato proposto come un'alternativa promettente a un innesto particolato (Trombelli et al. 2022). Si è suggerito che il bDBBM agisca come un'impalcatura osteoconduttiva efficace grazie alle sue proprietà meccaniche che comprendono una limitata dislocazione durante la manipolazione del lembo, così come una maggiore stabilità dimensionale (Benic et al. 2016; Benic et al. 2017; Mir-Mari et al. 2016). L'efficacia del bDBBM è supportata dai nostri risultati che hanno mostrato un tasso del 93% di correzione completa del PIBD. Inoltre, l'uso di bDBBM ha portato a un BTT maggiore rispetto al pDBBM sia alla linea di base che al rientro. Questi risultati sono coerenti con quelli provenienti da uno studio in cui la combinazione di un bDBBM e una membrana di collagene, simultaneamente all'inserimento dell'impianto, si è dimostrata superiore alla combinazione della stessa membrana e di un pDBBM nella risoluzione completa del difetto e nel ripristino di una placca buccale spessa (Benic et al. 2019). Tuttavia, va sottolineato che un paziente che ha ricevuto l'innesto a blocco ha sperimentato un'infezione dell'innesto post-chirurgica che ha portato a una deiscenza persistente a 6 mesi. Studi precedenti in cui è stato utilizzato un blocco osseo xenogenico per una procedura di aumento dell'osso del rialzo eseguita prima dell'inserimento dell'impianto hanno riportato un tasso di infezione dell'innesto e successiva rimozione dal 33% (Ortiz-Vigón et al. 2017) al 40% (Schwarz et al. 2021) dei casi trattati. Studi preclinici (Benic et al. 2016; Benic et al. 2017) e clinici (Laas, et al., 2020) hanno mostrato che il bDBBM era scarsamente colonizzato da nuovo osso rispetto al pDBBM. La limitata formazione ossea osservata era correlata a una vascolarizzazione compromessa del blocco a causa della sua macrostruttura (Laass et al. 2020). Se e in che misura l'uso di un bDBBM possa rappresentare un'alternativa sicura ed efficace al pDBBM quando combinato con la tecnica SPAL deve essere ulteriormente valutato.
Il nostro disegno dello studio può fornire un'anteprima preliminare sull'estensione del rimodellamento del innesto dopo le procedure SPAL con diverse forme di innesto rispetto al rimodellamento osseo dopo l'inserimento dell'impianto. Nonostante il gruppo SPALblock mostrasse un BTT significativamente maggiore sia dopo l'intervento chirurgico che al rientro, l'entità del rimodellamento dell'innesto era simile per i due innesti e rispetto all'osso nativo. Le variazioni del BTT nel gruppo SPALblock erano coerenti con studi precedenti che valutavano il rimodellamento dell'innesto dopo la procedura GBR eseguita utilizzando un bDBBM in combinazione con una membrana di collagene (Benic et al. 2019). Al contrario, lo stesso studio ha mostrato che la riduzione media dello spessore per un pDBBM più membrana di collagene era doppia rispetto ai nostri dati (2 mm). Le differenze nelle variazioni del BTT osservate nei due studi possono essere spiegate da dinamiche di rimodellamento dell'innesto variabili così come dall'estensione dello spostamento dell'innesto conseguente alla specifica procedura rigenerativa. Complessivamente, queste osservazioni suggeriscono la necessità di sovracorreggere la dimensione del BTT per compensare il restringimento orizzontale post-chirurgico dell'innesto indipendentemente dalle procedure di aumento osseo utilizzate.
Nel nostro materiale, il gruppo CONTROL era composto da pazienti in cui era presente uno spessore di PBBP di almeno 2 mm dopo l'inserimento dell'impianto. Questa scelta si basava su studi precedenti che dimostravano che lo spessore di PBBP è correlato all'incidenza di perdita ossea verticale nella piastra buccale dopo l'inserimento dell'impianto (Spray et al. 2000) e alla conseguente necessità di procedure di aumento osseo (Roccuzzo, Imber e Jensen 2021). È interessante notare che è stata osservata anche una riduzione media di BTT di 1 mm nel gruppo CONTROL, che ha portato due pazienti (18%) a sperimentare un incidente PIBD al riesame. Il rimodellamento osseo ha superato quello riportato in studi precedenti, dove la riduzione dello spessore di PBBP dopo l'inserimento dell'impianto variava da 0,3 (Merheb et al. 2017) a 0,4 mm (Cardaropoli, Lekholm e Wennström 2006). Diversi fattori, inclusa la posizione 3D dell'impianto (Nomiyama et al. 2022), i metodi per la preparazione del sito implantare (Baggi et al. 2008; Peker Tekdal et al. 2016), il design/superficie dell'impianto (Linkevicius et al. 2020; Galindo-Moreno et al. 2016; Camarda et al. 2021), la posizione anatomica (anteriore/posteriore, mandibola/mascella) (Ghaly et al. 2023), lo spessore della mucosa peri-implantare (Maia et al. 2015; Suárez-López Del Amo et al. 2016), e la connessione protesica (Linkevicius et al. 2015) potrebbero aver parzialmente spiegato questa osservazione discrepante.
Al fine di facilitare la chiusura per prima intenzione, sono stati posizionati impianti a livello tissutale con il margine coronale del collare lucidato a livello della cresta ossea. In questo senso, non si può escludere un impatto del posizionamento dell'impianto sulla quantità di correzione del PIBD così come sull'estensione del rimodellamento osseo peri-implantare dopo l'inserimento dell'impianto (Saleh et al. 2018). Inoltre, i gruppi SPAL e il gruppo CONTROL sono stati riaperti per la scopertura dell'impianto in diversi periodi post-chirurgici (6 mesi contro 3 mesi). Questa differenza potrebbe aver avuto vari effetti sul rimodellamento tissutale dopo l'inserimento dell'impianto.
La perdita ossea marginale peri-implantare dopo l'installazione dell'impianto può derivare da un rimodellamento fisiologico a causa di traumi meccanici e termici durante la preparazione del sito per l'impianto. È interessante notare che nel nostro materiale è stata osservata una quantità limitata di rimodellamento del innesto/osso tra i gruppi, coerente con studi precedenti in cui gli impianti a livello tissutale erano stati posizionati equicrestalmente (Saleh et al. 2018) o trattati con SPAL più pDBBM (Trombelli et al. 2020).
Alcune limitazioni dello studio attuale devono essere considerate quando si interpretano i suoi risultati. La scelta di uno studio pilota con un design retrospettivo è stata basata sulla mancanza di indicazioni cliniche specifiche (cioè, fattori relativi al paziente/defetto) per combinare la tecnica SPAL con DBBM particolato o blocco DBBM a causa delle prove limitate e aneddotiche (Trombelli et al. 2022) a supporto dell'uso del blocco DBBM in combinazione con la tecnica SPAL. È stata utilizzata una formulazione specifica di DBBM secondo la preferenza dell'operatore. Questa selezione imparziale del innesto utilizzato non ha comportato differenze significative in termini di caratteristiche del paziente e del difetto. Tuttavia, alcuni fattori, come la posizione anatomica e la lunghezza degli impianti, erano distribuiti in modo disomogeneo tra i gruppi e, sebbene controllati dall'analisi statistica, potrebbero aver influenzato i risultati osservati. Poiché i pazienti inclusi sono stati trattati consecutivamente durante l'attività clinica di routine, una sonda UNC 15 è stata lo strumento regolare/standardizzato utilizzato per effettuare tutte le misurazioni cliniche, comprese le dimensioni PIBD. Altri metodi di misurazione, come un calibro (Roccuzzo, Imber e Jensen 2021) o un dispositivo appositamente progettato (Merheb et al. 2017), avrebbero potuto portare a registrazioni più appropriate della dimensione della deiscenza e BBT.
In conclusione, i nostri risultati sembrano indicare che SPAL eseguito in combinazione con un innesto DBBM particolato o a blocco è altrettanto efficace nella correzione di un PIBD così come nell'aumento del BTT a 6 mesi.
Mattia Severi, Franzini Chiara, Anna Simonelli, Chiara Scapoli, Leonardo Trombelli
Riferimenti
- Baggi, L., I. Cappelloni, M. Di Girolamo, F. Maceri, e G. Vairo. 2008. “L'influenza del diametro e della lunghezza dell'impianto sulla distribuzione dello stress degli impianti osseointegrati in relazione alla geometria dell'osso crestal: un'analisi agli elementi finiti tridimensionale.” Journal of Prosthetic Dentistry 100, n. 6: 422–431. https://doi.org/10.1016/S0022-3913(08)60259-0.
- Benic, G. I., B. M. Eisner, R. E. Jung, T. Basler, D. Schneider, e C. H. F. Hämmerle. 2019. “Cambiamenti nei tessuti duri dopo rigenerazione ossea guidata di difetti peri-impiantari confrontando innesti ossei a blocco rispetto a particolati: risultati a 6 mesi di uno studio clinico controllato randomizzato.” Clinical Oral Implants Research 30: 1016–1026. https://doi.org/10.1111/clr.13515.
- Benic, G. I., D. S. Thoma, F. Muñoz, I. S. Martin, R. E. Jung, e C. H. F. Hämmerle. 2016. “Rigenerazione ossea guidata di difetti peri-impiantari con sostituti ossei xenogenici particolati e a blocco.” Clinical Oral Implants Research 27, n. 5: 567–576. https://doi.org/10.1111/clr.12625.
- Benic, G. I., D. S. Thoma, I. Sanz-Martin, et al. 2017. “Rigenerazione ossea guidata in impianti dentali in zirconia e titanio: un'indagine istologica pilota.” Clinical Oral Implants Research 28, n. 12: 1592–1599. https://doi.org/10.1111/clr.13030.
- Bressan, E., N. Ferrarese, M. Pramstraller, D. Lops, R. Farina, e C. Tomasi. 2017. “Dimensioni del rialzo dell'osso mascellare nella mandibola edentula nel sestante posteriore: uno studio osservazionale su radiografie di tomografia computerizzata a fascio conico.” Implant Dentistry 26, n. 1: 66–72. https:// doi.org/10.1097/ID.0000000000000489.
- Camarda, A. J., R. Durand, M. Benkarim, P. H. Rompré, G. Guertin, e H. Ciaburro. 2021. “Studio clinico randomizzato prospettico che valuta gli effetti di due diversi design di collare per impianti sulla guarigione peri-impiantare e sull'osseointegrazione funzionale dopo 25 anni.” Clinical Oral Implants Research 32: 285–296. https://doi.org/10.1111/clr.13699.
- Cardaropoli, G., U. Lekholm, e J. L. Wennström. 2006. “Alterazioni tissutali in sostituzioni di denti singoli supportati da impianti: uno studio clinico prospettico di 1 anno.” Clinical Oral Implants Research 17, n. 2: 165–171. https://doi.org/10.1111/j.1600-0501.2005.01210.x.
- Farina, R., A. Simonelli, A. Baraldi, et al. 2021. “Perdita di denti in pazienti con parodontite conformi e non conformi con diversi livelli di rischio parodontale durante la cura parodontale di supporto.” Clinical Oral Investigations 25, n. 10: 5897–5906. https://doi.org/10.1007/s00784-021-03895-8.
- Galindo-Moreno, P., A. León-Cano, A. Monje, I. Ortega-Oller, F. O'Valle, e A. Catena. 2016. “L'altezza dell'abutment influenza l'effetto del platform switching sulla perdita ossea marginale peri-impiantare.” Clinical Oral Implants Research 27, n. 2: 167–173. https://doi.org/10.1111/clr.12554.
- Gallucci, G. O., A. Hamilton, W. Zhou, D. Buser, e S. Chen. 2018. “Posizionamento e protocolli di carico degli impianti in pazienti parzialmente edentuli: una revisione sistematica.” Clinical Oral Implants Research 29, n. Suppl 16: 106–134. https://doi.org/10.1111/clr.13276.
- Ghaly, M., D. Tarrazzi, V. Xia, S. Tharrington, e T. R. Schoenbaum. 2023. “Cambiamenti nel livello osseo marginale peri-impiantare in base alla posizione della mascella: una revisione sistematica e meta-analisi di 4970 impianti.” Journal of Oral Implantology 49, n. 4: 444–455. https://doi.org/10.1563/aaid-joi-D-22-00252.
- Herrera, D., T. Berglundh, F. Schwarz, et al. 2023. “Prevenzione e trattamento delle malattie peri-impiantari—Le linee guida cliniche di livello EFP S3.” Journal of Clinical Periodontology 50, n. Suppl 26: 4–76. https://doi.org/10.1111/jcpe.13823.
- Jensen, S. S., T. Aghaloo, R. E. Jung, et al. 2023. “Rapporto di consenso del Gruppo 1 ITI: Il ruolo delle dimensioni ossee e delle procedure di aumento dei tessuti molli sulla stabilità degli esiti clinici, radiografici e riportati dai pazienti del trattamento implantare.” Clinical Oral Implants Research 34, n. Suppl 26: 43–49. https://doi.org/10.1111/clr.14154.
- Jung, R. E., M. Herzog, K. Wolleb, C. F. Ramel, D. S. Thoma, e C. H. F. Hämmerle. 2017. “Uno studio clinico controllato randomizzato che confronta piccoli difetti di deiscenza buccale attorno agli impianti dentali trattati con rigenerazione ossea guidata o lasciati per guarigione spontanea.” Clinical Oral Implants Research 28, n. 3: 348–354. https://doi.org/10.1111/clr.12806.
- Laass, A., B. M. Eisner, C. H. F. Hämmerle, R. E. Jung, D. S. Thoma, e G. I. Benic. 2020. “Risultati istologici dopo rigenerazione ossea guidata di difetti peri-impiantari confrontando sostituti ossei a blocco di forma individuale rispetto a particolati.” International Journal of Periodontics and Restorative Dentistry 40, n. 4: 519–527. https://doi.org/10.11607/prd.4575.
- Linkevicius, T., A. Puisys, L. Linkeviciene, V. Peciuliene, e M. Schlee. 2015. “Stabilità dell'osso crestal attorno agli impianti con connessione orizzontale dopo ispessimento dei tessuti molli: uno studio clinico prospettico.” Clinical Implant Dentistry and Related Research 17, n. 3: 497–508. https://doi.org/10.1111/cid.12155.
- Linkevicius, T., A. Puisys, R. Linkevicius, J. Alkimavicius, E. Gineviciute, e L. Linkeviciene. 2020. “L'influenza dell'abutment di guarigione sommerso o del posizionamento subcrestale dell'impianto sullo spessore dei tessuti molli e sulla stabilità dell'osso crestal. Uno studio clinico randomizzato di 2 anni.” Clinical Implant Dentistry and Related Research 22, n. 4: 497–506. https://doi.org/10.1111/cid.12903.
- Maia, L. P., D. M. Reino, V. A. Muglia, et al. 2015. “Influenza dello spessore del tessuto parodontale sulla rimodellazione della piastra buccale su impianti immediati con xenograft.” Journal of Clinical Periodontology 42: 590–598. https:// doi.org/10.1111/jcpe.12405.
- Merheb, J., M. Vercruyssen, W. Coucke, L. Beckers, W. Teughels, e M. Quirynen. 2017. “Il destino dell'osso buccale attorno agli impianti dentali. Uno studio di follow-up a 12 mesi dopo il carico.” Clinical Oral Implants Research 28, n. 1: 103–108. https://doi.org/10.1111/clr.12767.
- Mir-Mari, J., H. Wui, R. E. Jung, C. H. F. Hämmerle, e G. I. Benic. 2016. “Influenza della chiusura della ferita cieca sulla stabilità del volume di diversi materiali GBR: un esame tomografico a fascio conico in vitro.” Clinical Oral Implants Research 27, n. 2: 258–265. https://doi.org/10.1111/clr.12590.
- Monje, A., V. Chappuis, F. Monje, et al. 2019. “Lo spessore critico della parete ossea buccale peri-impiantare rivisitato: uno studio sperimentale nel cane Beagle.” International Journal of Oral & Maxillofacial Implants 34, n. 6: 1328–1336. https://doi.org/10.11607/jomi.7657.
- Monje, A., A. Roccuzzo, D. Buser, e H. L. Wang. 2023. “Influenza dello spessore della parete ossea buccale sui cambiamenti dimensionali dei tessuti duri e molli peri-impiantari: una revisione sistematica.” Clinical Oral Implants Research 34, n. 3: 157–176. https://doi.org/10.1111/clr.14029.
- Nobuto, T., F. Suwa, T. Kono, et al. 2005. “Risposta microvascolare nel periostio dopo chirurgia con lembi mucoperiostei nei cani: angiogenesi e riassorbimento e formazione ossea.” Journal of Periodontology 76, n. 8: 1346–1353. https://doi.org/10.1902/jop.2005.76.8.1346.
- Nomiyama, L. M., E. K. Matumoto, M. G. Corrêa, et al. 2022. “Confronto tra chirurgia guidata senza lembi e chirurgia convenzionale per il posizionamento degli impianti: uno studio clinico randomizzato di 12 mesi.” Clinical Oral Investigations 27: 1665–1679. https://doi.org/10.1007/s00784-022-04793-3.
- Ortiz-Vigón, A., I. Suarez, S. Martínez-Villa, I. Sanz-Martín, J. Bollain, e M. Sanz. 2017. “Sicurezza e prestazioni di un nuovo blocco osseo xenogenico collagene per l'aumento della cresta alveolare laterale per il posizionamento di impianti in fasi.” Clinical Oral Implants Research 29, n. 1: 36–45. https://doi.org/10.1111/clr.13036.
- Peker Tekdal, G., N. Bostanci, G. N. Belibasakis, e A. Gürkan. 2016. “L'effetto dell'osteotomia implantare chirurgica piezoelettrica sui parametri radiologici e molecolari della perdita ossea crestal peri-impiantare: uno studio randomizzato, controllato, split-mouth.” Clinical Oral Implants Research 27, n. 5: 535–544. https://doi.org/10.1111/clr.12620.
- Pramstraller, M., G. P. Schincaglia, R. Vecchiatini, R. Farina, e L. Trombelli. 2018. “Dimensioni del rialzo alveolare nelle regioni posteriori mandibolari: uno studio comparativo retrospettivo di siti dentati ed edentuli utilizzando dati di tomografia computerizzata.” Surgical and Radiologic Anatomy 40, n. 12: 1419–1428. https://doi.org/10.1007/s00276-018-2095-0.
- Roccuzzo, A., J. C. Imber, e S. S. Jensen. 2021. “Necessità di aumento osseo laterale in due impianti a diametro ridotto: uno studio clinico prospettico controllato.” Clinical Oral Implants Research 32, n. 4: 511–520. https://doi.org/10.1111/clr.13721.
- Saleh, M. H. A., A. Ravidà, F. Suárez-López Del Amo, G. H. Lin, F. Asa'ad, e H. L. Wang. 2018. “L'effetto della posizione della giunzione impianto-abutment sulla perdita ossea crestal: una revisione sistematica e meta-analisi.” Clinical Implant Dentistry and Related Research 20, n. 4: 617–633. https://doi.org/10.1111/cid.12600.
- Schwarz, F., D. Sahin, S. Civale-Schweighöfer, e J. Becker. 2021. “Risultati a lungo termine dopo l'aumento laterale della cresta alveolare utilizzando un blocco osseo xenogenico collagene: uno studio clinico monocentrico prospettico a braccio singolo.” International Journal of Implant Dentistry 7, n. 1: 9. https://doi.org/10.1186/s40729-021-00293-3.
- Schwarz, F., N. Sahm, e J. Becker. 2012. “Impatto dell'esito della rigenerazione ossea guidata in difetti di tipo deiscenza sulla stabilità a lungo termine della salute peri-impiantare: osservazioni cliniche a 4 anni.” Clinical Oral Implants Research 23, n. 2: 191–196. https://doi.org/10.1111/j.1600-0501.2011.02214.x.