Una revisione sistematica sulla definizione della peri-implantite: Limiti legati alle varie diagnosi proposte
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Astratto
Obiettivo: Lo scopo di questa revisione sistematica completa era presentare le diverse definizioni di periimplantite proposte nella letteratura.
Materiali e metodi: Sono state condotte ricerche elettroniche e manuali nella letteratura da tre revisori indipendenti per identificare manoscritti che riportano dati sulla definizione di periimplantite con diagnosi clinica, scritti in inglese e pubblicati fino a ottobre 2015. Sono state consultate diverse banche dati, tra cui PubMed, Embase, la Cochrane Library e il Grey Literature Database.
Risultati: Quarantanove articoli sono stati considerati idonei per la revisione. Le evidenze attuali suggeriscono l'uso di definizioni di caso inequivocabili per la periimplantite, definite da cambiamenti nel livello dell'osso crestal, presenza di sanguinamento alla sondatura e/o suppurazione, con o senza un concomitante approfondimento delle tasche periimplantari. Tuttavia, sono stati utilizzati diversi punti di riferimento per misurare questi cambiamenti, inclusi diversi livelli di gravità e anni di follow-up.
Conclusione: La letteratura scientifica disponibile ha suggerito l'assenza di una definizione unanime di periimplantite. Dovrebbero essere considerati futuri studi che applicano definizioni di caso coerenti.
Introduzione
Il termine “periimplantite” è stato introdotto all'inizio degli anni '60 per descrivere condizioni patologiche infettive del tessuto periimplantare. Oggi, la periimplantite è la complicazione più frequente degli impianti dentali e si verifica con una frequenza che varia dall'1% al 47% a livello dell'impianto. Diversa dalla mucosite periimplantare (definita come la presenza di infiltrato infiammatorio dei tessuti molli reversibile, senza ulteriore perdita ossea oltre il normale rimodellamento osseo fisiologico iniziale), la periimplantite è stata descritta come caratterizzata da un processo infiammatorio attorno a un impianto, che include sia l'infiammazione dei tessuti molli sia la perdita progressiva di osso di supporto oltre il normale rimodellamento osseo crestal fisiologico. Tuttavia, come evidenziato in recenti revisioni della letteratura e conferenze di consenso, sono state riportate diverse definizioni di periimplantite. Ciò può essere dovuto in parte alla mancanza di consenso su terminologia, eziologia, diagnosi e sistemi di prognosi.
La periimplantite è stata descritta come una malattia con un componente infettivo simile alla parodontite cronica. L'8° Workshop Europeo sulla Parodontologia ha concordato che le definizioni pubblicate nel 200810 e nel 20118 dovrebbero essere adottate. La definizione suggerita dovrebbe includere quanto segue: cambiamenti nel livello dell'osso crestal, sanguinamento positivo alla sondaggio (BOP) e/o suppurazione (SUP), con o senza tasche periimplantari concomitanti (profondità della tasca di sondaggio, PPD). Oggi, sebbene l'accumulo di placca sia ancora considerato il principale fattore eziologico, è stato dimostrato che ci sono altri potenziali fattori di rischio correlati alla malattia, inclusi fattori del paziente, chirurgici e protesici che possono certamente contribuire al suo sviluppo.
Nel database MeSH (Medical Subject Headings), il termine “periimplantite” è stato introdotto nel 2011 e definito come un processo infiammatorio con perdita di osso di supporto nei tessuti circostanti impianti dentali funzionanti. Nonostante questa definizione di malattia molto chiara e completa, emergono incoerenze e confusione nell'applicazione della terminologia clinicamente. Tutti questi fattori insieme hanno portato a diverse interpretazioni e definizioni di questa comune malattia emergente. Inoltre, recentemente, l'ipotesi della reazione da corpo estraneo non infettivo ha ulteriormente complicato la comprensione di questa questione. L'obiettivo della presente revisione sistematica era presentare le diverse definizioni di periimplantite proposte nella letteratura.
Materiali e metodi
Il presente documento è stato preparato in parziale adempimento di una dichiarazione di consenso tenutasi a Roma, Italia, nel gennaio 2016. Questa revisione sistematica è stata scritta secondo le linee guida PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) (http://www.prisma-statement.org/PRISMAStatement/PRISMA-Statement.aspx).
La domanda focalizzata era: Esiste una definizione unanime di periimplantite, inclusa la diagnosi clinica. La domanda di ricerca è stata adattata al formato PICO:
P = popolazione: pazienti umani derivati da studi clinici, revisioni sistematiche, revisioni narrative, dichiarazioni di consenso, commenti o editoriali, che presentavano almeno un impianto dentale in funzione per un minimo di un anno, affetti da periimplantite;
I = intervento: dati clinici raccolti con l'obiettivo di stabilire la gravità della malattia peri-implantare e di definire nuovi criteri per classificare le malattie peri-implantari;
C = comparatore/controllo: risultati clinici della peri-implantite confrontati con segni clinici di parodontite, così come con pazienti sani;
O = risultati: parametri clinici e valutazione radiografica della peri-implantite: BOP, PPD, indice di sanguinamento, presenza di SUP e perdita ossea marginale (MBL).
Strategia di ricerca
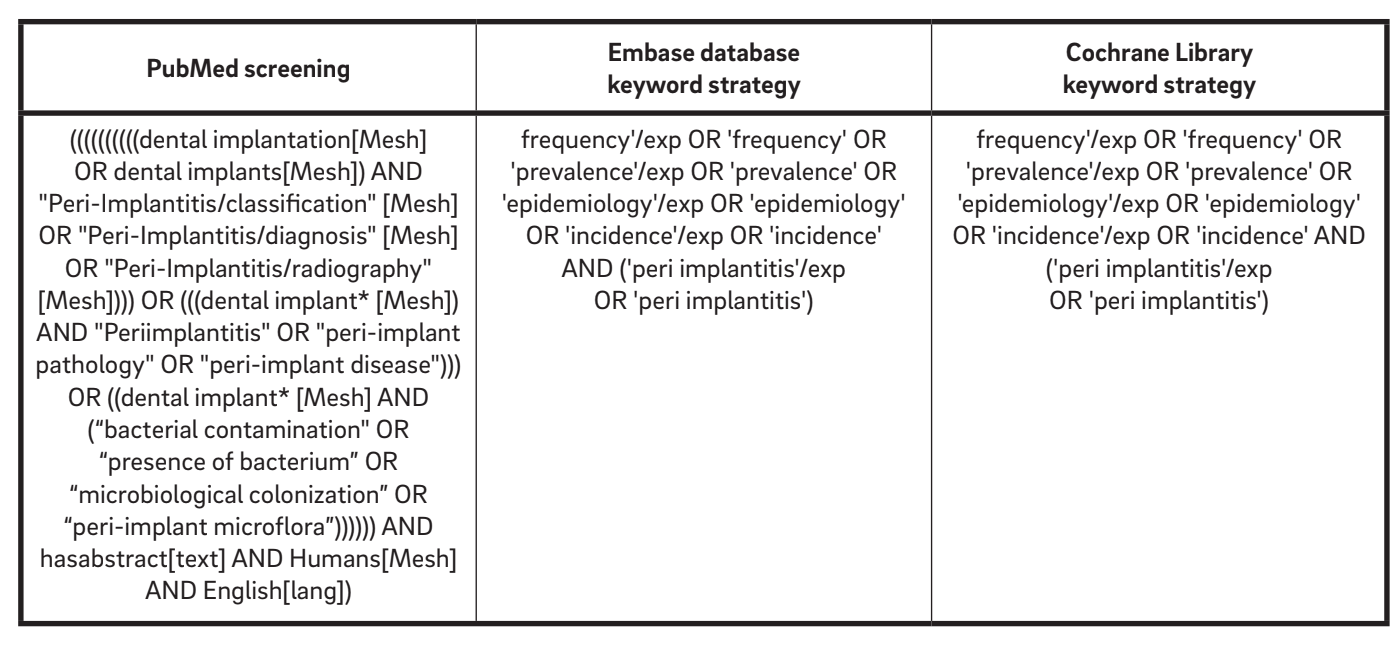
È stata eseguita una strategia di ricerca iniziale che comprendeva la letteratura inglese dal 1967 fino a ottobre 2015 per identificare studi pertinenti che soddisfacessero i criteri di inclusione. Sono state consultate le seguenti banche dati elettroniche: il database PubMed della Biblioteca Nazionale di Medicina degli Stati Uniti, Embase (Excerpta Medica dataBASE) e la Cochrane Library. Secondo la checklist AMSTAR (A Measurement Tool to Assess Systematic Reviews), è stata esaminata la Grey Literature Database nel Grey Literature Report dell'Accademia di Medicina di New York per trovare possibili lavori non pubblicati. Lo screening è stato effettuato in modo indipendente e simultaneo da due esaminatori (MT e AM). Un terzo revisore (LC) ha riesaminato gli studi inclusi ed esclusi. Le banche dati elettroniche sono state cercate utilizzando una combinazione di parole chiave booleane, inclusi MeSH e diversi termini in testo libero (Tabella 1).
Criteri di idoneità
I seguenti criteri di inclusione sono stati definiti per la selezione degli articoli:
- scritti in inglese;
- che comportano esami clinici di pazienti umani;
- studi clinici controllati randomizzati di impianti di ≥ 1 anno in funzione;
- studi di coorte prospettici e retrospettivi di impianti di ≥ 1 anno in funzione;
- studi trasversali di ≥ 1 anno in funzione; e
- revisioni sistematiche, revisioni narrative, dichiarazioni di consenso, commenti o editoriali.
Gli articoli sono stati esclusi se erano
- studi sugli animali;
- in vitro studi;
- rapporti di siti e/o condizioni compromessi localmente o sistemicamente;
- rapporti con < 15 casi;
- rapporti che coinvolgono mini-impianti, impianti monopezzo o impianti a lama; o
- rapporti su impianti < 1 anno in funzione.
Sono stati selezionati articoli senza abstract, ma con titoli correlati agli obiettivi di questa revisione, in modo che il testo completo potesse essere esaminato per l'idoneità. I testi completi sono stati ottenuti per tutti gli abstract e i titoli che sembravano soddisfare i criteri di inclusione e sono stati valutati per l'inclusione dagli stessi due esaminatori. Le liste di riferimento degli studi selezionati sono state esaminate per ulteriori articoli che potrebbero aver soddisfatto i criteri di idoneità dello studio. Inoltre, sono state condotte ricerche manuali delle liste di riferimento delle revisioni sistematiche selezionate, limitate alle seguenti riviste: Clinical Implant Dentistry and Related Research, Clinical Oral Implants Research, International Journal of Oral and Maxillofacial Implants, Journal of Clinical Periodontology e Journal of Periodontology. Qualsiasi disaccordo tra i due revisori è stato risolto dopo una discussione aggiuntiva. Inoltre, l'accordo tra gli investigatori è stato calcolato nella seconda fase. Un revisore finale (LC) ha valutato possibili incoerenze tra i due revisori. Tutti i testi completi degli articoli selezionati sono stati archiviati in cartelle condivise accessibili a tutti i revisori.
Valutazione qualitativa dei parametri per definire la periimplantite
È stata effettuata una valutazione descrittiva per analizzare qualitativamente l'insieme di parametri considerati per definire la periimplantite come una condizione infiammatoria irreversibile che porta alla degradazione del tessuto duro. Di conseguenza, sono stati valutati i seguenti parametri comuni: PPD, BOP, SUP e MBL radiografico. Tali parametri provenienti dai vari articoli sono stati aggregati per analizzare la varianza o l'uniformità tra le definizioni di caso riportate di periimplantite. Sono stati generati grafici per presentare la varianza. Mentre il PPD è stato classificato in tre gruppi diversi (< 3 mm, 3–5 mm e > 5 mm), l'MBL radiografico è stato categorizzato in quattro intervalli principali, a seconda del riferimento principale che considera la consegna della protesi come baseline: ≤ 1 mm, > 1–2 mm, > 3–4 mm e ≥ 5 mm.
Risultati
Processo di screening
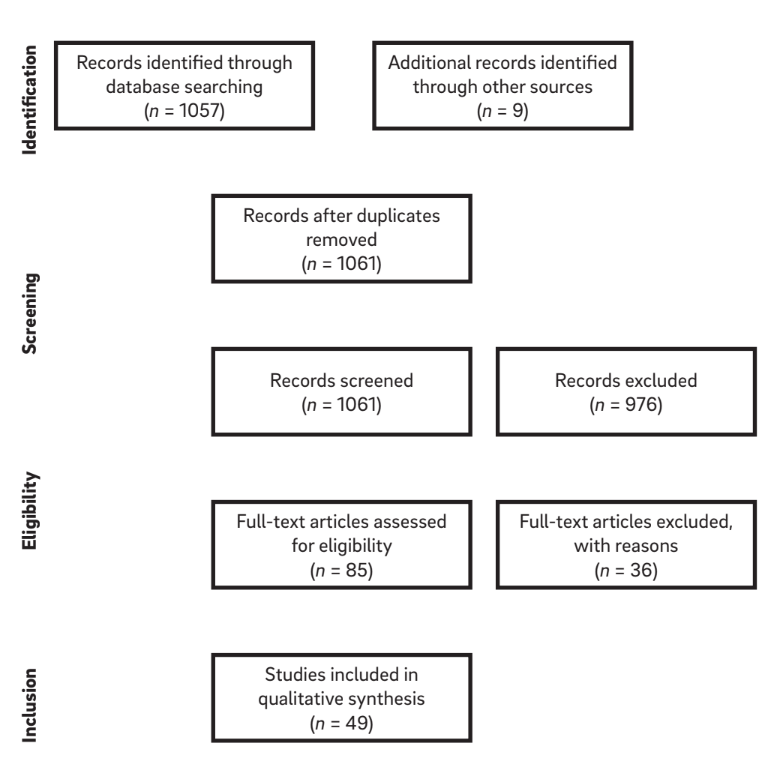
Le combinazioni di termini di ricerca e una ricerca manuale di riferimenti in articoli selezionati hanno portato a un elenco di 1.061 titoli. Di questi, 976 articoli sono stati esclusi sulla base della valutazione del titolo e dell'abstract, lasciando 85 articoli idonei per l'inclusione (k = 0,84). Dopo l'applicazione dei criteri di idoneità, un totale di 49 articoli è stato considerato per la revisione. Dopo la selezione e la lettura degli articoli a testo completo, le informazioni rilevanti da ciascun articolo sono state estratte. Un diagramma della strategia di ricerca è mostrato in Figura 1.
Definizioni di “periimplantite”
Diciotto manoscritti, inclusi revisioni narrative e sistematiche, dichiarazioni di consenso e articoli originali, sono stati selezionati e i dati sono stati estratti. Nel 1965, Levignac riportò un'infiammazione dei tessuti molli periimplantari con successiva distruzione dell'osso e la etichettò come “periimplantite.” Nel 1987, Mombelli et al. descrissero la periimplantite come una malattia infettiva che condivide caratteristiche con la parodontite cronica.13 Lo stesso autore sottolineò la natura infettiva di questa condizione patologica, concentrandosi sul carico batterico della superficie dell'impianto e sull'apparizione successiva di una reazione infiammatoria dei tessuti molli adiacente agli impianti dentali che a volte portava alla perdita di osso di supporto. Come la parodontite, l'etiopatogenesi della periimplantite è stata dimostrata essere innescata da un'infezione batterica che attiva una cascata di citochine, portando a una perdita ossea infiammatoria.
“Peri-implantite” è diventato un termine accettato nel rapporto di consenso del 1° Workshop Europeo di Parodontologia nel 1993. È stato descritto come una reazione infiammatoria distruttiva irreversibile attorno agli impianti in funzione che porta alla perdita di osso di supporto. Il 6° Workshop Europeo di Parodontologia ha presentato una definizione modificata, non solo per riconoscere che la peri-implantite è una condizione trattabile, ma anche per includere il termine collettivo di “malattia peri-implantare” sia per la mucosite peri-implantare che per la peri-implantite.
Al fine di migliorare la qualità della ricerca sulle malattie peri-implantari, il 7° Workshop Europeo di Parodontologia ha raccomandato l'uso di definizioni di caso inequivocabili: cambiamenti nel livello dell'osso crestal e presenza di BOP e/o SUP, con o senza un concomitante approfondimento delle tasche peri-implantari. Infine, l'Accademia Americana di Parodontologia nel 2013 ha definito “peri-implantite” come una reazione infiammatoria associata alla perdita di osso di supporto oltre il rimodellamento biologico osseo iniziale attorno a un impianto in funzione.
L'estensione e la gravità delle malattie periimplantari sono state raramente riportate. Froum e Rosen hanno proposto una combinazione di BOP e/o SUP, PPD e l'estensione della MBL radiografica attorno all'impianto per classificare la periimplantite in categorie di malattia precoce, moderata o avanzata. Allo stesso modo, Decker et al. hanno proposto un sistema di prognosi basato sulla diagnosi per ciascuna categoria seguendo la classificazione di prognosi di Kwok e Caton per la dentizione naturale. Nel loro studio, gli autori hanno dichiarato che PPD, l'estensione della MBL radiografica, la presenza di SUP e la mobilità dell'impianto sono stati trovati essere i fattori più critici per categorizzare i casi come aventi una prognosi favorevole, dubbia, sfavorevole o senza speranza.
Recentemente, Albrektsson et al. hanno modificato il concetto di periimplantite come una perdita di osso attorno a un impianto come una reazione clinicamente sfavorevole e sbilanciata del corpo estraneo, specificando che l'osseointegrazione è un processo mediante il quale l'osso reagisce all'impianto dentale formando una struttura calcificata adiacente ad esso. Infatti, a volte, questa reazione del corpo estraneo può effettivamente portare a un'attività osteoclastica che può distruggere l'osso di supporto. Gli autori credono che il termine “periimplantite” sia piuttosto appropriato, perché non è una malattia primaria, ma una complicazione di una reazione clinicamente sfavorevole e sbilanciata del corpo estraneo che è il punto di partenza del processo patologico e delle conseguenti sequele tissutali.
Attualmente, come previsto dal consenso del 7° Workshop Europeo sulla Parodontologia, si presume che l'infezione stessa sia sempre causata dalla placca e dai suoi prodotti; Tuttavia, numerosi fattori di rischio sono riconosciuti come specificamente associati alla periimplantite, come fattori chirurgici o protesici, caratteristiche dell'impianto, fumo e risposta dell'ospite.
Definizione di periimplantite con diagnosi clinica e radiografica
Trentuno manoscritti (Tabella 2) sono stati selezionati e sono stati estratti dati. Informazioni da 1.711 pazienti con 5.432 impianti sono state analizzate. Il termine “periimplantite” è stato generalmente utilizzato per descrivere qualsiasi impianto con vari gradi di perdita ossea, e una chiara definizione non è stata presentata o è stata estratta direttamente dalla terminologia.
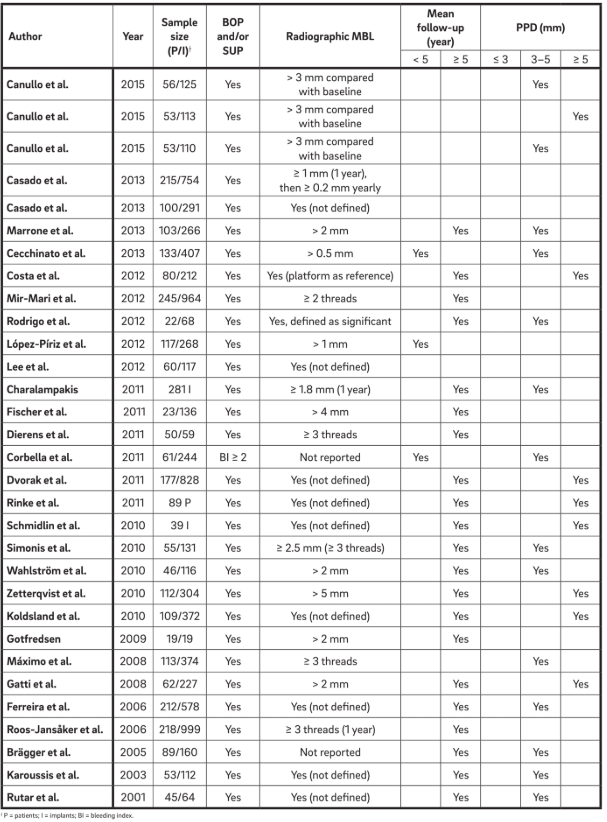
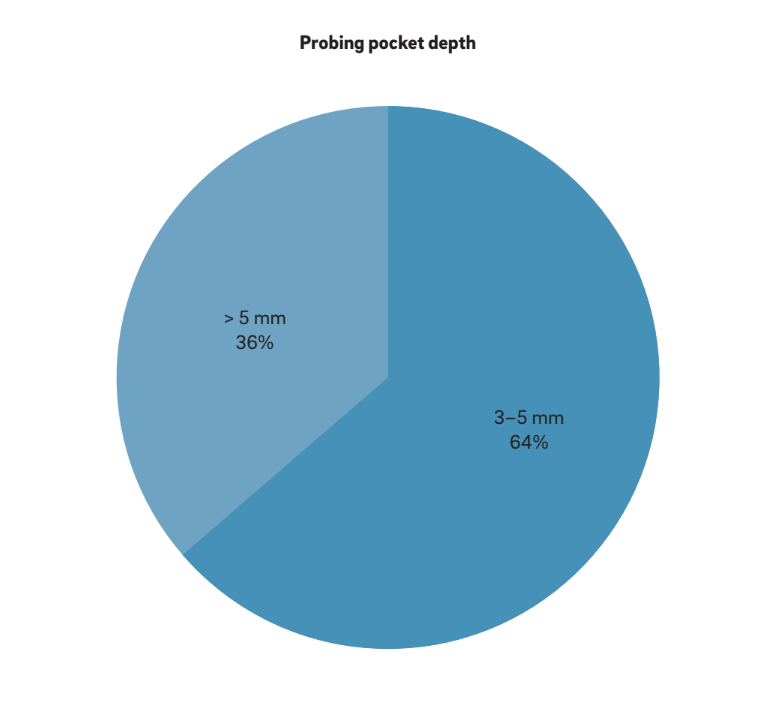
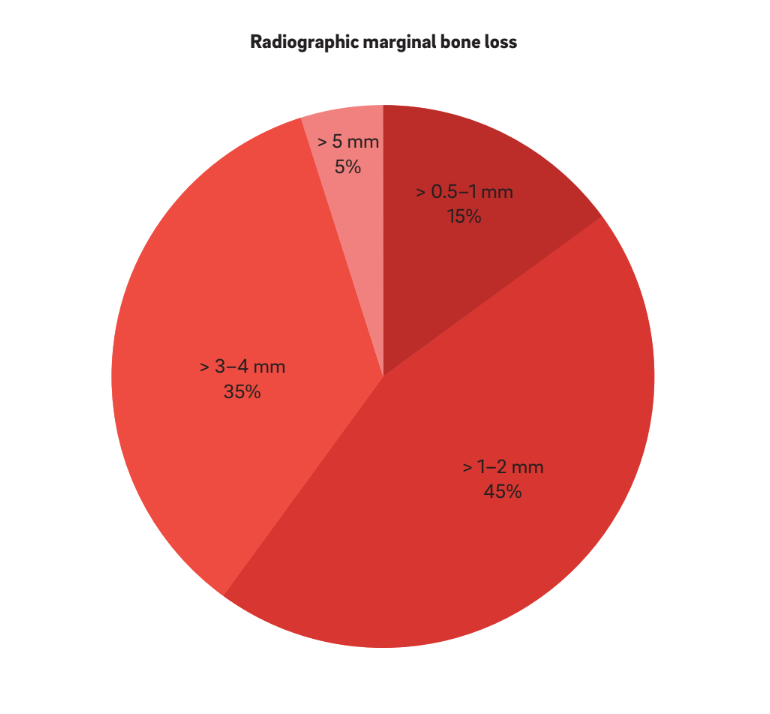
Quattro caratteristiche principali sono state utilizzate per definire “periimplantite”. È interessante notare che tutti gli autori considerano BOP e SUP come indicatori di periimplantite. Questo approccio considera la periimplantite indotta esclusivamente da placca e corpi estranei, dove una risposta infiammatoria è spesso innescata dal biofilm o dai suoi prodotti e/o sostanze estranee, come il cemento residuo. Inoltre, 22 studi hanno chiaramente riportato PPD come un parametro cruciale per determinare la periimplantite. Nessuno studio ha considerato PPD < 3 mm come indicativo di periimplantite. Mentre la stragrande maggioranza (64%) degli studi ha definito PPD = 3–5 mm come indicativo di periimplantite, il restante 36% ha considerato PPD > 5 mm come riferimento (Fig. 2). Un MBL radiografico ≥ 0.5–1 mm, > 1–2 mm, > 3–4 mm e ≥ 5 mm, prendendo la consegna della protesi come baseline, è stato considerato come definente la periimplantite nel 15%, 45%, 35% e 5% degli studi, rispettivamente (Fig. 3). Pertanto, si è ipotizzato che un MBL radiografico < 1 mm dovrebbe essere considerato come rimodellamento osseo fisiologico.
BOP e/o SUP erano prerequisiti in tutti gli studi analizzati. Nella maggior parte degli studi, è stata utilizzata la combinazione di misurazioni cliniche e radiografiche per la definizione dei casi. In due studi prospettici, il MBL radiografico non è stato riportato e sono state utilizzate solo misurazioni cliniche per valutare le complicazioni biologiche. In questi casi, la presenza di BOP e/o SUP alla sondatura e PPD ≥ 4 mm erano prerequisiti per una diagnosi di periimplantite. In nove studi, uno studio controllato randomizzato, tre studi prospettici e cinque studi retrospettivi, sono state effettuate valutazioni di BOP e radiografiche da sole, senza riportare alcuna misurazione di PPD. In questi casi, un MBL compreso tra 0,5 mm e > 4 mm34 è stato considerato associato alla periimplantite.
Prima del 2012, i cambiamenti nel livello dell'osso crestal non erano né definiti né riportati chiaramente, rendendo difficile la diagnosi di periimplantite. Tuttavia, anche negli studi che definivano l'entità del MBL, sono stati utilizzati criteri diagnostici diversi. In uno studio a lungo termine, la periimplantite è stata definita come la presenza di BOP, PPD ≥ 4 mm e MBL > 0,5 mm. Tuttavia, un altro studio ha utilizzato MBL > 4 mm come valore di riferimento.34 La maggior parte degli studi ha considerato MBL > 2 mm per la diagnosi di periimplantite. In precedenza, il nostro gruppo ha utilizzato un MBL radiografico > 3 mm, dalla radiografia di base effettuata al momento della consegna della protesi, per diagnosticare la periimplantite. In altri tre studi, il MBL è stato considerato in relazione al tempo in cui la protesi era in funzione. Tutti gli studi tranne cinque hanno calcolato il MBL in millimetri. Negli altri studi, i fili dell'impianto sono stati utilizzati come riferimento.
Otto studi hanno applicato PPD > 5 mm per la diagnosi di periimplantite. Marrone et al. hanno definito la periimplantite come la presenza di BOP, PPD > 5 mm e MBL > 2 mm. Charalampakis et al. hanno applicato i criteri della presenza di BOP e/o SUP, PPD ≥ 5 mm e MBL ≥ 1.8 mm dopo un anno di funzionamento. Zetterqvist et al. hanno incluso casi di PPD > 5 mm e MBL ≥ 3 mm. Altri due studi, uno prospettico e uno retrospettivo, hanno applicato la presenza di BOP e/o SUP, PPD > 5 mm e segni radiografici di MBL, senza specificare il livello osseo di base. BOP e/o SUP positivi, MBL radiografico ≥ 3 mm e PPD ≥ 6 mm sono stati utilizzati da Koldsland et al.
Al 7° e 8° Workshop Europeo sulla Parodontologia, la mucosite periimplantare e la periimplantite sono state descritte come segue: “cambiamenti nel livello dell'osso crestal, presenza di sanguinamento alla sondatura e/o suppurazione; con o senza concomitante approfondimento delle tasche peri-implantari.” La mucosite periimplantare è stata definita con BOP e/o SUP positivi e la periimplantite con BOP e/o SUP positivi, in combinazione con MBL radiografico ≥ 2 mm. Gli stessi parametri sono stati utilizzati da Zitzmann e Berglundh per definire la periimplantite. Tuttavia, Atieh et al. hanno utilizzato gli stessi criteri, più PPD ≥ 5 mm, come definizione di periimplantite nel loro articolo di revisione sistematica.
Discussione
Le malattie periimplantari si presentano in due forme: mucosite periimplantare e periimplantite. Entrambe sono caratterizzate da una reazione infiammatoria nei tessuti circostanti un impianto. La mucosite periimplantare è stata definita come una reazione infiammatoria reversibile nei tessuti molli che circondano un impianto in funzione, mentre la periimplantite è stata definita come una lesione infiammatoria più profonda caratterizzata da una tasca periimplantare approfondita e dalla perdita di osso di supporto attorno a un impianto funzionale.
Studi pubblicati all'inizio del 2010 hanno suggerito che la mucosite e la periimplantite siano equivalenti alla parodontite, poiché entrambe sono descritte come uno squilibrio tra carico batterico e risposta dell'ospite. Basandosi su questo, entrambe le malattie sono strettamente correlate alla formazione di un biofilm contenente microbiota ricco di batteri Gram-negativi in presenza di un ospite suscettibile. Tuttavia, è stato dimostrato che i microrganismi possono essere presenti, ma non sono una necessità per la periimplantite. Inoltre, sia la parodontite che la periimplantite condividono diversi fattori di rischio sistemici o indicatori comuni (ad es., fumo, scarsa igiene orale, diabete o storia di parodontite, osteoporosi). Allo stesso modo, la periimplantite, come avviene con la parodontite, sembra essere influenzata da un particolare profilo genetico (cioè, polimorfismo dell'interleuchina-1). Altri hanno rifiutato la descrizione di una malattia comparabile alla parodontite, a causa delle differenze anatomiche che esistono tra le strutture parodontali e periimplantari (ad es., diversa orientazione delle fibre di collagene [perpendicolare vs. orizzontale], vascolarità o capacità di riparazione, e la resilienza meccanica fornita dal legamento parodontale). Infatti, la parodontite è caratterizzata dalla distruzione infiammatoria dell'apparato di supporto della dentizione (parodonto), inclusi il legamento parodontale e l'osso alveolare. A causa della diversa composizione dei due tessuti di supporto, reazioni tissutali simili attorno a un impianto e a un dente sembrano molto improbabili. Il termine “osseo-insufficienza” è stato proposto da Zarb e Koka per descrivere la differenza tra la periimplantite e la perdita ossea indotta da parodontite. L'immagine anatomica della riassorbimento osseo dovuto a parodontite o periimplantite differisce, in molte situazioni, con crateri ossei molto ampi tipici per l'impianto ma non per il dente. Pertanto, la periimplantite può essere considerata distinta dalla parodontite in quanto differisce significativamente riguardo all'insorgenza e alla progressione e ha una scarsa prevedibilità del trattamento; di conseguenza, il suo trattamento deve essere focalizzato sulla diagnosi precoce e sul controllo dei fattori di rischio o indicatori per prevenirne l'insorgenza.
Ad oggi, non ci sono stati parametri standardizzati per differenziare clinicamente i vari stadi e gravità della periimplantite. I criteri utilizzati per diagnosticare la periimplantite rimangono inconcludenti. La maggior parte degli studi esistenti ha utilizzato parametri clinici in combinazione con risultati radiografici per definire la periimplantite. Tuttavia, i parametri clinici come BOP e PPD attorno agli impianti sono meno prevedibili, poiché sono influenzati da fattori confondenti rispetto alla dentizione naturale. Inoltre, qualsiasi fattore che facilita la formazione della placca (ad es., scarsa igiene orale) o la capacità di difesa dell'ospite (ad es., abitudine al fumo, consumo eccessivo di alcol, tratti genetici, storia di parodontite o uso di bifosfonati) potrebbe contribuire allo sviluppo della periimplantite. La diagnosi e la progressione della periimplantite possono essere caratterizzate da misurazioni aumentate per i parametri clinici (PPD, BOP, SUP o addirittura mobilità), MBL e microbiologia. Per quanto riguarda i parametri clinici, il PPD è un metodo di valutazione valido, poiché esiste una correlazione tra i livelli ossei registrati e la penetrazione della sonda radiografica. Tuttavia, in uno studio trasversale, i livelli ossei periimplantari misurati intraoperatoriamente erano più apicali rispetto ai livelli ossei radiografici. Il SUP si verifica più frequentemente negli impianti con perdita ossea progressiva rispetto a quelli senza, in particolare nei fumatori, e può essere associato a episodi di distruzione attiva dei tessuti. In una revisione sistematica, Berglundh et al. hanno definito la periimplantite come avente un PPD ≥ 6 mm o MBL ≥ 2,5 mm. Lang e Berglundh, nel consenso della Federazione Europea di Parodontologia del 2011, hanno affermato che i dati clinici e radiografici dovrebbero essere ottenuti di routine dopo l'installazione della protesi sugli impianti per stabilire una linea di base per la diagnosi di periimplantite durante la manutenzione dei pazienti con impianti. Una meta-analisi di Derks e Tomasi ha chiaramente mostrato una relazione positiva tra la prevalenza della periimplantite e il tempo di funzione. La presenza di perdita ossea e PPD da sola potrebbe non essere sufficiente per stabilire una diagnosi di periimplantite. Un fattore importante che potenzialmente influenza l'ampia gamma di prevalenza della periimplantite è la mancanza di consenso riguardo ai parametri clinici. Ad esempio, uno studio ha riportato che se il PPD > 4 mm veniva utilizzato come criterio, allora il 74,8% degli individui aveva periimplantite, ma se questa misurazione veniva cambiata in > 6 mm, allora la prevalenza scendeva al 43,9%. Quando l'MBL radiografico veniva considerato per definire la periimplantite, il 25,3% degli individui mostrava > 2 mm, mentre il 13,1% aveva > 3 mm. Infatti, se si considera il PPD, si può trovare ulteriore eterogeneità. La sonda attorno agli impianti è influenzata da molti fattori, come la dimensione della sonda, la forza di sondaggio, la direzione della sonda, la salute e lo spessore del tessuto molle periimplantare e il design del collo dell'impianto e della sovrastruttura.1 Infatti, il design a piattaforma switch, così come le restaurazioni difettose, possono complicare il sondaggio e, quindi, nascondere la vera estensione della periimplantite. Inoltre, la presenza di discrepanze nei livelli di tessuto duro e molle buccolinguali può risultare in letture di PPD diverse.
A causa della mancanza di parametri standard per determinare la presenza e la gravità della malattia periimplantare, è difficile sviluppare una strategia clinica basata sulla PPD nella gestione di questo comune problema nell'odontoiatria implantare. Tuttavia, Froum e Rosen hanno proposto un sistema di classificazione per determinare la gravità della periimplantite basato su PPD, MBL e segni clinici di BOP e/o SUP,28 ma questo sistema deve ancora essere convalidato. Inoltre, in una serie di studi condotti da Merli et al., l'accordo inter-valutatore nella diagnosi della malattia periimplantare è stato giudicato solo buono, a causa della definizione poco chiara di periimplantite e mucosite, con accordo completo ottenuto solo nella metà dei casi (52%).
La stragrande maggioranza (45%) degli studi inclusi nella presente revisione ha trovato MBL radiografico > 1–2 mm dopo il carico protesico. Pertanto, i seguenti criteri per definire la periimplantite sono proposti: un MBL radiografico > 1 mm dopo la consegna della protesi implantare o 2 mm almeno sei mesi dopo il posizionamento della protesi implantare come buon indicatore di periimplantite. Il BOP non possiede un alto valore predittivo a causa della debole connessione dei tessuti molli attorno agli impianti dentali. Allo stesso modo, la PPD dipende in gran parte dal design dell'impianto (livello osseo vs. livello tissutale), dalla posizione apicocoronale e dal biotipo. Dai dati estratti, sembra logico considerare l'MBL radiografico come l'indicatore più uniforme e accurato della periimplantite. Sebbene il valore di cut-off dipenda dal pattern infiammatorio del paziente, dal tipo di intervento chirurgico, dalla posizione apicocoronale dell'impianto, dal macrodesign dell'impianto e dal modulo crestale, considerando la rapida progressione della malattia nel tempo, deve essere seguito un rigoroso controllo radiografico se viene rilevato qualche sintomo clinico. Inoltre, il clinico deve utilizzare una combinazione dei molti parametri clinici disponibili, come PPD, stato infiammatorio della mucosa, BOP alla leggera sondatura, MBL radiografico e possibilmente biomarcatori batterici e/o di fluido crevicolare periimplantare per stabilire una diagnosi accurata di periimplantite. A differenza del caso della parodontite, il test batterico potrebbe non essere affidabile nella diagnosi della periimplantite. Ciò suggerisce che gli ecosistemi parodontalici e periimplantari differiscono significativamente e, quindi, la malattia periimplantare potrebbe non essere sempre affrontata come una malattia infettiva. Allo stesso modo, tale differenza è stata dimostrata applicabile alla patogenesi. Inoltre, non è stata trovata alcuna evidenza che un'infezione primaria causasse la riassorbimento osseo marginale.
Conclusione
La letteratura scientifica disponibile ha suggerito l'assenza di una definizione unanime di periimplantite. Le attuali definizioni di periimplantite si basavano esclusivamente su parametri clinici senza considerare altri potenziali fattori di rischio correlati alla malattia. Dovrebbero essere considerati futuri studi che applicano definizioni di caso coerenti.
Marco Tallarico, Alberto Monje, Hom-Lay Wang, Pablo Galindo Moreno, Erta Xhanarid & Luigi Canulloe
Riferimenti
- Levignac J. [Osteolisi periimplantare— periimplantosi—periimplantite]. Rev Fr Odontostomatol. 1965 Ott;12(8):1251–60. Francese.
- Hämmerle CH, Glauser R. Valutazione clinica del trattamento con impianti dentali. Periodontol 2000. 2004 Feb;34:230–9.
- Schwarz F, Becker K, Sager M. Efficacia della rimozione professionale della placca con o senza misure aggiuntive per il trattamento della mucosite peri-implantare. Una revisione sistematica e meta-analisi. J Clin Periodontol. 2015 Apr;42 Suppl 16:S202–13.
- Atieh MA, Alsabeeha NH, Faggion CM, Duncan WJ. La frequenza delle malattie peri-implantari: una revisione sistematica e meta-analisi. J Periodontol. 2013 Nov;84(11):1586–98.
- Zitzmann NU, Margolin MD, Filippi A, Weiger R, Krastl G. Valutazione e diagnosi del paziente nel trattamento implantare. Aust Dent J. 2008 Giu;53 Suppl 1:S3–10.
- Sanz M, Chapple IL; Gruppo di Lavoro 4 dell'VIII Workshop Europeo sulla Parodontologia. Ricerca clinica sulle malattie peri-implantari: rapporto di consenso del Gruppo di Lavoro 4. J Clin Periodontol. 2012 Feb;39 Suppl 12:202–6.
- American Academy of Periodontology. Rapporto dell'Accademia: mucosite peri-implantare e periimplantite: una comprensione attuale delle loro diagnosi e implicazioni cliniche. J Periodontol. 2013 Apr;84(4):436–43.
- Lang NP, Berglundh T; Gruppo di Lavoro 4 del Settimo Workshop Europeo sulla Parodontologia. Malattie periimplantari: dove siamo ora?—Consenso del Settimo Workshop Europeo sulla Parodontologia. J Clin Periodontol. 2011 Mar;38 Suppl 11:178–81.
- Chan HL, Lin GH, Suarez F, MacEachern M, Wang HL. Gestione chirurgica della periimplantite: una revisione sistematica e meta-analisi dei risultati del trattamento. J Periodontol. 2014 Ago;85(8):1027–41.
- Lindhe J, Meyle J; Gruppo D del Workshop Europeo sulla Parodontologia. Malattie peri-implantari: rapporto di consenso del Sesto Workshop Europeo sulla Parodontologia. J Clin Periodontol. 2008 Set;35(8 Suppl):282–5.
- Mombelli A, Müller N, Cionca N. L'epidemiologia della periimplantite. Clin Oral Implants Res. 2012 Ott;23 Suppl 6:67–76.