Confronto di tre tecniche di otturazione in relazione alla perdita batterica
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract
Obiettivo: Confrontare la perdita batterica nei canali radicolari otturati con le tecniche a cono singolo modificato, condensazione laterale e onda continua di condensazione.
Metodi: I canali radicolari distobuccali dei molari mascellari sono stati modellati fino a ProTaper F2 e otturati con la tecnica a cono singolo modificato, condensazione laterale o onda continua di condensazione. È stato utilizzato un modello batterico a due camere con Enterococcus faecalis per la valutazione della perdita batterica per 30 giorni. È stato applicato il test del chi-quadrato per valutare le differenze tra campioni torbidi e non torbidi, e il test di Kruskal-Wallis è stato utilizzato per valutare il tempo necessario per la microperdita. Un livello di significatività del 5% è stato impostato per tutte le analisi.
Risultati: La tecnica a cono singolo modificato ha mostrato perdite nel 73,3% dei campioni, la condensazione laterale nel 66,6% e l'onda continua di condensazione nel 53,3%, ma non ci sono state differenze significative tra i gruppi (p>0,05).
Conclusioni: Si può concludere che la tecnica del cono singolo modificata mostra un'efficacia di sigillatura simile a quella della tecnica di condensazione laterale e della tecnica di onda continua di condensazione.
Introduzione
Lo scopo dell'otturazione di un sistema canalare radicolare è la sua sigillatura attraverso il legame di un materiale solido con un sigillante endodontico. Tuttavia, è stato osservato che un'eccessiva quantità di sigillante può essere solubilizzata e creare spazi vuoti, ostacolando la sigillatura.
La condensazione laterale è la tecnica più antica e ancora utilizzata, ma richiede competenza professionale e richiede più tempo e materiale per la sua esecuzione. La tecnica di otturazione del canale radicolare con gutta-percha termoplastificata è una delle più indicate perché è associata a un migliore riempimento anatomico e a una minore quantità di sigillante utilizzato, ma manca di controllo longitudinale e necessita di attrezzature speciali.
In questo modo, il miglioramento delle tecniche più vecchie e convenzionali mira a migliorare la praticità, la rapidità e la semplicità, a beneficio sia del paziente che del dentista. Attualmente, anche la modellatura delle pareti del canale viene ottenuta mediante strumentazione meccanizzata, che consente il riempimento radicolare con cono singolo. Questa tecnica di otturazione non richiede l'introduzione di molti coni accessori, riduce il tempo operativo, è facile da eseguire e non richiede attrezzature speciali.
Tuttavia, è stato osservato che la modellatura con il sistema rotante ProTaper consente l'uso di un cono master 0.06 e di un diametro apicale maggiore rispetto all'ultimo strumento, caratterizzando questo come una tecnica a cono singolo modificata. I confronti della quantità di materiale di otturazione tra il cono singolo originale ProTaper e il cono singolo modificato hanno mostrato una percentuale maggiore di guttaperca rispetto al sigillante quando si utilizza la tecnica modificata.
Considerando che non ci sono studi che valutano la capacità di sigillatura della tecnica a cono singolo modificata, l'obiettivo del presente studio era confrontare la micropermeabilità dei canali strumentati con ProTaper e otturati con la tecnica a cono singolo modificata, condensazione laterale e onda continua di condensazione.
Materiale e metodi
Dopo l'approvazione del Comitato Etico della Scuola di Odontoiatria, Università di São Paulo (23/2010), 49 radici distobuccali di molari mascellari sono state standardizzate a 10 mm di lunghezza e sterilizzate in autoclave. Il percorso del canale è stato esplorato e il forame apicale è stato standardizzato utilizzando un K-file di dimensione 15 (Dentsply Maillefer, Ballaigues, Svizzera).
I campioni sono stati strumentati secondo Machado et al.: i terzi cervicale e medio sono stati preparati con punte Gates Glidden 1, 2 e 3 (Dentsply Maillefer) e file ProTaper (Dentsply Maillefer) SX e S2 a 500 rpm e una coppia di 4 Ncm (X-Smart; Dentsply Maillefer). La lunghezza di lavoro è stata determinata utilizzando una K-file di dimensione 15 introdotta a meno di 1 mm dal forame. Il terzo apicale è stato strumentato con file manuali fino alla K-file di dimensione 25, seguita da ProTaper S1, S2, F1 e F2, utilizzando NaOCl al 1% (Fórmula e Ação, São Paulo, SP, Brasile). L'irrigazione finale è stata effettuata con 5 mL di NaOCl al 1% seguita da 5 mL di EDTA al 17% (Fórmula e Ação) e poi altri 5 mL di NaOCl al 1%. Dopo la verifica della pervietà con una K-file di dimensione 15, i canali sono stati asciugati con punti di carta (ProTaper; Dentsply Maillefer). I campioni sono stati suddivisi casualmente in 3 gruppi (n=15) come segue:
Cono singolo modificato: un cono master 30 o 35/0.06 (Dentsply Maillefer) (che ha raggiunto una migliore adattabilità nella lunghezza di lavoro) è stato posizionato nel canale con sigillante AHPlus (Dentsply De Trey Gmbh, Konstanz, DE-BW, Germania) preparato come raccomandato dal produttore. L'eccesso di guttaperca è stato rimosso con un plugger elettrico (Dentsply Tulsa Dental, Tulsa, OK, Stati Uniti d'America) impostato a 200°C, seguito da condensazione a freddo.
Condensazione laterale: è stata selezionata una cono master 30 o 35/0.02 (che forniva una migliore adattabilità nella lunghezza di lavoro) e posizionata nel canale con sigillante AHPlus. La compattazione laterale è stata ottenuta utilizzando coni accessori (Dentsply Maillefer) e uno spreader B (Dentsply Maillefer) fino a non penetrare più di 2 mm del terzo cervicale. L'eccesso è stato rimosso e compattato come nel gruppo precedente.
Onda continua di condensazione: è stata selezionata una cono master 0.02 e posizionata nel canale come nei gruppi precedenti, dove è stata inserita nel canale con sigillante AHPlus. Un plugger elettrico impostato a 200°C e precedentemente calibrato a 6 mm è stato introdotto nel canale, e la condensazione a freddo è stata eseguita nel terzo apicale. È stata quindi eseguita la riempitura utilizzando il Calamus Pack Obturation Delivery System (Dentsply Tulsa Dental, Tulsa, OK, USA) impostato a 180°C, seguita da condensazione a freddo.
Il controllo positivo consisteva in due campioni strumentati e senza otturazione, e il controllo negativo consisteva in due campioni in cui è stata utilizzata la condensazione laterale per l'otturazione e l'apertura coronale sigillata con cianoacrilato (Henkel, Jacareí, SP, Brasile).
Due strati di adesivo cianoacrilico sono stati applicati sulla superficie esterna della radice, lasciando 2 mm dell'apice libero. Tutti i campioni sono stati posti in un'incubatrice a 37°C con umidità al 100% per 7 giorni.
Sono state utilizzate quarantanove fiale acriliche con tappo. Il centro del tappo è stato perforato per adattare un microtubo Eppendorf (Axygen, Union City, CA, USA) con la punta rimossa. La radice è stata adattata all'Eppendorf e fissata con cianoacrilato. La sigillatura è stata effettuata utilizzando uno strato doppio di smalto per unghie (Impala, Porto Velho, RO, Brasile), uno strato di epoxy (Araldite, Brascola, Joinvile, SC, Brasile) e altri due strati di smalto per unghie.
L'apparecchiatura è stata sterilizzata con ossido di etilene e sono stati introdotti 3 mL di TSB sterile (Tryptic Soy Broth, Difco, Le Pont de Claix, RA, Francia) nella fiala acrilica, con 2 mm dell'apice della radice immerso nella soluzione. L'apparecchiatura è stata incubata a 37°C per 7 giorni per dimostrare la sterilità.
Un campione di Enterococcus faecalis (ATCC 29212) in TSB è stato standardizzato su una scala di McFarland di 4 (BioMèriex, Marcy-l’Etoile, RA, Francia) e aggiunto al serbatoio superiore. L'apparecchiatura è stata incubata a 37°C e ogni 48 h, 200 µL del brodo batterico sono stati rimossi e 200 µL di TSB fresco sono stati aggiunti. Il TSB nel serbatoio inferiore è stato controllato per torbidità.
Dopo un periodo sperimentale di 30 giorni, 100 µL del brodo nel compartimento superiore dei campioni che non mostrano perdite e del gruppo di controllo negativo sono stati raccolti e aggiunti al TSB del compartimento inferiore, seguiti da incubazione a 37°C per 24 h per dimostrare la vitalità cellulare. Per confermare la purezza di E. faecalis nel TSB, un campione di brodo nel serbatoio inferiore dei campioni che mostrano perdite e del gruppo di controllo positivo è stato coltivato su piastre TSA (Tryptic Soy Agar, Difco, Le Pont de Claix, RA, Francia) e sono state osservate la morfologia delle colonie e le caratteristiche cellulari.
Il test del chi-quadrato è stato applicato per valutare le differenze tra campioni torbidi e non torbidi, e il test di Kruskal-Wallis è stato utilizzato per valutare il tempo necessario per l'insorgenza della microperdita. Il livello di significatività è stato fissato al 5% per tutte le analisi.
Risultati
I campioni del gruppo di controllo positivo hanno mostrato torbidità entro 24 h di incubazione.
Il 30° giorno, la maggior parte dei campioni ha mostrato perdite, senza differenze significative tra i gruppi (p<0.05). La distribuzione dei campioni perduti e non perduti è mostrata nella Tabella 1.
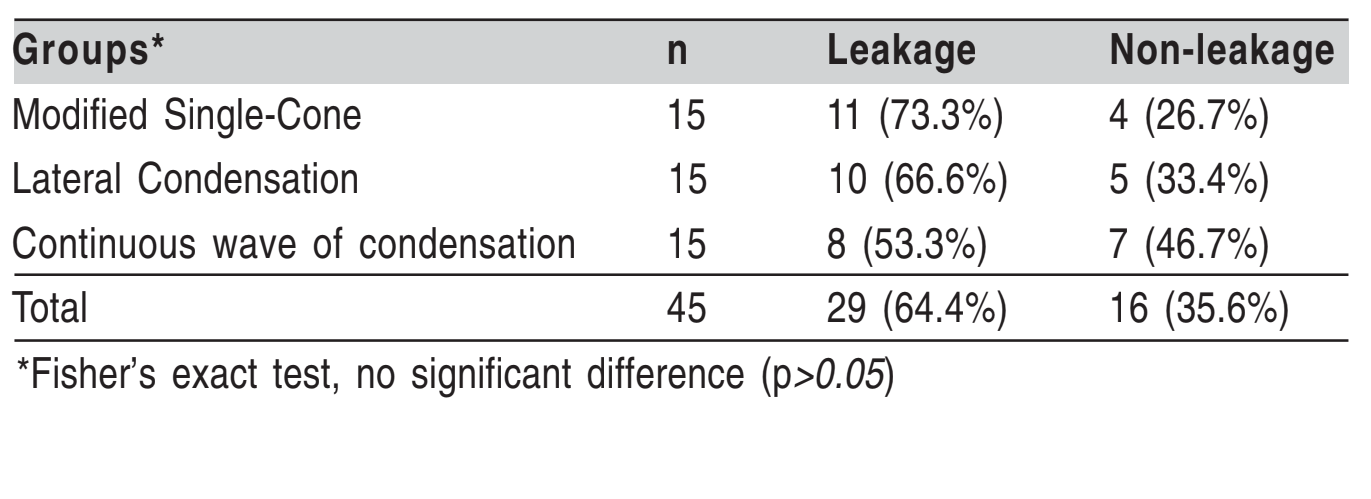
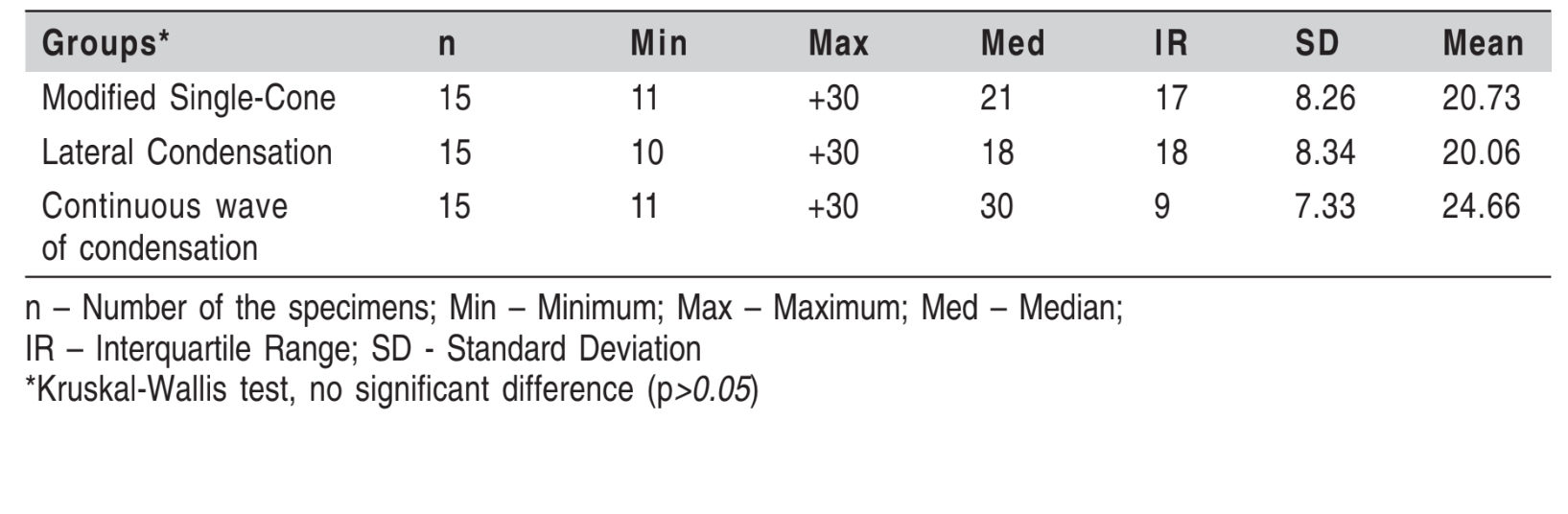
Il tempo minimo per la torbidità è stato di 10 giorni, mentre il tempo medio nel periodo sperimentale è stato di 21,86 giorni, senza differenze significative tra i gruppi (p=0,2817) (Tabella 2).
Il gruppo di controllo negativo non ha mostrato torbidità nel periodo sperimentale. Ogni campione che non mostrava perdite ha avuto la vitalità cellulare confermata positivamente dopo il tempo sperimentale.
Discussione
Vari metodi sono stati impiegati nella valutazione dell'otturazione dei canali radicolari: perdita di colorante, filtrazione di fluidi e perdita batterica. L'opzione per la perdita batterica è giustificata poiché si tratta di un modello sperimentale semplice e facile da replicare. Inoltre, le molecole di colorante sono molto più piccole dei batteri e il metodo di filtrazione di fluidi è eccessivamente sensibile.
La maggior parte degli studi ha utilizzato denti monoradicolati. L'uso dei molari è stato proposto a causa della loro alta incidenza nel trattamento endodontico, e la scelta della radice distobuccale del molare mascellare si basa su un criterio di standardizzazione.
Vari batteri sono stati utilizzati negli studi di microperdita. Tuttavia, c'è un focus su E. faecalis a causa della sua resistenza, sopravvivenza in aree povere di nutrienti per lunghi periodi e associazione con lesioni periapicali croniche persistenti.
I risultati hanno dimostrato che il tempo medio di perdita nei campioni durante il periodo sperimentale era di 21 giorni. Il primo campione ha mostrato perdite a 10 giorni, e il 64,4% ha mostrato perdite entro il tempo sperimentale. Anche se il gruppo termoplastificato ha mostrato un numero maggiore di campioni senza perdite, non c'era una differenza significativa tra i gruppi in relazione al numero di campioni con perdite o meno, e al tempo necessario per la microperdita. Tuttavia, questi risultati devono essere interpretati con cautela. Sebbene questo metodo sia il più utilizzato, i risultati differiscono e non riproducono l'alto tasso di successo clinico dei trattamenti endodontici. I risultati del presente studio mostrano un tasso di perdita simile a quello di diversi lavori sperimentali. Tuttavia, concordiamo con Baumgartner et al. (2007) che questi metodi hanno limitazioni e l'interpretazione dei risultati è interessante per i confronti tra di essi, anche se non corrispondono necessariamente alla realtà clinica. Inoltre, è necessario considerare l'assenza di restauro coronale in questa metodologia che aumenta il tasso di perdita. Pertanto, i nostri risultati hanno mostrato una capacità di sigillatura simile delle tecniche, ma la microperdita potrebbe essere clinicamente inferiore a causa del restauro coronale.
Il confronto dei nostri risultati con altri studi è ostacolato perché possono essere osservate molte variabili metodologiche; come il periodo sperimentale. La letteratura dimostra una discrepanza tra gli studi che hanno mostrato un alto tasso di micropermeabilità a breve termine e quelli che hanno mostrato una percentuale inferiore di campioni con perdite a lungo termine. Ad esempio, Jacobson et al. (2002) hanno mostrato il 75% dei campioni con condensazione laterale con perdite a 48 giorni, Yücel e Çiftçi (2006) con il 95% a 60 giorni, Taºdemir et al. (2009) con il 45% a 56 giorni, Nawal et al. (2011) con
il 70% a 30 giorni, Kangarlou et al. (2012) con il 93% a 60 giorni, e lo studio attuale con il 66,6% a 30 giorni. Al contrario, De-Deus et al. (2006) hanno trovato il 16% a 100 giorni, e De-Deus et al. (2008) con il 30% a 105 giorni. Un'altra variabile da notare è la lunghezza delle radici. Monticelli et al. (2007) hanno utilizzato campioni di 17 mm, Tådemir et al. (2009) 16 mm, e Nawal et al. (2011) 15 mm, rispetto a 10 mm nello studio attuale. Aggiungendo alle variabili ci sono altre condizioni come diversi gruppi di denti, sigillanti e specie batteriche.
Anche con le domande metodologiche sopra menzionate, questo è il metodo in vitro attualmente più accettato dalla comunità scientifica. In considerazione dei risultati, la somiglianza tra i gruppi sperimentali indica la tecnica del cono singolo modificato come un'alternativa che raggiunge gli obiettivi di rapidità, praticità e semplicità, senza perdita di qualità rispetto alle tecniche convenzionali. Tuttavia, futuri studi dovrebbero essere condotti con l'obiettivo di cercare nuovi metodi di valutazione che possano produrre risultati con differenze meno significative tra i modelli sperimentali.
Cleber Keiti Nabeshima, Guilherme Henrique Rosa Martins, Mário Francisco de Pasquali Leonardo, Regina Célia Furukava Shin, Silvana Cai, Manoel Eduardo de Lima Machado
Riferimenti
- Peters DD. Valutazione della solubilità in vitro di due anni di quattro tecniche di otturazione con guttaperca. J Endod. 1986; 12: 139-45.
- Hembrough MW, Steiman HR, Belanger KK. Condensazione laterale in canali preparati con strumenti rotanti in titanio nickel: una valutazione dell'uso di tre diversi coni master. J Endod. 2002; 28: 516-9.
- Gabardo MCL, Silva WJ, Gonçalves LM, Deonízio MDA. Efficacia di diverse tecniche di otturazione nel superare il ledge formato in canali curvi simulati. Braz J Oral Sci. 2013; 12: 138-42.
- Yelton C, Walker MP, Lee C, Dryden JA, Kulild JC. Valutazione di un sistema di consegna di guttaperca termoplastificata per otturare efficacemente canali con dimensioni di preparazione variabili. J Endod. 2007; 33: 156-9.
- Ozawa T, Taha N, Messer HH. Un confronto tra tecniche per otturare canali radicolari di forma ovale. Dent Mat J. 2009; 28: 290-4.
- Somma F, Cretella G, Carotenuto M, Pecci R, Bedini R, De Biasi M, et al. Qualità delle otturazioni radicolari termoplastificate e a punto singolo valutate tramite micro-tomografia computerizzata. Int Endod J. 2011; 44: 362-9.
- Marciano MA, Ordinola-Zapata R, Cunha TVRN, Duarte MAH, Cavenago BC, Garcia RB, et al. Analisi di quattro tecniche di guttaperca utilizzate per riempire i canali radicolari mesiali dei molari mandibolari. Int Endod J. 2011; 44: 321-9.
- Gordon MPJ, Love RM, Chandler NP. Un'analisi dei coni di guttaperca a punta conica .06 per il riempimento di canali radicolari curvi preparati a .06. Int Endod J. 2005; 38: 87-96.
- Machado MEL, Sapia LAB, Cai S, Martins GHR, Nabeshima CK. Confronto di due sistemi rotanti nella preparazione dei canali radicolari riguardo alla disinfezione. J Endod. 2010; 36: 1238-40.
- Araquam KR, Britto MLB, Nabeshima CK. Confronto di due tecniche di otturazione a cono singolo. Endo (Lond Engl). 2011; 5: 133-7.
- Rechenberg D-K, De-Deus G, Zehnder M. Potenziale errore sistematico negli esperimenti di laboratorio sulla perdita microbica attraverso canali radicolari otturati: revisione degli articoli pubblicati. Int Endod J. 2011; 44: 183-94.
- Gilhooly RMP, Hayes SJ, Bryant ST, Dummer PMH. Confronto tra condensazione laterale e guttaperca a fase α riscaldata termomeccanicamente con un cono singolo per otturare canali radicolari curvi. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001; 91: 89-94.
- Zmener O, Pameijer CH, Macri E. Valutazione del sigillo apicale in canali radicolari preparati con un nuovo sistema rotante e otturati con un sigillante endodontico a base di metacrilato: uno studio in vitro. J Endod. 2005; 31: 392-5.
- Machado R, Silva Neto UX, Ignácio SA, Cunha RS. Mancanza di correlazione tra limiti di otturazione e perdita apicale. Braz Oral Res. 2013; 27: 331-5.
- Monticelli F, Sword J, Martin RL, Schuster GS, Weller RN, Ferrari M, Pashley DH, Tay FR. Proprietà di sigillatura di due sistemi di otturazione a cono singolo contemporanei. Int Endod J. 2007; 40: 374-85.
- Vasconcelos BC, Bernardes RA, Duarte MAH, Bramante CM, Moraes IG. Sigillatura apicale delle otturazioni radicolari eseguite con cinque diversi sigillanti endodontici: analisi tramite filtrazione di fluidi. J Appl Oral Sci. 2011; 19: 324-8.
- Jacobson HLJ, Xia T, Braumgartner JC, Marshall G, Beeler WJ. Valutazione della perdita microbica della continua onda di condensazione. J Endod. 2002; 28: 269-71.
- De-Deus G, Murad CF, Reis CM, Gurgel-Filho E, Coutinho Filho T. Analisi della capacità di sigillatura di diverse tecniche di otturazione in canali di forma ovale: uno studio utilizzando un modello di perdita batterica. Braz Oral Res. 2006; 20: 64-9.
- Yücel AÇ, Çiftçi A. Effetti di diverse tecniche di otturazione dei canali radicolari sulla penetrazione batterica. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006; 102: e88-92.
- Baumgartner G, Zehnder M, Paqué F. Perdita di ceppi tipo Enterococcus faecalis attraverso canali radicolari riempiti con guttaperca/AH Plus o Resilon/ Epiphany. J Endod. 2007; 33: 45-7.
- Monticelli F, Sadek FT, Schuster GS, Volkmann KR, Looney SW, Ferrari M, et al. Efficacia di due tecniche di riempimento a cono singolo contemporanee nel prevenire la perdita batterica. J Endod. 2007; 33: 310-3.
- Tådemir T, Er K, Yildirim T, Buruk K, Çelik D, Cora S, et al. Confronto della capacità di sigillatura di tre tecniche di riempimento in canali modellati con due diversi sistemi rotanti: uno studio sulla perdita batterica. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009; 108: e129-34.
- Nawal RR, Parande M, Sehgal R, Rao NR, Naik A. Una valutazione comparativa di 3 sistemi di riempimento dei canali radicolari. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2011; 111: 387-93.
- Kangarlou A, Dianat O, Esfahrood ZR, Asharaf H, Zandi B, Eslami G. Perdita batterica di canali radicolari riempiti con GuttaFlow rispetto a canali riempiti con Reasilon/ Epiphany e guttaperca/AH26. Aust Endod J. 2012; 38: 10-3.
- De-Deus G, Murad C, Paciornik S, Reis CM, Coutinho-Filho T. L'effetto dell'area riempita del canale sulla perdita batterica di canali di forma ovale. Int Endod J. 2008; 41: 183-90.
- Sedgley CM, Lennan SL, Appelbe OK. Sopravvivenza di Enterococcus faecalis in canali radicolari ex vivo. Int Endod J. 2005; 38: 735-42.
- Gomes BPFA, Pinheiro ET, Jacinto RC, Zaia AA, Ferraz CCR, Souza-Filho FJ. Analisi microbica dei canali di denti riempiti con periapicali utilizzando la Reazione a Catena della Polimerasi. J Endod. 2008; 34: 537-40.
- Siqueira Jr JF, Rôças IN, Alves FRF, Campos LC. Stato periradicolare relativo alla qualità delle restaurazioni coronali e delle otturazioni dei canali radicolari in una popolazione brasiliana. Oral Surg Oral Med Oral Pathol Oral radiol Endod. 2005; 100: 369-74.
