Morfologia dell'aedeago come marcatore discriminante in due specie cactofile strettamente correlate di Drosophila (Diptera; Drosophilidae) in Sud America
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract
Drosophila serido e D. antonietae sono specie sorelle appartenenti al gruppo Drosophila buzzatii. Morfologicamente, possono essere discriminate solo da tratti quantitativi. In questo articolo analizziamo la lunghezza e la curvatura media equalizzata di quattro regioni dell'aedeago di D. antonietae e D. serido. I campioni di D. serido e D. antonietae sono stati classificati correttamente nel 96,74% dei casi. Basandoci solo sulla variabile che ha maggiormente contribuito alla discriminazione dei gruppi (curvatura media equalizzata dell'arco IV dell'aedeago), abbiamo osservato una significativa divergenza morfologica intraspecifica in D. serido rispetto a D. antonietae, in accordo con altri marcatori. L'alta divergenza morfologica nella curvatura media equalizzata dell'arco IV dell'aedeago mostra che questa regione è evoluta più rapidamente di altre, dalla divergenza delle due specie. L'importanza del presente studio per la comprensione della base genetica che controlla la formazione dell'aedeago, nelle specie del gruppo Drosophila buzzatii, è discussa.
Introduzione
I caratteri morfologici sono stati storicamente utilizzati negli studi evolutivi e tassonomici. Tuttavia, la mancanza di differenze morfologiche qualitative tra specie sorelle rende difficile stabilire le caratteristiche morfologiche diagnostiche tra di esse. In molti casi, le variazioni quantitative dei tratti morfometrici sono sufficienti per la discriminazione delle specie sorelle (Moreteau et al. 2003, Moraes et al. 2004).
La morfologia dell'aedeago (genitali maschili esterni) è di estrema importanza nella caratterizzazione tassonomica delle specie di Drosophila (Vilela 1983, Silva e Sene 1991, Liu et al. 1996, Moreteau et al. 2003, Kullikov et al. 2004), così come in altri Ditteri. Le variazioni quantitative nelle caratteristiche morfologiche dell'aedeago sono state utilizzate anche per la discriminazione delle specie sorelle di Drosophila (Silva e Sene 1991, Kullikov et al. 2004). Nel gruppo Drosophila repleta , che include più di 90 specie neotropicali, la maggior parte è considerata specie sorelle. Tuttavia, esiste una marcata differenza nella forma degli aedeagi (forma + dimensione) tra di esse, che è considerata il principale carattere diagnostico del gruppo (Vilela 1983).
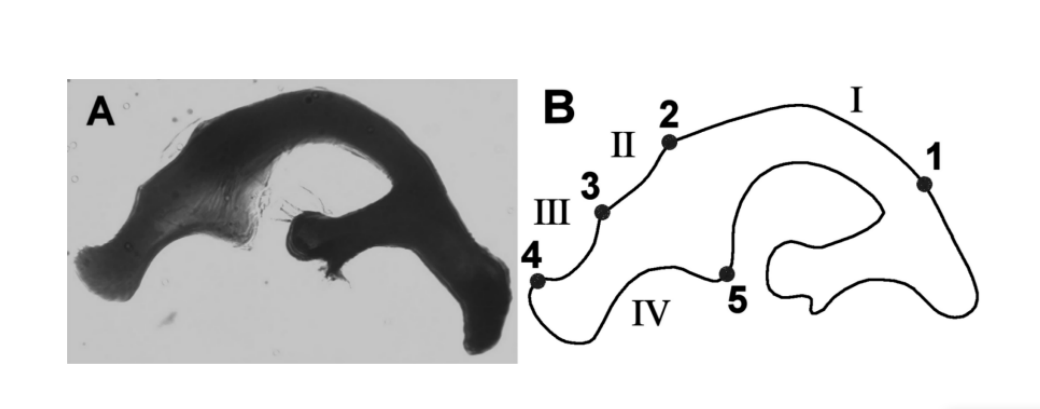
Il Drosophila buzzatii cluster (repleta gruppo, mulleri sottogruppo, buzzatii complesso) è un gruppo monofiletico formato da sette specie sorelle cactofile: D. buzzatii, D. borborema, D. koepferae, D. antonietae, D. gouveai, D. serido e D. seriema. In questo cluster, le differenze quantitative delle caratteristiche morfologiche dell'ala (Moraes et al. 2004) e dei genitali maschili (Silva e Sene 1991, Tidon-Sklorz e Sene 1995, Prado et al. 2004) sono state utilizzate con successo per la discriminazione delle specie e delle popolazioni. Tra le sette specie di questo cluster, D. buzzatii e D. borborema presentano aedeagi che sono diversi per forma e dimensione rispetto alle altre specie (Tidon-Sklorz e Sene 1995). Tuttavia, la morfologia dell'aedeagus delle altre specie del cluster è simile al cosiddetto tipo di aedeagus D. serido (Figura 1a) e basandosi su questa osservazione, queste specie sono state inizialmente classificate come appartenenti alla stessa specie (Vilela e Sene 1977). Per studiare l'aedeagus di queste specie, Silva e Sene (1991) lo hanno diviso in quattro regioni principali delimitate da punti di riferimento (Figura 1b). Ogni regione delimitata da due punti di riferimento adiacenti è stata denominata arco. Basandosi sulla lunghezza degli archi, i ricercatori hanno identificato cinque diversi tipi di aedeagus, denominati da A a E, specifici per ciascuna specie.
Drosophila serido e D. antonietae sono due specie sorelle appartenenti al cluster Drosophila buzzatii analizzato in questo studio. D. antonietae si trova nelle foreste mesofile delle regioni del bacino Paraná-Paraguay, in Sud America, associata al cactus Cereus hildemannianus (Tidon-Sklorz e Sene 2001). D. serido è presente nella Caatinga nord-orientale e sulla costa atlantica del Brasile, dal Nord-est alla regione meridionale del Brasile, associata a una serie di generi di cactus (Pereira et al. 1983). Al limite meridionale della distribuzione di D. serido, c'è un'area di contatto con D. antonietae (A.C. Morales et al., dati non pubblicati). Anche se D. serido e D. antonietae presentano piastre metafasiche distinte (Baimai et al. 1983), schemi alloenzimatici (A.C. Morales et al., dati non pubblicati, Mateus e Sene 2003), haplotipo mitocondriale (Manfrin et al. 2001) e DNA satellitare (Kuhn e Sene 2005), condividono la stessa inversione cromosomica fissa 2x7 (Ruiz et al. 2000), che può indicare una stretta relazione filogenetica. In termini morfologici, solo variazioni quantitative possono discriminare queste due specie (Silva e Sene 1991, Moraes et al. 2004).
In questo articolo, sono stati analizzati i caratteri morfometrici dell'aedeago di esemplari di D. antonietae provenienti da diverse popolazioni, coprendo tutta la distribuzione conosciuta della specie, e di esemplari di D. serido provenienti da due diverse popolazioni. Abbiamo scelto queste specie perché possono essere differenziate attraverso marcatori genetici e, presentando un'area di contatto secondaria, con una popolazione in simpatria, con possibile formazione di ibridi nella regione meridionale del Brasile. Oltre alle misurazioni della lunghezza dell'arco dell'aedeago, già utilizzate in Silva e Sene (1991), sono state utilizzate anche misurazioni della curvatura di questi archi (Prado et al. 2004). I nostri obiettivi principali erano introdurre e testare l'uso delle misure di curvatura nelle specie del gruppo Drosophila buzzatii e determinare le regioni dell'aedeago che hanno maggiormente contribuito alla discriminazione delle specie D. serido e D. antonietae. I dati discussi qui evidenziano l'importanza di queste regioni dell'aedeago per future ricerche al fine di comprendere la base genetica dell'aedeago delle specie appartenenti al gruppo Drosophila buzzatii, così come per studi dell'area di contatto tra le due specie.
Materiali e metodi
Campioni
Sono stati analizzati cinquantotto aedeagi della specie D. antonietae provenienti da diverse popolazioni, rappresentando l'intera distribuzione, e 34 aedeagi di D. serido, appartenenti a popolazioni situate a Junco do Seridó/PB e Milagres/BA (localizzazione tipo) (Tabella I). Tutti gli individui analizzati sono stati raccolti in ambienti naturali (mosche catturate in natura). Gli aedeagi sono stati preparati in sezioni per la microscopia ottica secondo Kaneshiro (1969). Tutti gli aedeagi utilizzati in questo articolo sono stati depositati nel Laboratorio di Genetica Evolutiva presso l'USP – Ribeirão Preto. Le immagini degli aedeagi sono state ingrandite 200X e digitalizzate da un microscopio (Axioplan2 Zeiss) dotato del sistema di acquisizione di immagini digitali Axiovision Zeiss e memorizzate su un computer.
Misurazione e Analisi Statistica
Cinque punti sono stati definiti manualmente come punti di riferimento, secondo Silva e Sene (1991). I punti di riferimento sono stati utilizzati per stabilire i contorni interni della regione in studio; le regioni tra due punti di riferimento adiacenti sono gli archi (Figura 1b).
Come in Silva e Sene (1991), sono state misurate le lunghezze degli archi I, II, III e IV dell'aedeago (Tabella II). Questa misura rappresenta la distanza accumulata tra i punti di riferimento consecutivi. Oltre a questo, abbiamo anche eseguito misure normalizzate della curvatura degli archi. In breve, la curvatura continua è una misura geometrica che esprime il tasso di cambiamento dell'angolo tra la tangente della curva e l'asse x (Costa et al. 2004). I valori della curvatura normalizzata sono generati attraverso la standardizzazione tramite una sigmoide della curvatura continua per amplificare i punti di bassa curvatura della regione di interesse (Costa e Cesar 2000). Questa fase consente di massimizzare le informazioni sulla curvatura della struttura analizzata. Per eseguire le analisi, abbiamo utilizzato le medie delle curvature normalizzate degli archi I, II, III e IV dell'aedeago (Tabella II). Le misure sono state ottenute in conformità con la metodologia descritta da Prado et al. (2004).
Abbiamo eseguito tre distinte analisi discriminanti, utilizzando esclusivamente le misure della lunghezza dell'arco (discriminante I) e la curvatura media equalizzata (discriminante II) e un'analisi discriminante utilizzando tutte le misure insieme (discriminante III). Queste analisi sono state eseguite per ottenere percentuali corrette di classificazione degli individui, per verificare quali variabili contribuissero maggiormente alla discriminazione dei gruppi e per confrontare l'uso delle misure di curvatura utilizzate con le misure della lunghezza dell'arco, precedentemente eseguite da Silva e Sene (1991). I valori più bassi del lambda di Wilk (che variano da 0 a 1) indicano una migliore analisi. Oltre a questo, con i dati dell'analisi discriminante III, è stata eseguita un'analisi delle variabili canoniche. L'analisi delle variabili discriminanti e canoniche è stata eseguita con l'uso del software Splus (versione 1.8).
Il valore assoluto dei coefficienti standardizzati canonici, generati dall'analisi delle variabili canoniche, rappresenta il peso di ciascuna variabile nella formazione della radice canonica, dove valori più alti corrispondono a una maggiore differenziazione tra i gruppi. Questi coefficienti saranno presentati per mostrare il contributo relativo di ciascuna variabile nella formazione della radice canonica ottenuta e per determinare quale variabile sia la più importante per la discriminazione dei gruppi.
Oltre all'analisi multivariata, la misura più importante per la discriminazione delle specie è stata utilizzata singolarmente al fine di ottenere la percentuale corretta di classificazione degli individui attraverso il metodo di classificazione bayesiano (Duda et al. 2000). A tal fine, sono state stabilite curve normali a partire dalla media e dalla deviazione standard di ciascun gruppo in relazione alla variabile, definendo la densità della funzione e la probabilità utilizzate nell'analisi bayesiana.
Risultati
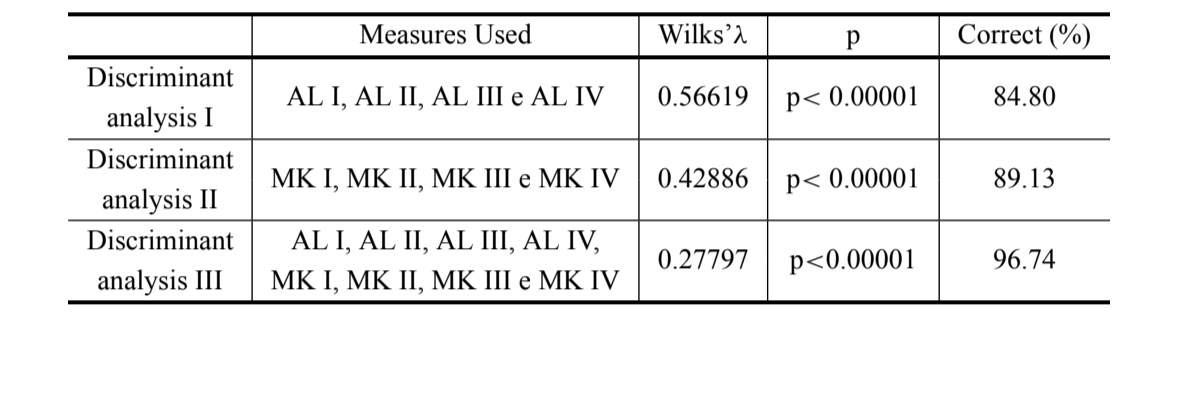
I risultati delle tre analisi discriminanti effettuate sono mostrati nella Tabella III. La discriminazione tra D. antonietae e D. serido è maggiore quando si utilizzano le lunghezze dell'arco dell'aedeago insieme alle misure di curvatura (discriminante III) (λ di Wilks = 0.27797; p<0.00001), dove il 96.74% degli individui è classificato correttamente (Tabella III), la classificazione corretta di D. antonietae è del 98.30% e quella di D. serido è del 94.10%.
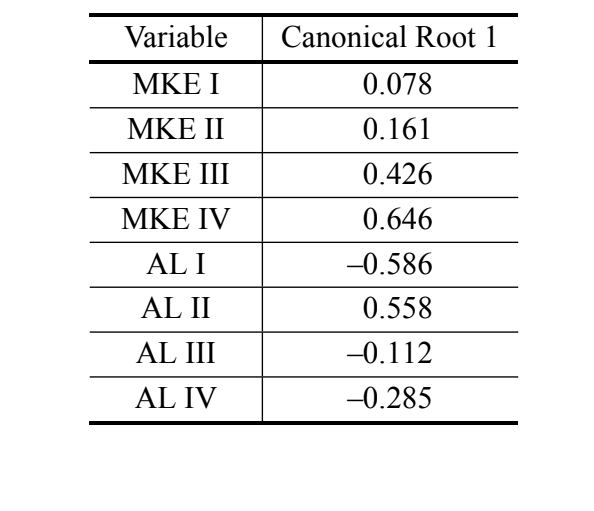
È stato ottenuto un solo asse canonico nell'analisi delle variabili canoniche utilizzando le misure dell'analisi discriminante III. I coefficienti canonici standardizzati (il peso di ciascuna variabile) sono mostrati nella Tabella IV. I valori assoluti di questi coefficienti indicano che la variabile più importante per la formazione della radice canonica era MKE IV, mentre la meno importante era la variabile MKE I. Le curve normali ottenute dalla media e dalla deviazione standard dei due gruppi in relazione ai punteggi canonici sono mostrate nella Figura 2, in cui possiamo osservare la discriminazione tra D. antonietae (punteggi canonici più alti) e D. serido (punteggi canonici più bassi).
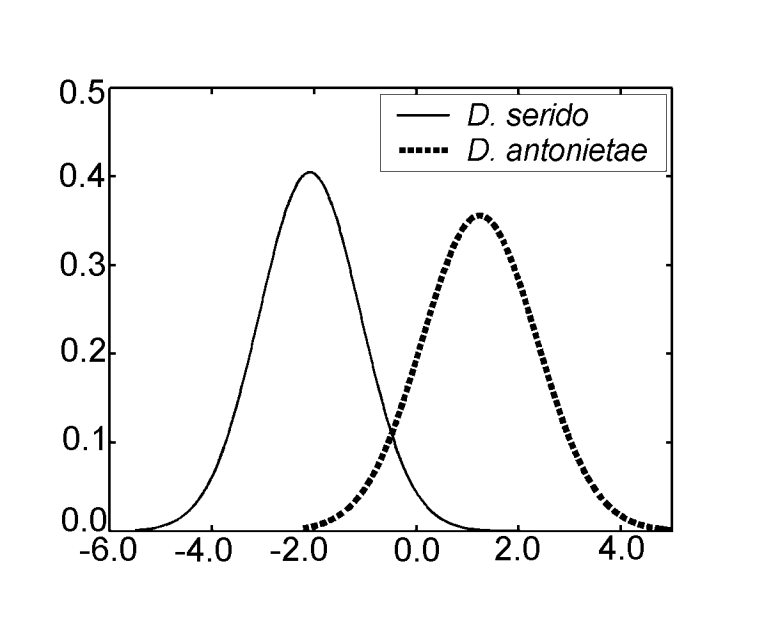
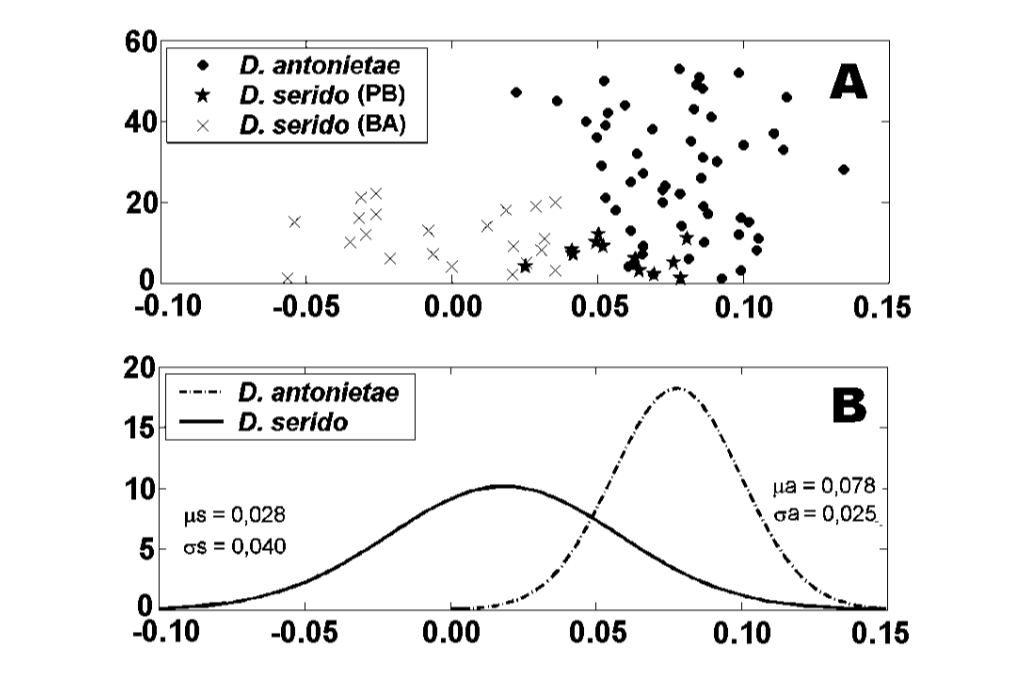
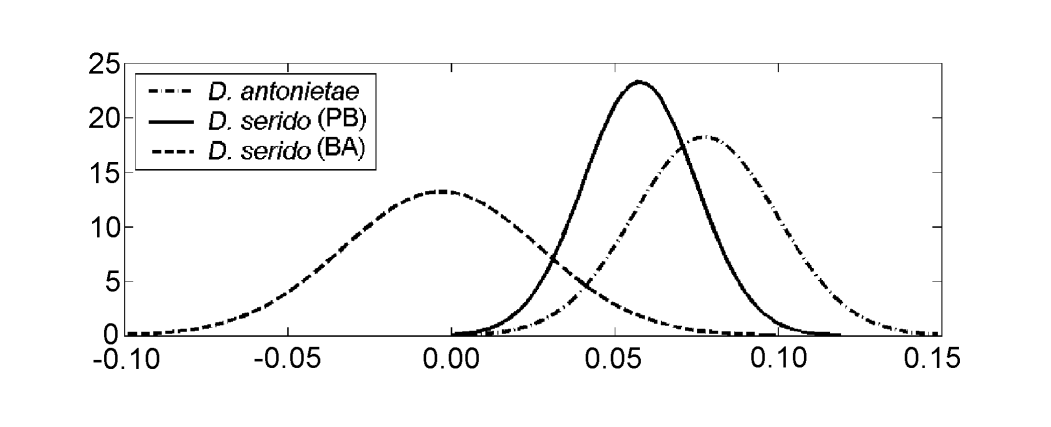
I valori per ciascun individuo ottenuti dall'analisi di MKE IV sono mostrati nella Figura 3a. In relazione a questa misura, D. serido ha una maggiore variazione attorno alla media (deviazione standard = 0.04) rispetto a D. antonietae (deviazione standard = 0.025) (Figura 3b), principalmente perché ci sono differenze significative in relazione a questa misura tra le due popolazioni che compongono il campione di D. serido (Figura 3a; Figura 4).
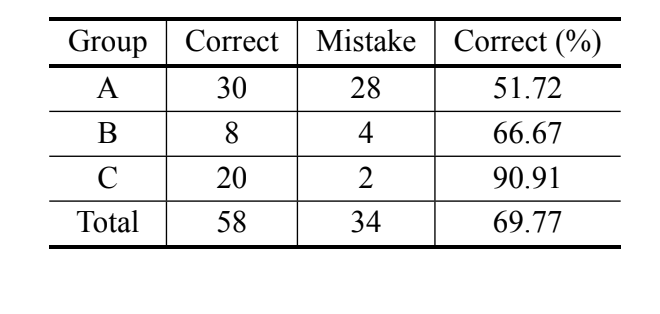
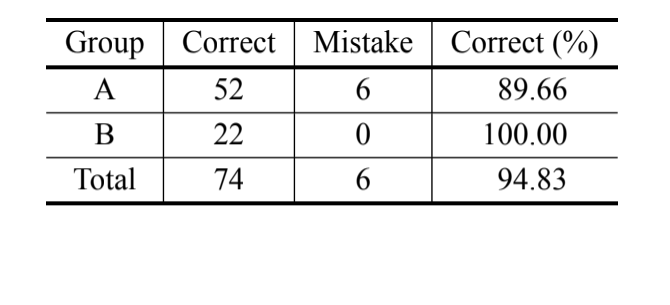
In conformità con l'analisi bayesiana, basata solo sulla misura MKE IV, il 69,8% degli individui è stato classificato correttamente e oltre il 90% degli individui di D. serido di Milagres/BA è stato classificato correttamente. Tuttavia, è stata osservata una percentuale elevata di errori negli individui di D. serido di Junco do Seridó/PB e
D. antonietae (Tabella V). La stessa analisi è stata eseguita senza gli individui di D. serido di Junco do Seridó/PB e la percentuale di classificazioni corrette è stata del 94,83% (Tabella VI), mostrando un'estrema divergenza tra gli individui della popolazione di D. serido di Milagres/BA e D. antonietae basata su MKE IV.
Discussione
I nostri dati confermano l'esistenza di differenze quantitative nelle caratteristiche morfologiche dell'aedeago degli individui analizzati, rendendo possibile la discriminazione di D. serido da D. antonietae. Inoltre, la curvatura media equalizzata dell'arco IV (MKE IV) è stata la variabile che ha maggiormente contribuito alla discriminazione dei gruppi (Tabella IV).
La lunghezza dei primi quattro archi dell'aedeago era già stata utilizzata con successo nella discriminazione delle specie del cluster Drosophila buzzatii, tra cui D. serido e D. antonietae (aedeago Tipo A e D, rispettivamente in Silva e Sene 1991). In questo articolo abbiamo riscontrato un notevole aumento nella discriminazione dei gruppi aggiungendo misure di curvatura media equalizzata nell'analisi morfometrica, dove il 96,74% degli individui sono correttamente classificati (Tabella III). Pertanto, le misurazioni della curvatura media equalizzata sono importanti per la discriminazione di D. antonietae e D. serido e potrebbero essere utili nello studio di una zona di simpatria tra queste specie nella regione meridionale del Brasile. Poiché le misure di curvatura non tengono conto delle dimensioni della struttura, è possibile inferire che piccole alterazioni quantitative nella forma dell'aedeago, specialmente nella regione dell'arco IV, potrebbero essere avvenute dall'evento di cladogenesi delle specie D. serido e D. antonietae.
Esiste una significativa divergenza morfologica in relazione a MKE IV tra D. antonietae e D. serido, poiché D. antonietae mostra relativamente meno variazione attorno alla media rispetto a D. serido (Figura 3b). Sono stati analizzati individui provenienti da diverse popolazioni, che rappresentano l'intera area di distribuzione delle popolazioni di D. antonietae (Tabella I); in questo campione, i dati suggeriscono che c'è omogeneità tra le popolazioni di D. antonietae . Monteiro e Sene (1995) hanno analizzato la morfologia dell'aedeagus di individui provenienti da diverse popolazioni di
D. antonietae attraverso il metodo morfometrico della rete truss e non hanno osservato differenze morfologiche tra di esse. I pattern alloenzimatici (Mateus e Sene 2003) e dei microsatelliti (L.P.B. Machado et al., dati non pubblicati) hanno mostrato anch'essi omogeneità tra le diverse popolazioni di D. antonietae. Questi risultati suggeriscono un flusso genico tra le popolazioni di D. antonietae, favorito dall'associazione di questa specie e del suo cactus ospite, Cereus hildmaniannus che si trova nelle foreste galleggianti mesofile lungo i fiumi del bacino Paraná-Paraguay, che formano corridoi di migrazione per gli individui della specie D. antonietae (Monteiro e Sene 1995).
Drosophila serido ha, comparativamente, una maggiore variazione interspecifica in relazione a MKE IV rispetto a D. antonietae (Figura 3b), come si può osservare nelle differenze riscontrate tra gli individui delle popolazioni di Junco do Seridó/PB e Milagres/BA. Gli individui di D. serido della popolazione di Junco do Seridó/PB hanno valori intermedi per MKE IV rispetto a quelli trovati per le popolazioni di D. serido a Milagres/BA e le popolazioni di D. antonietae analizzate (Figura 4). Questi dati suggeriscono una differenziazione morfologica tra entrambe le popolazioni di D. serido, probabilmente a causa della restrizione del flusso genico tra di esse. C'è un grande fiume tra gli stati brasiliani di Bahia e Pernambuco, il fiume São Francisco, che potrebbe agire come una barriera geografica, impedendo il flusso genico tra le popolazioni di D. serido analizzate in questo articolo. Le divergenze morfologiche tra le popolazioni di D. serido sono in accordo con altri lavori, essendo questa specie polimorfa rispetto ad altri marcatori. Le popolazioni nord-orientali di D. serido hanno piastre metafasiche di Tipo I, mentre alcune popolazioni costiere hanno piastre metafasiche di Tipo III (Arraial do Cabo/RJ) e Tipo IV (Peruíbe/SP) (Baimai et al. 1983). Per quanto riguarda le inversioni cromosomiche, sebbene tutte le popolazioni di D. serido condividano l'inversione fissa 2x7, quattro inversioni polimorfiche sono ristrette alle popolazioni nord-orientali (2a8, 2b8, 2c8 e 2d8) e due inversioni fisse (2x8 e 2w8) si verificano nelle popolazioni costiere (Tosi e Sene 1989, Ruiz et al. 2000). Inoltre, le popolazioni di D. serido del Brasile nord-orientale sono parzialmente isolate riproduttivamente dalla popolazione di Arraial do Cabo/RJ lungo la costa brasiliana (N.M.V. Bizzo, dati non pubblicati). Studi recenti suggeriscono anche una discriminazione tra le popolazioni di D. serido nel nord-est e nel Brasile costiero basata sulla differenziazione degli haplotipi mitocondriali (A.C. Morales et al., dati non pubblicati).
La differenziazione tra popolazioni della stessa specie è un requisito importante nel processo di speciazione, pertanto, studi che coinvolgono una varietà di popolazioni di una specie polimorfa, come D. serido, sono importanti per quantificare la divergenza morfologica in relazione alla divergenza genetica nelle popolazioni naturali.
Non tutti gli archi dell'aedeago sono ugualmente informativi nella discriminazione delle specie. Secondo Silva e Sene (1991), gli archi II e III (Figura 1) sono i più informativi per la discriminazione delle specie nel cluster di Drosophila buzzatii. In confronto, coppia per coppia, utilizzando il metodo della rete a truss, le misure relative all'arco III sono state le più significative nella discriminazione tra
D. antonietae e D. gouveai (Monteiro e Sene 1995). Attraverso l'analisi della morfometria geometrica utilizzando le misure di curvatura, Prado et al. (2004) hanno osservato che la curvatura e la lunghezza normalizzata dell'arco III sono misure importanti nella discriminazione tra le specie D. gouveai e D. antonietae. I nostri dati mostrano che l'MKE IV è il più importante nella discriminazione delle specie D. serido e D. antonietae; e basandosi esclusivamente su questa misura, è possibile discriminare oltre il 94% degli individui di D. serido dalla popolazione di Milagres/BA (localizzazione tipo) rispetto a quelli di D. antonietae (Tabella VI). Questi risultati mostrano che la porzione distale dell'aedeago (arco III + arco IV) presenta le maggiori differenze interspecifiche, indipendentemente da altre parti di questo organo, suggerendo che questa regione può essere considerata un "punto evolutivo caldo" (Kullikov et al. 2004) per l'aedeago durante eventi di cladogenesi nel cluster di Drosophila buzzatii, ma questa questione rimane ancora aperta alla discussione.
Le variazioni morfometriche tra e all'interno dei gruppi di organismi riflettono l'espressione di un fenotipo risultante da un controllo poligenico integrato, che viene alterato durante le cladogenesi e l'evoluzione dei gruppi (Falconer 1989). Inoltre, diversi fattori epigenetici e ambientali possono influenzare la formazione di una struttura (Atchley et al. 1992), il che rende difficile identificare le cause della divergenza morfologica tra popolazioni e specie. Tuttavia, gli studi morfometrici comparativi delle regioni omologhe di entrambe le specie, come gli archi dell'aedeago, sono requisiti importanti per la comprensione della base genetica che controlla la formazione di quella regione. Sebbene la base genetica dell'aedeago stia venendo scoperta per altri gruppi di Drosophila (Liu et al. 1996), i geni che controllano la formazione dell'aedeago nelle specie del gruppo Drosophila buzzatii non sono ancora stati stabiliti. L'alto percentuale di correttezza degli individui analizzati in questo articolo, basata esclusivamente sul MKE IV, indica che la regione dell'arco quattro potrebbe essere utile per studi futuri per comprendere la base genetica dell'aedeago in queste specie, poiché stabilire caratteri morfologici informativi tra distinti gruppi tassonomici è un passo preliminare nello studio dei QTL (Quantitative Trait Loci), una metodologia per la rilevazione, mappatura e stima degli effetti di alcuni loci nelle caratteristiche metriche.
Autori: Fernando F. Franco, Pedro R.R. Prado, Fábio M. Sene, Luciano F. Costa e Maura H. Manfrin
Riferimenti
- Atchley WR, Cowley DE, Vogi C e Mc-Lellan T. 1992. Divergenza evolutiva, cambiamento di forma e struttura di correlazione genetica nella mandibola dei roditori. Syst Biol 41: 196–221.
- Baimai V, Sene FM e Pereira MAQR. 1983. Eterocromatina e differenziazione cariotipica di alcune specie neotropicali di cactubreeding del gruppo Drosophila repleta . Genetica 67: 81–92.
- Costa LF e Cesar RMJ. 2000. Analisi della forma e classificazione: teoria e pratica. CRC Press Book Series on Image Processing. Cambridge Univ Press, New York, 659 p.
- Costa LF, dos Reis SF, Arantes RAT, Alves ACR e Multinari G. 2004. Analisi biologica della forma tramite curvatura digitale. Pattern Recognit 37: 515–524.
- Duda RO, Hart PE e Stork DG. 2000. Classificazione dei modelli. J Wiley & Sons, New York, USA, 680 p.
- Falconer DS. 1989. Introduzione alla genetica quantitativa. 2a ed., Londra: Longman.
- Kaneshiro KY. 1969. Uno studio delle relazioni delle specie di Drosophila hawaiane basato sugli organi genitali maschili esterni. Univ Texas Publ 6918: 55–70.
- Kuhn GCS e Sene FM. 2005. Ricambio evolutivo di due sottogruppi di DNA satellitare pBuM nel cluster di specie Drosophila buzzatii (gruppo repleta ): da alpha a alpha/beta array. Gene 349: 77–85.
- Kullikov AM, Melnikov AI, Gornostaev NG, Lazebny OE e Mitrofanov VG. 2004. Analisi morfologica dell'organo di accoppiamento maschile nel gruppo di specie Drosophila virilis : un approccio multivariato. J Zool. Syst Evol Res 42: 135–144.
- Liu J, Mercer JM, Stam LF, Gibson GC, Zeng Zhao-Bang e Laurie CC. 1996. Analisi genetica di una differenza morfologica nella genitalia maschile di Drosophila simulans e D. mauritiana. Genetics 142: 1129–1145.
- Manfrin MH, Brito ROA e Sene FM. 2001. Sistematica ed evoluzione del cluster Drosophila buzzatii (Diptera; Drosophilidade) utilizzando mtDNA. Ann Entomol Soc Am 94: 333–346.
- Mateus RP e Sene FM. 2003. Variazione temporale e spaziale degli allozimi nella Drosophila antonietae cactofila sudamericana (Diptera; Drosophilidae). Biochem Genet 41: 219–233.
- Monteiro SG e Sene FM. 1995. Studio morfometrico delle popolazioni di Drosophila serido delle regioni Centrale e Sud del Brasile. Rev Bras Genet 18 (Suppl.): 283.
- Moraes EM, Spressola VL, Prado PRR, Costa LF e Sene FM. 2004. Divergenza nella morfologia delle ali tra specie sorelle del cluster buzzatii . J Zool Syst Evol Res 42: 154–158.
- Moreteau B, Gibert P, Pétavy G, Moereteau JC, Huey RB e David JR. 2003. Evoluzione morfometrica in un clade di Drosophila : il gruppo Drosophila obscure . J Zool Syst Evol Res 41: 64–71.
- Pereira MAQR, Vilela CR e Sene FM. 1983. Note sui siti di riproduzione e alimentazione di alcune specie del gruppo repleta del genere Drosophila (Diptera; Drosophilidae). Cienc Cult 35: 1313–1319.
- Prado PRP, Franco FF, Manfrin MH, Costa LF e Sene FM. 2004. Un modo facile e veloce per analizzare i caratteri morfometrici. Proc Third Braz Symp Mathem Comp Biol 1: 329–340.
- Ruiz A, Cassian AM, Kuhn GCS, Alves Maqr e Sene FM. 2000. Il puzzle della speciazione di Drosophila serido : mettere insieme nuovi pezzi. Genetica 108: 217–227.
- Silva AFG e Sene FM. 1991. Variabilità geografica morfologica in Drosophila serido (Diptera; Drosophilidae). Rev Bras Entomol 35: 455–468.
- Tidon-Sklorz R e Sene FM. 1995. Evoluzione del buzzatii cluster (gruppo di specie Drosophila repleta) nel centro del Sud America. Evolución Biologica 9: 71–85.
- Tidon-Sklorz R e Sene FM. 2001. Due nuove specie del set di sorelle di Drosophila serido (Diptera; Drosophilidae). Iheringia 90: 141–146.
- Tosi D e Sene FM. 1989. Ulteriori studi sulla variabilità cromosomica nel taxon complesso Drosophila serido (Diptera; Drosophilidae). Rev Bras Genet 12: 729–745.
- Vilela CR. 1983. Una revisione del gruppo di specie Drosophila repleta (Diptera; Drosophilidae). Rev Bras Entomol 27: 1–114.
- Vilela CR e Sene FM. 1977. Due nuove specie neotropicali del gruppo repleta del genere Drosophila (Diptera; Drosophilidae). Papéis Avulsos de Zoologia 30: 295–299.
