Efficacia del fibrinogeno ricco di piastrine al silicio e dell'osso autologo nella rigenerazione ossea in difetti calvariali di coniglio: uno studio radiologico e istologico.
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract: La riparazione dei difetti ossei in Chirurgia Orale richiede spesso l'uso di tecniche di rigenerazione ossea. Il silicio è un elemento che è stato impiegato come materiale di rigenerazione in diversi studi. Nel nostro studio, il silicio è stato combinato con osso autologo e membrane di fibrina ricca di piastrine (PRF) per analizzare il comportamento di questo elemento nella rigenerazione ossea. Sono stati creati quattro difetti circonferenziali nel cranio di 5 conigli della Nuova Zelanda. Gli elementi seguenti sono stati applicati alla rigenerazione dei difetti: (P): PRF; (S): silicio e (B): osso autologo, con la seguente distribuzione dei gruppi di studio: Gruppo 1 (PSB); Gruppo 2 (PS); Gruppo 3 (SB) e Gruppo 4 (CONTROL): gruppo non rigenerato. Gli animali sono stati sacrificati dopo 3 settimane. Sono stati effettuati studi di microtomografia computerizzata (μ-CT), così come quelli istomorfometrici. È stato utilizzato il test statistico ANOVA con un test post-hoc di Bonferroni per confrontare i risultati (p≤ 0.05). Radiologicamente, i gruppi PSB e SB sono risultati migliori per quanto riguarda la quantità e la percentuale di osso sano osservato, ma non in modo significativo rispetto al gruppo di controllo. Il gruppo PS è risultato significativamente peggiore. Il test istologico ha rivelato che il gruppo PSB era quello che presentava la maggiore area, percentuale e perimetro di osso mineralizzato. Nella valutazione dell'osso in formazione (osteoid), non è stata osservata alcuna differenza tra i gruppi, ad eccezione del perimetro osseo, dove il gruppo SB era significativamente migliore. La variabile altezza ossea non ha mostrato differenze significative. In conclusione, possiamo affermare che la combinazione di PRF, osso autologo e silicio fornisce buoni risultati dopo 3 settimane, mentre il gruppo PS mostra i risultati peggiori. Questo evidenzia l'importanza dell'osso autologo come parte del materiale di innesto affinché l'osso possa mineralizzarsi.
Introduzione
I difetti ossei nella Chirurgia Orale sono comuni e a volte difficili da riparare, richiedendo tecniche di rigenerazione ossea per garantire il successo del trattamento restaurativo. La ricerca scientifica continua a fare progressi nella comprensione dei processi biologici e fisiologici coinvolti nella guarigione, rigenerazione e rimodellamento osseo. In vivo l'ingegneria tissutale copre la rigenerazione e la ricostruzione di tessuti e organi nel corpo stesso. La premessa di base è che la manipolazione controllata del microambiente extracellulare può portare a controllare la capacità delle cellule di organizzarsi, crescere, differenziarsi e formare una matrice extracellulare funzionante e infine nuovo tessuto funzionale.
Le tecniche rigenerative sono diventate procedure di routine e con risultati clinici comprovati, ma la loro prevedibilità e il tempo di attesa sono ancora alcuni dei fattori che spingono a continuare a indagare lo sviluppo di materiali nuovi e migliorati per la rigenerazione ossea. L'osso autologo e il plasma ricco di piastrine sono due materiali ampiamente utilizzati nel campo dell'implantologia per rigenerare tessuti molli e duri. Tuttavia, un materiale che combini tutti i vantaggi di ciascuno di essi separatamente non è ancora stato sviluppato.
L'uso di osso autologo è ampiamente descritto nella letteratura poiché è considerato il gold standard per la rigenerazione ossea. Tuttavia, nonostante abbia eccellenti proprietà biologiche di osteoinduzione, osteoconduzione e osteogenesi, l'autoinnesto presenta una morbidità considerevole e un tasso di riassorbimento elevato e imprevedibile, ma ha dimostrato che il suo comportamento migliora in combinazione con altri sostituti ossei, ottenendo un volume più abbondante e consistente nel tempo e una guarigione ossea più rapida.
Insieme all'osso autologo, i derivati del sangue ricchi di piastrine sono anche frequentemente utilizzati nella rigenerazione dei tessuti. Tra questi derivati c'è il fibrina ricca di piastrine [PRF]. È un biomateriale rigenerativo ampiamente utilizzato in varie applicazioni mediche. Inoltre, ha guadagnato maggiore popolarità rispetto al plasma ricco di piastrine [PRP] perché è una tecnica a un solo passaggio a cui non è necessario aggiungere sostanze chimiche. Un altro vantaggio è il rilascio graduale maggiore di fattori di crescita nel tempo. Una singola membrana di fibrina contiene una grande quantità di fattori di crescita e citochine coinvolti nella rigenerazione ossea e nella maturazione dei tessuti molli. È un biomateriale facilmente manipolabile che in Chirurgia Orale viene applicato nella terapia parodontale, nella preservazione alveolare, nelle procedure di aumento osseo chirurgico e, in combinazione con innesti ossei, nella chirurgia di elevazione del seno mascellare. La sua ultima applicazione, ancora non testata clinicamente, è come decontaminante per superfici in titanio ruvide grazie alle sue proprietà antimicrobiche.
Infine, ci sono diverse pubblicazioni che affermano che ioni bioinorganici come zinco, manganese, magnesio o silicio sono essenziali nel metabolismo osseo. Il silicio è il secondo elemento più abbondante nella crosta terrestre e nel corpo umano si trova principalmente nelle aree di mineralizzazione e crescita ossea. Svolge un ruolo vitale nella biologia delle ossa e dei tessuti connettivi, e sebbene il suo meccanismo d'azione non sia esattamente compreso, grazie alla ricerca di Carlisle e Schwarz si sa che agisce producendo una maggiore mineralizzazione sulla matrice ossea attraverso la sintesi e la stabilizzazione del legame incrociato delle fibre di collagene. Il silicio è un fattore iniziale nella mineralizzazione ossea poiché è presente in elevate concentrazioni nella matrice osteoide dell'osso immaturo e, man mano che l'osso matura, la concentrazione di silicio diminuisce a causa della concentrazione di calcio. È stato utilizzato nel corso degli anni come materiale rigenerativo osseo sotto forma di rivestimento per impianti dentali ed è stato anche incorporato in biomateriali ceramici [idrossiapatite, fosfato tricalcico o ceramiche vetrose] fornendo buoni risultati riguardo alla rigenerazione ossea in studi in vitro e in vivo. Questo buon comportamento è dovuto al suo forte legame. Il silicio è stato impiegato insieme ad altri biomateriali come ceramiche vetrose o apatite o con fosfato tricalcico [TCP] per migliorare le proprietà biologiche dei materiali con cui si lega. Tuttavia, per quanto ne sappiamo, non ci sono studi con osso a causa della formazione di uno strato biologicamente attivo, simile all'apatite, sulla sua superficie.
Il silicio è stato impiegato insieme ad altri biomateriali come ceramiche di vetro o apatite o con fosfato tricalcico [TCP] per migliorare le proprietà biologiche dei materiali con cui si lega. Tuttavia, per quanto ne sappiamo, non sono stati trovati studi sull'uso del silicio in combinazione con osso autologo o con membrane di fibrina ricca di piastrine per l'uso nella rigenerazione ossea.
Nel nostro studio, il silicio è stato combinato con osso autologo e membrane PRF al fine di analizzare il ruolo di questo elemento nella rigenerazione ossea quando combinato con altri biomateriali ampiamente utilizzati. L'obiettivo principale era valutare la rigenerazione ossea ottenuta nei diversi gruppi analizzati (questi sono (P): PRF; (S): silicio e (B): osso autologo, con una distribuzione del gruppo di studio come segue: Gruppo 1 (PSB); Gruppo 2 (PS); Gruppo 3 (SB) e Gruppo 4 (CONTROL): gruppo non rigenerato) per un periodo di 3 settimane in un modello di test animale.
Materiali e Metodi
Campioni di animali da test
Lo studio sperimentale è stato condotto sull'osso parietale di 5 conigli di laboratorio della Nuova Zelanda di 6 mesi e dal peso compreso tra 3,5 e 4 kg. Gli animali sono stati alimentati quotidianamente (ad libitum) con una dieta per animali da laboratorio utilizzando Harlan-Teklad (2030). Gli animali sono stati sottoposti a intervento chirurgico in anestesia generale presso il Centro Chirurgico Minimale Jesús Usón, [Cáceres, Extremadura, Spagna]. L'esperimento è stato condotto in conformità con le linee guida dell'Istituto Nazionale della Salute spagnolo (NIH) e la Direttiva Europea 86/609/EEC sulla cura e l'uso degli animali da esperimento. Lo studio ha anche rispettato la Direttiva Europea 2010/63/EU sulla protezione degli animali utilizzati per scopi sperimentali e tutte le leggi e regolamenti locali. I ricercatori hanno ottenuto l'approvazione del Comitato Etico dell'Istituzione (CCMI-Ref 028/16). L'identificazione degli animali che compongono i gruppi da valutare è stata effettuata utilizzando un chip. Durante il periodo sperimentale, i campioni sono stati tenuti in gabbie individuali.
Procedura chirurgica
Prima di iniziare la procedura chirurgica, è stata effettuata l'immobilizzazione dei conigli e sono stati registrati i loro segni vitali. Gli anestetici impiegati sono stati il midazolam endovenoso (0,25 mg / kg) e il propofol (5 mg / kg) e il gas sevoflurano inalato al 2,8%. Sono stati utilizzati due analgesici: tramadolo (3 mg / kg) e ketorolac (1,5 mg / kg). Dopo la sedazione, è stato prelevato un campione di sangue retro-orbitale da ciascun coniglio utilizzando un ago a farfalla. Detti campioni sono stati posti in provette senza anticoagulante e sono stati centrifugati per 12 minuti a una velocità di 2700 rpm a temperatura ambiente per ottenere membrane PRF. Una volta ottenute le membrane, queste sono state tagliate in piccole porzioni di circa 2 mm di diametro per essere suddivise in tre parti che sono state utilizzate successivamente per i tre gruppi sperimentali. È stato utilizzato 0,01 mg per cc di versenato di silicio. (Laboratorio di Energia Naturale del Venezuela, Caracas, Venezuela).
Quattro difetti ossei non auto-riparabili sono stati creati (diametro: 9 mm; profondità: circa 3 mm, fino a raggiungere la dura madre) sull'osso parietale, su ciascun lato della linea mediana del cranio, utilizzando un trefina (Helmut-Zepf Medical GmbH, Seitingen, Germania) montata su un micromotore chirurgico a 2000 rpm sotto irrigazione con soluzione salina. Sono stati utilizzati strumenti piezoelettrici per rimuovere il tavolo interno e l'osso midollare di ciascun difetto. La profondità è stata controllata con una sonda parodontale. Una volta effettuati i difetti, l'osso ottenuto è stato macinato e il materiale ottenuto è stato suddiviso in due parti uguali. La configurazione dei gruppi era la seguente: Gruppo 1 (PSB): miscela di membrana di fibrina ricca di piastrine (P) + silicio (S) + osso autologo (B); Gruppo 2 (PS): membrana di fibrina ricca di piastrine (P) + silicio (S); Gruppo 3 (SB): silicio (S) + osso autologo (B) e infine Gruppo 4 (CONTROLLO) in cui non è stato posto alcun materiale rigenerativo. La distribuzione dei gruppi nell'osso parietale può essere vista nella Tabella 1.
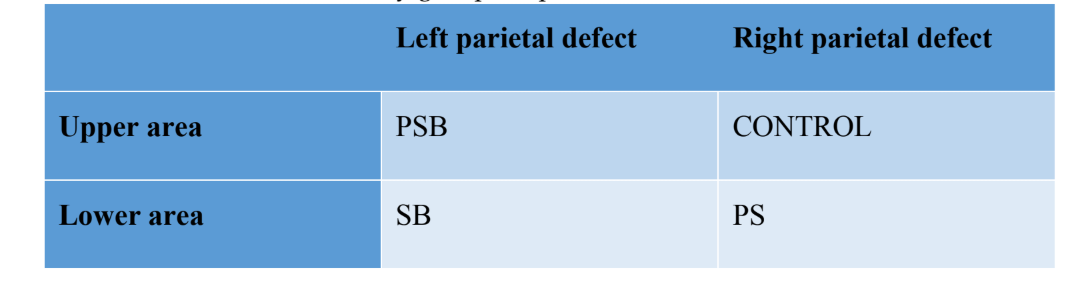
Dopo la sutura, sono stati somministrati agenti anti-infiammatori e analgesici (carprofene 1 ml / 12,5 kg e buprenorfina 0,05 mg / kg). Infine, gli animali sono stati sacrificati utilizzando un'overdose endovenosa di cloruro di potassio dopo 3 settimane. La procedura chirurgica può essere vista nella Figura 1.
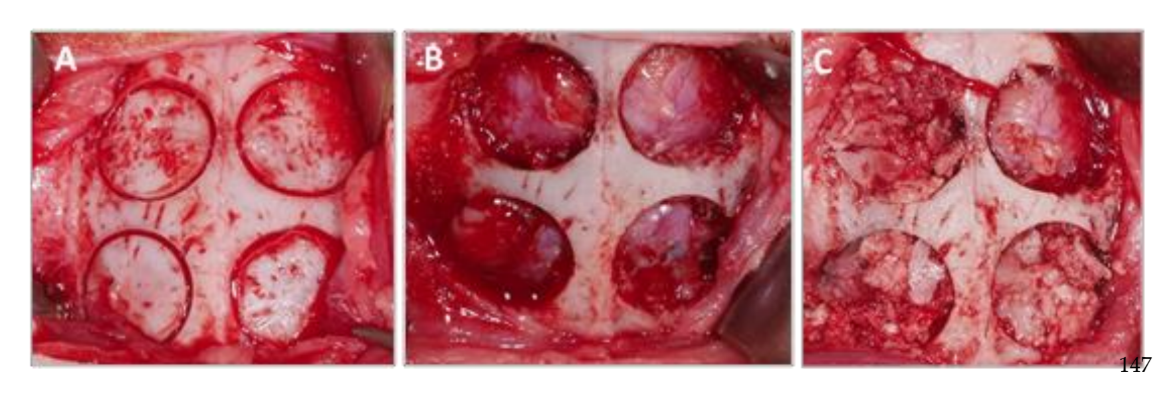
I campioni ottenuti dalla volta cranica di ciascun campione sono stati tagliati sul piano sagittale anatomico e, dopo essere stati separati dalla massa cerebrale e lavati in soluzione salina fisiologica, i pezzi sono stati tagliati e contrassegnati individualmente. Ognuno dei campioni è stato immerso in una soluzione di formalina al 10% per analisi tomografiche e istomorfometriche.
Microtomografia computerizzata (micro-CT)
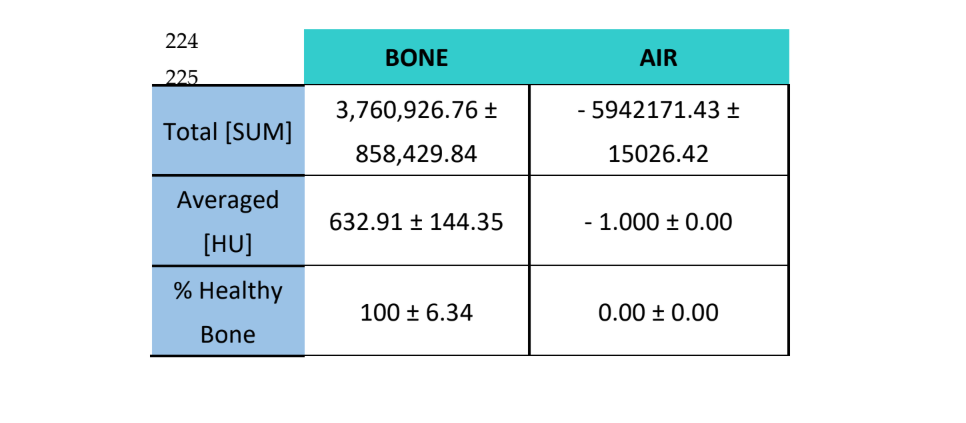
I campioni sono stati analizzati utilizzando la Tomografia Computerizzata (CT) con uno scanner CT Bruker Albira (Bruker Co., Billerica, MA, USA). Le acquisizioni sono state effettuate utilizzando i seguenti parametri: 1000 immagini, in proiezione radiografica a 360°, a 45 kV e 30 minuti di tempo di acquisizione. La ricostruzione tomografica è stata eseguita utilizzando il software Albira Suite (Bruker Co., Billerica, MA, USA) e parametri di ricostruzione standard per generare volumi 2D e 3D con una risoluzione di 8.3 voxel/mm. La densità ossea media misurata in Unità di Hounsfield (HU) è stata valutata utilizzando il software PMOD (Bruker Co., Billerica, MA, USA), posizionando volumi sferici di interesse [VOI] di 2 mm in una formazione a rosetta all'interno di ogni lesione. Ricostruzioni ad alta risoluzione di un volume di 10 mm3 sono state effettuate in ogni lesione utilizzando il software Albira Suite, dando origine a volumi con una risoluzione di 20 voxel/mm. Per ciascuno dei volumi sono state valutate le seguenti variabili: (1) La somma totale dei valori di Hounsfield di tutti i voxel (SOMMA TOTALE), (2) la media di tutti i valori di Hounsfield dei voxel (Media) in unità di Hounsfield e (3) la percentuale di osso sano (%).
Queste stesse variabili sono state valutate per l'aria ̶ come misura per stabilire il rumore di fondo delle immagini ̶ e per l'osso circostante, in cui la percentuale di osso sano atteso è del 100%.
Processamento istologico del campione
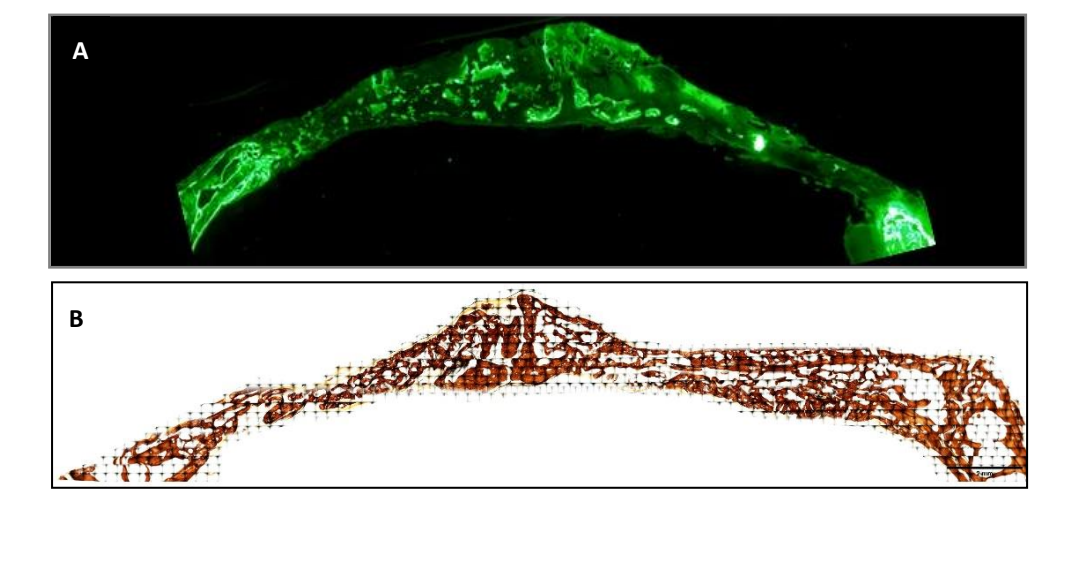
I campioni sono stati ottenuti dal cranio di ciascun campione, tagliando lungo il piano sagittale anatomico. I campioni disidratati sono stati immediatamente immersi in una soluzione di formaldeide al 4% e calcio al 1% incorporati in resina acrilica e sono stati lavorati per il taglio seguendo il metodo di Donath e Breuner per ottenere sezioni istologiche di 5µm di spessore. I campioni sono stati colorati con Von Kossa (VK) 5% nitrato d'argento (Sigma-Aldrich Chemical Co., Poole, Regno Unito) per visualizzare l'osso mineralizzato dopo 3 settimane e sono stati osservati utilizzando un microscopio ottico Olympus BXB61 (Olympus, Tokyo, Giappone) con obiettivi da 1.5 e 20x. Le immagini sono state catturate utilizzando un processore di segnale digitale DSP DS-Fi1 (Nikon, Tokyo, Giappone) in combinazione con il software NIS-Elements 4.0 BR (Nikon, Tokyo, Giappone). È stata scattata un'immagine di ciascun difetto osseo. Una settimana prima di sacrificare i campioni (a 2 settimane) è stato somministrato un marcatore fluorescente ai conigli per osservare la deposizione di calceina sulla matrice ossea recentemente depositata. Le immagini fluorescenti sono state catturate utilizzando una fotocamera DSP DS-Fi1 [Nikon, Tokyo, Giappone] in combinazione con il software NIS-Elements 4.0 BR [Nikon, Tokyo, Giappone].
Per entrambi i tipi di colorazioni (VK e immunofluorescenza) sono state analizzate quattro variabili: altezza ossea (solo su VK) (mm) (BH), area ossea (µm2) (BA), percentuale di area ossea (%) (BA) e perimetro osseo (µm) (BP).
Analisi statistica
Per l'analisi statistica dei risultati ottenuti è stato applicato il test t ANOVA con un successivo test di Bonferroni per confrontare i risultati ottenuti nei due gruppi di studio, utilizzando il software STATVIEW F-4.5. I risultati sono stati espressi come mediana ± deviazione standard per tutte le variabili analizzate. Il livello di significatività è stato fissato a p ≤ 0.05.
Risultati
Risultati per le variabili radiologiche
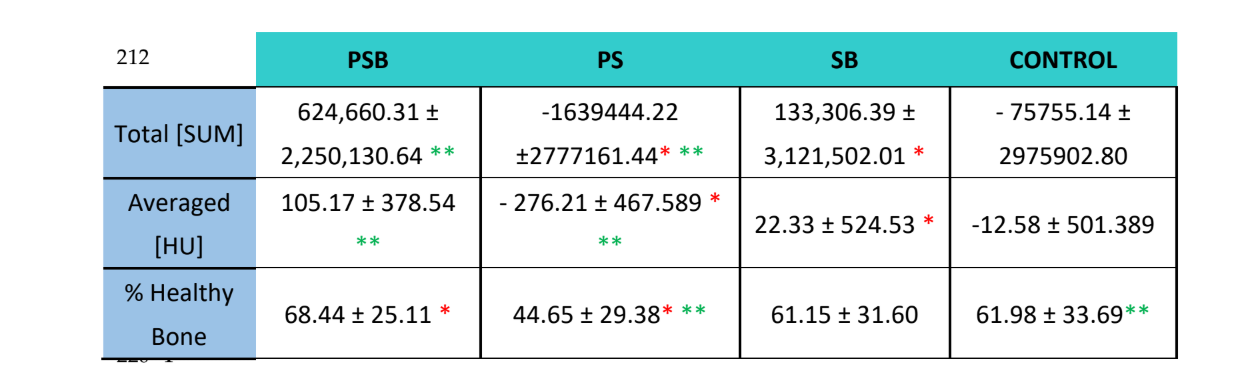
Utilizzando il software Albira Suite, sono state ottenute ricostruzioni 2D e 3D ad alta definizione (Figura 2) e sono state misurate le variabili di quantificazione ossea, nelle quali dopo 3 settimane non sono state riscontrate differenze statisticamente significative tra i gruppi PSB, SB e CONTROLLO nelle variabili Total SUM, Averaged e % Healthy Bone. Il gruppo PS è stato quello che ha ottenuto i valori meno significativi per queste tre variabili (Tabelle 2 e 3).
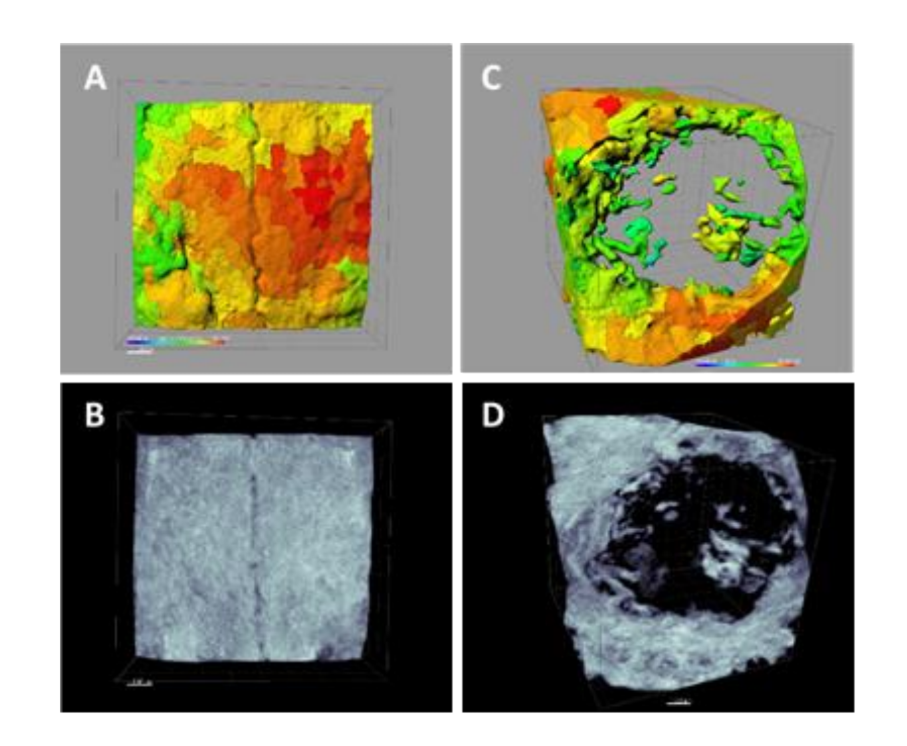
Tre settimane dopo sono state effettuate valutazioni istologiche dei quattro gruppi (Tabella 4). La variabile altezza ossea non ha mostrato differenze statisticamente significative tra i gruppi dopo 3 settimane di guarigione.
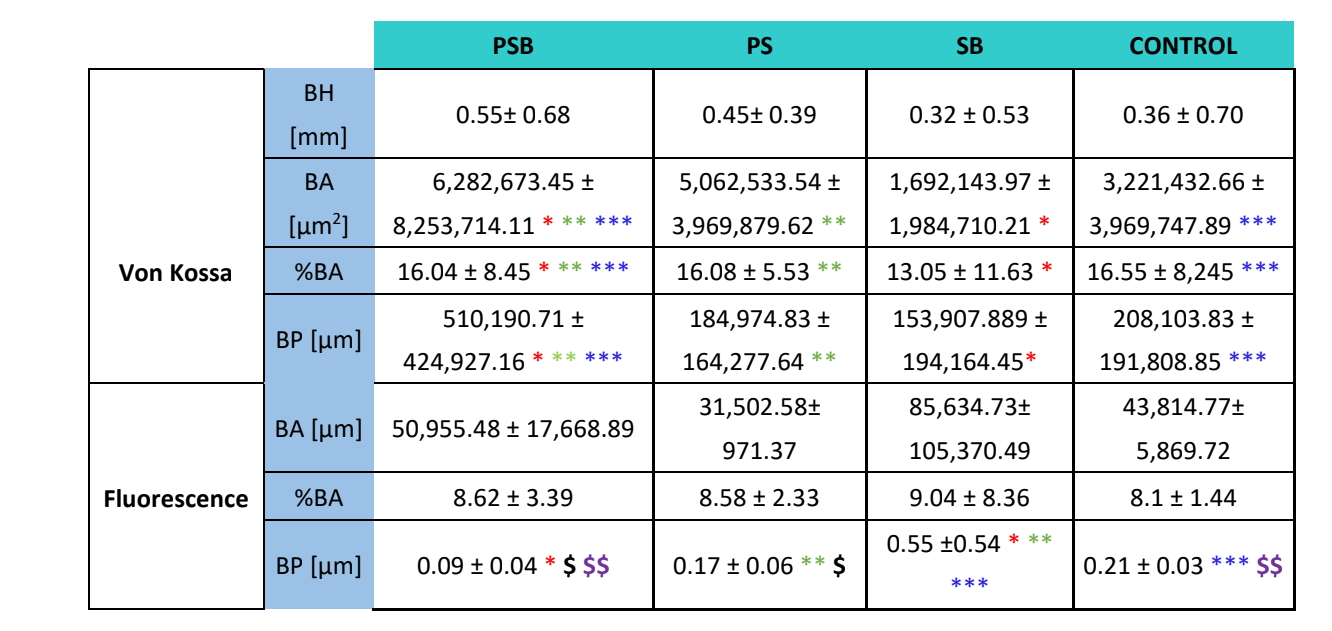
Due colorazioni istologiche, Von Kossa e fluorescenza, sono state eseguite (Figura 4). La prima è stata utilizzata per osservare l'osso mineralizzato. Sono state osservate l'area ossea [BA], la percentuale di area [%BA] e il perimetro osseo [BP]. La colorazione di Von Kossa ha rivelato che il gruppo PSB presentava BA e BP statisticamente superiori rispetto agli altri gruppi. La %BA era più alta nel gruppo CONTROL, sebbene non significativamente rispetto a tutti i gruppi, essendo la dimensione del campione molto piccola.
La colorazione fluorescente è stata utilizzata per misurare le variabili sopra menzionate nel nuovo osso depositato. Non sono state osservate differenze statisticamente significative tra i gruppi per le variabili BA e %BA dopo 3 settimane. Nel gruppo SB il perimetro osseo era significativamente più alto, mentre il gruppo PSB mostrava un valore significativamente più basso.
Discussione
In questo studio radiologico e istologico, abbiamo osservato l'osso formato dopo l'applicazione di diversi materiali rigenerativi ossei ai quali è stato aggiunto silicio per valutare il suo ruolo come stimolatore della formazione ossea.
Nello studio radiologico (Tabella 2) è stato osservato che i gruppi PSB e SB mostrano valori più elevati in termini di quantità e percentuale di osso sano osservato. Tuttavia, queste differenze non erano statisticamente significative rispetto al gruppo CONTROLLO. D'altra parte, il gruppo PS presentava valori significativamente più bassi rispetto al resto dei gruppi.
Lo studio istologico (Tabella 4) ha rivelato che il gruppo PSB era quello che presentava la maggiore area, percentuale e perimetro di osso mineralizzato rispetto agli altri gruppi. Al contrario, valutando la deposizione di calceina sulla matrice ossea, non sono state osservate differenze tra i gruppi riguardo all'area ossea e alla percentuale di area. Il gruppo SB ha presentato un perimetro osseo significativamente più grande. La variabile altezza ossea non ha mostrato differenze tra i gruppi.
Il silicio è un ione bioinorganico che è stato impiegato come materiale rigenerativo in diversi studi, solitamente con altri biomateriali inorganici come il fosfato di calcio o l'idrossiapatite. I vantaggi che offrono sono un basso costo e una vita utile più lunga. La bioattività del silicio dipenderà dall'accumulo di ioni di silicio quando è esposto ai fluidi corporei, come il sangue nel caso di questo studio. Questo fenomeno ha dato origine alla formazione di uno strato simile all'apatite biologicamente attiva.
Per quanto ne sappiamo, non ci sono evidenze nella letteratura dell'uso del versenato di silicio come materiale rigenerativo, quindi il confronto con altri studi deve essere effettuato con cautela.
Il metodo solitamente impiegato consiste nella sostituzione dell'idrossiapatite o del fosfato di calcio con silicio mediante metodi di precipitazione, consentendo di ottenere biomateriali rigenerativi con migliori proprietà. Diversi studi in vitro hanno dimostrato che il silicio è un elemento biocompatibile e bioinerte. Inoltre, promuove l'angiogenesi, la differenziazione osteoblastica e aumenta la densità minerale ossea, accelerando la sua formazione. In uno studio recente, sono stati rigenerati difetti sulle volte craniche dei ratti e, dopo 4 settimane, è stato osservato che si era verificata una formazione ossea significativamente maggiore rispetto a una miscela simile a cui non era stato aggiunto silicio.
Allo stesso modo, sono stati condotti studi misti in vitro e in vivo nei quali è stato possibile confrontare il comportamento del silicio in entrambe le situazioni. Mao et al ha condotto uno studio in cui il silicio è stato aggiunto a una miscela di fosfato di calcio e ceramica vetrosa per rigenerare difetti della volta cranica nei conigli. È stata osservata una viabilità cellulare simile a quella presente nel tessuto osseo spongioso bovino, ma con un tasso di proliferazione cellulare maggiore. Tutto ciò è stato attribuito all'inclusione di ioni di silicio, che dovevano anche potenziare altre funzioni cellulari come l'adesione cellulare. Nello studio istologico condotto, è stata osservata una maggiore formazione di nuovo osso nel gruppo sperimentale.
In base alla letteratura esaminata, ci si aspetterebbe di trovare una maggiore quantità di osso mineralizzato nei gruppi contenenti silicio. Nel nostro studio, i gruppi PS e SB non hanno mostrato differenze rispetto al gruppo di controllo, il quale ha combinato silicio, fibrina ricca di piastrine e osso autologo [il gruppo PSB] essendo quello che ha consentito un livello significativamente più alto di osso mineralizzato rispetto agli altri.
L'osso autologo è ancora considerato il materiale di riferimento per la rigenerazione poiché è l'unico con proprietà osteogeniche, osteoinduttive e osteoconduttive, il che gli conferisce un vantaggio rispetto agli altri materiali disponibili. Tuttavia, la sua disponibilità limitata, la morbidità e il suo tasso di riassorbimento più elevato hanno spinto alla ricerca di nuovi biomateriali.
Nel nostro studio, l'osso autologo combinato con silicio [SB] non ha mostrato differenze significative rispetto ai gruppi PS e di controllo per quanto riguarda l'osso calcificato. Tuttavia, è stato, dopo il gruppo PSB, quello che ha presentato una maggiore quantità di osso e quello che ha mostrato un perimetro osseo maggiore di osso osteoide. Non ci sono pubblicazioni in cui uno dei gruppi di studio abbia impiegato osso autologo con silicio; e i nostri risultati preliminari suggeriscono che dovremmo vedere come si comporta l'osso autologo nel lungo periodo.
Il plasma ricco di fibrina è stato utilizzato in precedenza nella rigenerazione ossea come unico materiale di riempimento, o in combinazione con osso autologo, xenotrapianti o innesti alloplastici, fornendo risultati migliori riguardo alla rigenerazione ossea e una guarigione più rapida rispetto ai gruppi di controllo negativi. Tuttavia, ci sono prove limitate sulla combinazione di silicio e concentrati ricchi di piastrine. Sono stati trovati solo due studi nella letteratura che combinano entrambi i materiali. I loro risultati differiscono e anche i nostri. Nel primo studio, una combinazione di PRP/silicio è stata successivamente gelificata con cloruro di calcio. È stata applicata su una coltura cellulare di osteoblasti, e si è osservata una maggiore proliferazione, una maggiore vitalità cellulare e una maggiore deposizione di calcio da parte delle cellule nel gruppo sperimentale rispetto al gruppo senza silicio. Al contrario, nel secondo studio un fattore generatore di cellule (CGF) è stato combinato con ortosilicato di sodio su osteoblasti umani. Non sono state osservate differenze statisticamente significative riguardo alla proliferazione cellulare o alla crescita rispetto ai gruppi in cui è stato somministrato solo ortosilicato o solo concentrato piastrinico. Al contrario, è stata osservata una maggiore produzione di collagene di tipo I. In entrambi gli studi si è concluso che le proprietà osteoconduttive del silicio sarebbero state potenziate dai fattori di crescita nel CGF. Entrambi i risultati differivano nel nostro studio, in cui il gruppo PS era quello che otteneva valori radiologici significativamente più bassi, sebbene istologicamente non mostrasse differenze rispetto al gruppo di controllo. Il confronto con entrambe le pubblicazioni deve essere fatto con cautela perché si trattava di studi in vitro con un materiale diverso. Tuttavia, i nostri risultati sarebbero in accordo con due prove effettuate su osso di coniglio in cui si è osservato che il PRF non migliorava significativamente la rigenerazione ossea rispetto al gruppo di controllo negativo.
Nel nostro studio, una maggiore formazione di osso mineralizzato si è verificata nel gruppo PSB e questo potrebbe essere dovuto a due fattori: il primo di questi è che il silicio e il PRF potrebbero potenziare la sua capacità osteoconduttiva combinandosi tra loro e allo stesso tempo accelererebbero la mineralizzazione ossea. Questo potrebbe spiegare le migliori prestazioni del gruppo PSB nel nostro studio. Il secondo fattore è l'aggiunta di osso autologo al biomateriale che, come accennato in precedenza, è considerato il materiale di riferimento nella rigenerazione ossea.
Tra i limiti dello studio, vale la pena notare il basso numero di campioni nel campione, così come il periodo di tempo valutato. I gruppi di studio PSB e SB hanno offerto buoni risultati di rigenerazione, tuttavia, radiologicamente non hanno presentato una differenza significativa rispetto al gruppo di controllo. Un modo per migliorare lo studio sarebbe valutare periodi di tempo più lunghi, che potrebbero forse offrire risultati più rivelatori sul comportamento di questi materiali rigenerativi. Inoltre, l'uso di un gruppo di controllo positivo (riempiendo il difetto con osso autologo senza silicio o una miscela di solo osso autologo e eterologo) potrebbe essere stato contemplato. Un altro limite dello studio è la difficoltà di confronto a causa del tipo di materiale impiegato (silicio versenato). Il silicio è un elemento che viene impiegato in forme molto diverse nella letteratura come biossido di silicio, acetato di silicio e silicato di sodio, e non esiste ancora un protocollo validato. Il silicio granulato è stato utilizzato nel nostro studio. In condizioni fisiologiche, il silicio bio-disponibile si trova sotto forma di acido ortosilicico, mentre negli studi in cui è stato impiegato idrossiapatite sostituita con silicio, il silicio utilizzato è sotto forma di SiO4, sebbene, d'altra parte, sia stato recentemente dimostrato che il silicio nella sua forma fisiologica potrebbe non essere concentrato nella fase minerale inorganica dell'osso senza essere prima metabolizzato in ortosilicato.
Nello studio radiologico, non è stata osservata alcuna differenza statisticamente significativa tra i gruppi di studio rispetto al gruppo di controllo e questo potrebbe essere dovuto alla mancanza di utilizzo di membrane o agenti fissativi per rivestire il difetto al fine di stabilizzare la coagulazione e prevenire ritardi nella completa ossificazione dell'area, sebbene il periodo studiato (3 settimane) sia insufficiente per osservarlo.
Conclusioni
Il silicio è un elemento promettente come materiale da includere con altri materiali rigenerativi ossei grazie al suo basso costo e alle buone proprietà osservate in vitro e in vivo, sebbene la definizione delle sue proprietà e delle condizioni ottimali di utilizzo sia ancora in fase di studio. La combinazione di fibrina ricca di piastrine, osso autologo e silicio offre buoni risultati dopo 3 settimane. I gruppi PSB e SB sono quelli che offrono buoni risultati, il gruppo PSB presenta una maggiore velocità di mineralizzazione ossea rispetto al SB e questo potrebbe essere dovuto all'inclusione di plasma ricco di piastrine e silicio. I risultati ottenuti in questo studio rivelano l'importanza dell'osso autologo come parte del materiale di innesto affinché l'osso possa mineralizzarsi.
Entro i limiti di questa ricerca, l'analisi istologica dei tessuti rigenerati potrebbe fornire informazioni utili sulla natura e sulla quantità di osso formato con l'uso di silicio, fibrina ricca di piastrine e osso autologo. Sono necessari ulteriori studi per acquisire conoscenze sul vero potenziale rigenerativo degli ioni bioinorganici come il silicio.
Autori: Argimiro Hernández-Suarez, María Rizo-Gorrita, Dubraska Suárez-Vega, Gladys Velazco, Ivan Rodriguez Gelfenstein, María-Ángeles Serrera-Figallo e Daniel Torres-Lagares
Riferimenti:
- Ferres E. Studio dell'effetto dell'aggiunta di silicio al beta-fosfato tricálcico e idrossiapatite nella neoformazione ossea in difetti critici in calotte e conigli. Tesi di Dottorato. Università di Murcia. 2017.
- Morales D. Ingegneria tissutale come pilastro della medicina rigenerativa in stomatologia. Revista Cubana de Estomatología 2014;51(3):288-304
- Oppenheimer AJ, Tong L, Buchman SR. Innesto osseo craniofacciale: la legge di Wolff rivisitata. Craniomaxillofac Trauma Reconstr. 2008;1(1):49-61.
- Henkel J, Woodruff MA, Epari DR, Steck R, Glatt V, Dickinson IC, Choong PF, Schuetz MA, Hutmacher DW. Rigenerazione ossea basata su concezioni di ingegneria tissutale - Una prospettiva del 21° secolo. Bone Res. 2013 Sep 25;1(3):216-48.
- Mordenfeld A, Johansson CB, Albrektsson T, Hallman M. Uno studio clinico randomizzato e controllato su due diverse composizioni di osso bovino deproteinizzato e osso autologo utilizzato per l'aumento del bordo laterale. Clin Oral Implants Res. 2014 Mar;25(3):310-320.
- Masoudi E, Ribas J, Kaushik G, Leijten J, Khademhosseini A. Derivati del sangue ricchi di piastrine per ingegneria tissutale e rigenerazione basata su cellule staminali. Curr Stem Cell Rep. 2016 Mar;2(1):33-42.
- Anitua E, Sánchez M, Nurden AT, Nurden P, Orive G, Andía I. Nuove intuizioni e nuove applicazioni per le terapie con fibrina ricca di piastrine. Trends Biotechnol. 2006 May;24(5):227-34.
- Amaral Valladão CA Jr, Freitas Monteiro M, Joly JC. Rigenerazione ossea guidata in aumento osseo verticale e orizzontale in fasi utilizzando fibrina ricca di piastrine associata a innesti ossei: uno studio clinico retrospettivo. Int J Implant Dent. 2020 Oct 17;6(1):72.
- Cho YS, Hwang KG, Jun SH, Tallarico M, Kwon AM, Park CJ. Analisi comparativa radiologica tra riempimento con soluzione salina e fibrina ricca di piastrine dopo sollevamento del seno transcrestale idraulico senza innesto osseo aggiuntivo: uno studio clinico randomizzato controllato. Clin Oral Implants Res. 2020 Nov;31(11):1087-1093.
- Areewong K, Chantaramungkorn M, Khongkhunthian P. Fibrina ricca di piastrine per preservare le cavità ossee alveolari dopo l'estrazione dentale: uno studio clinico randomizzato controllato. Clin Implant Dent Relat Res. 2019 Dec;21(6):1156-1163.
- de Almeida Barros Mourão CF, de Mello-Machado RC, Javid K, Moraschini V. L'uso di fibrina ricca di leucociti e piastrine nella gestione della guarigione dei tessuti molli e del dolore nelle cavità post-estrattive: uno studio clinico randomizzato. J Craniomaxillofac Surg. 2020 Apr;48(4):452-457.
- Castro AB, Herrero ER, Slomka V, Pinto N, Teughels W, Quirynen M. Capacità antimicrobica della fibrina ricca di leucociti e piastrine contro i patogeni parodontali. Sci Rep. 2019 Jun 3;9(1):8188.
- Schuldt L, Bi J, Owen G, Shen Y, Haapasalo M, Häkkinen L, Larjava H. Decontaminazione delle superfici implantari ruvide colonizzate da biofilm orale multispecie mediante applicazione di fibrina ricca di leucociti e piastrine. J Periodontol. 2020 Aug 27.
- Zofková I, Nemcikova P, Matucha P. Elementi traccia e salute ossea. Clin Chem Lab Med. 2013 Aug;51(8):1555-61.
- Zhang D, Wong CS, Wen C, Li Y. Risposte cellulari delle cellule osteoblasti-simili a 17 metalli elementari. J Biomed Mater Res A. 2017 Jan;105(1):148-158.
- Arora M., Arora E. La promessa del silicio: rigenerazione ossea e aumento della densità ossea. J Arthroscopy and Joint Surgery 2017;4(3):103-105.
- Carlisle EM. Silicio. Un possibile fattore nella calcificazione ossea. Science 1970;167:279–280.
- Carlisle EM. Silicio come elemento traccia essenziale nella nutrizione animale. Ciba Found Symp. 1986;121:123-39.
- Schwarz K, Milne DB. Effetti di promozione della crescita del silicio nei ratti. Nature. 1972 Oct 6;239(5371):333-4.
- Dong M, Jiao G, Liu H, Wu W, Li S, Wang Q, Xu D, Li X, Liu H, Chen Y. Il silicio biologico stimola la sintesi di collagene di tipo 1 e osteocalcina nelle cellule osteoblasti-simili umane attraverso la via di segnalazione BMP-2/Smad/RUNX2. Biol Trace Elem Res. 2016 Oct;173(2):306-15.
- Price CT, Koval KJ, Langford JR. Silicio: una revisione del suo potenziale ruolo nella prevenzione e nel trattamento dell'osteoporosi postmenopausale. Int J Endocrinol. 2013;2013:316783.
- Zou S, Ireland D, Brooks RA, Rushton N, Best S. Gli effetti degli ioni silicato sull'adesione, proliferazione e differenziazione degli osteoblasti umani. J Biomed Mater Res B Appl Biomater. 2009 Jul;90(1):123-30. Uribe P, Johansson A, Jugdaohsingh R, Powell JJ, Magnusson C, Davila M, Westerlund A, Ransjö M. La silice solubile stimola la differenziazione osteogenica e la comunicazione delle giunzioni gap nelle cellule del follicolo dentale umano. Sci Rep. 2020 Jun 18;10(1):9923.
- Kim, E. J., Bu, S. Y., Sung, M. K. & Choi, M. K. Effetti del silicio sull'attività osteoblastica e sulla mineralizzazione ossea delle cellule MC3T3-E1. Biol. Trace Elem. Res. 2013; 152(1):105–12.
- Hench LL, Xynos ID, Polak JM. Vetrini bioattivi per la rigenerazione tissutale in situ. J Biomater Sci Polym Ed. 2004;15(4):543-62.
- Chowdhury M. Le formulazioni a base di silice per la somministrazione di farmaci, il trattamento osseo e la rigenerazione ossea. ChemBioEng Rev 2016; 3(5):229-246.
- Byun IS, Sarkar SK, Anirban Jyoti M, Min YK, Seo HS, Lee BT, Song HY. Iniziale biocompatibilità e risposta osteoblastica migliorata del doping di Si in un sostituto osseo poroso BCP. J Mater Sci Mater Med. 2010 Jun;21(6):1937-47.
- Mao Z, Gu Y, ZhangJ, Shu W.W., Cui Y. Superiore prestazione biologica e attività osteoinduttiva delle particelle bioattive per la rigenerazione ossea contenenti Si per la ricostruzione dell'osso alveolare. Ceram. Int. 2020. 46(2020):353-364.
- Wang X, Ito A, Sogo Y, Li X, Oyane A. Strati compositi di silicato-apatite su barre di fissazione esterne e valutazione in vitro utilizzando fibroblasti e osteoblasti. J Biomed Mater Res A. 2010 Mar 1;92(3):1181-9.
- Roh J, Kim JY, Choi YM, Ha SM, Kim KN, Kim KM. Rigenerazione ossea utilizzando una miscela di corallo HA sostituito da silicio e β-TCP in un modello di difetto osseo calvariale nei ratti. Materials (Basel). 2016 Feb 6;9(2):97.
- Toledano M, Toledano-Osorio M, Osorio R, Carrasco-Carmona Á, Gutiérrez-Pérez JL, Gutiérrez-Corrales A, Serrera-Figallo MA, Lynch CD, Torres-Lagares D. Doxiciclina e polimeri nanofibrosi caricati di silice come biomateriali per la rigenerazione ossea. Polymers (Basel). 2020 May 25;12(5):1201.
- Sánchez F, Orero A, Soriano A, Correcher C, Conde P, González A, Hernández L, Moliner L, Rodríguez-Alvarez MJ, Vidal LF, Benlloch JM, Chapman SE, Leevy WM. ALBIRA: un sistema di imaging PET∕SPECT∕CT per piccoli animali. Med Phys. 2013 May;40(5):051906.
- Donath K, Breuner G. Un metodo per lo studio di ossa e denti non decalcificati con tessuti molli attaccati. La tecnica Säge-Schliff (segatura e macinatura). J Oral Pathol. 1982 Aug;11(4):318-26.
- Garbo C, Locs J, D'Este M, Demazeau G, Mocanu A, Roman C, Horovitz O, Tomoaia-Cotisel M. Idrossiapatiti avanzate multi-sostituite da Mg, Zn, Sr, Si per la rigenerazione ossea. Int J Nanomedicine. 2020 Feb 13;15:1037-1058.
- Wang W, Yeung KWK. Innesti ossei e sostituti biomateriali per la riparazione dei difetti ossei: una revisione. Bioact Mater. 2017 Jun 466 7;2(4):224-247.
- Götz W, Tobiasch E, Witzleben S, Schulze M. Effetti dei composti di silicio sulla biomineralizzazione, osteogenesi e formazione di tessuti duri. Pharmaceutics. 2019 Mar 12;11(3):117.
- Gibson IR, Best SM, Bonfield W. Effetto della sostituzione del silicio sulla sinterizzazione e microstruttura dell'idrossiapatite. J Am Ceram Soc. 2002;85(11):2771–2777
- Porter AE, Botelho CM, Lopes MA, Santos JD, Best SM, Bonfield W. Confronto ultrastrutturale della dissoluzione e della precipitazione dell'apatite su idrossiapatite e idrossiapatite sostituita da silicio in vitro e in vivo. J Biomed Mater Res A. 2004 Jun 15;69(4):670-9.
- Li H, Chang J. Materiali silicatati bioattivi stimolano l'angiogenesi in un sistema di co-coltura di fibroblasti e cellule endoteliali attraverso un effetto paracrino. Acta Biomater. 2013 Jun;9(6):6981-91.
- Shie MY, Ding SJ, Chang HC. Il ruolo del silicio nella proliferazione e apoptosi delle cellule simili agli osteoblasti. Acta Biomater. 2011 477 Jun;7(6):2604-14.
- Thian E.S., Huang J., Best S.M., et al., La risposta degli osteoblasti all'idrossiapatite sottile sostituita da silicio nanocristallino. Biomaterials 2006; 27(13):2692–2698
- Lee, S. H., Kim, S. W., Lee, J. I., Yoon, H. J. L'effetto della fibrina ricca di piastrine sulla rigenerazione ossea e sull'angiogenesi nei difetti craniali dei conigli. Tissue Engineering and Regenerative Medicine 2015. 12(5):362-370.
- Jeon YR, Kim MJ, Kim YO, Roh TS, Lee WJ, Kang EH, Yun IS. Rigenerazione ossea senza impalcatura utilizzando fibrina ricca di piastrine in un modello di difetto calvariale. J Craniofac Surg. 2018 Jan;29(1):251-254.
- Sindel A, Dereci Ö, Toru HS, Tozoğlu S. Confronto istomorfometrico della rigenerazione ossea in difetti ossei di dimensioni critiche utilizzando matrice ossea demineralizzata, fibrina ricca di piastrine e acido ialuronico come sostituti ossei. J Craniofac Surg. 2017 Oct;28(7):1865-1868.
- Kökdere NN, Baykul T, Findik Y. L'uso della fibrina ricca di piastrine (PRF) e dell'innesto osseo autologo misto a PRF nel trattamento dei difetti ossei: uno studio sperimentale e istomorfometrico. Dent Res J (Isfahan). 2015 Sep-Oct;12(5):418-24.
- Karayürek F, Kadiroğlu ET, Nergiz Y, Coşkun Akçay N, Tunik S, Ersöz Kanay B, Uysal E. Combinare fibrina ricca di piastrine con diversi materiali per innesti ossei: uno studio sperimentale sugli aspetti istopatologici e immunoistochimici della guarigione ossea. J Craniomaxillofac Surg. 2019 May;47(5):815-825.
- Knapen M, Gheldof D, Drion P, Layrolle P, Rompen E, Lambert F. Effetto della fibrina ricca di leucociti e piastrine (L-PRF) sulla rigenerazione ossea: uno studio nei conigli. Clin Implant Dent Relat Res. 2015 Jan;17 Suppl 1:e143-52.
- Sani F, Mehdipour F, Talaei-Khozani T, Sani M, e RazbanV. Fabbricazione di impalcature di plasma ricco di piastrine/silice per l'ingegneria dei tessuti ossei Bioispirati, Biomimetici e Nanobiomateriali 2018 7:2, 74-81.
- Bonazza V, Borsani E, Buffoli B, Parolini S, Inchingolo F, Rezzani R, Rodella LF. Trattamento in vitro con fattori di crescita concentrati (CGF) e ortosilicato di sodio influisce positivamente sul rinnovamento cellulare in tre diverse linee cellulari umane. Cell Biol Int. 2018 Mar;42(3):353-364.
- Faot F, Deprez S, Vandamme K, Camargos GV, Pinto N, Wouters J, van den Oord J, Quirynen M, Duyck J. L'effetto delle membrane L-PRF sulla guarigione ossea nei difetti ossei delle tibie dei conigli: risultati di micro-CT e biomarker. Sci Rep. 2017 Apr 12;7:46452.
- Fielding GA, Smoot W, Bose S. Effetti dei dopanti SiO2, SrO, MgO e ZnO nei fosfati tricálcici sull'espressione di Runx2 osteoblastica. J Biomed Mater Res A. 2014 Jul;102(7):2417-26.
- Kamitakahara M, Tatsukawa E, Shibata Y, Umemoto S, Yokoi T, Ioku K, Ikeda T. Effetto dell'incorporazione di silicato sulle risposte in vivo delle ceramiche α-fosfato tricálcico. J Mater Sci Mater Med. 2016 May;27(5):97.
- Chappell HF, Jugdaohsingh R, Powell JJ. L'incorporazione fisiologica di silicio nel minerale osseo richiede il metabolismo dell'acido ortosilicico in SiO44. J R Soc Interface. 2020 Jun;17(167):20200145.
- Gutiérrez-Prieto SJ, Fonseca LF, Sequeda-Castañeda LG, Díaz KJ, Castañeda LY, Leyva-Rojas JA, Salcedo-Reyes JC, Acosta AP. 508 Elaborazione e biocompatibilità di un materiale idrossiapatitico derivato da gusci d'uovo modificato con Si/PLGA per la rigenerazione ossea in odontoiatria. Int J Dent. 2019 Dec 5;2019:5949232.
- Szurkowska K, Szeleszczuk Ł, Kolmas J. Effetti delle condizioni di sintesi sulla formazione di fosfati tricálcici α-sostituiti da Si. Int J Mol Sci. 2020 Dec 1;21(23):9164.
