Efficacia della terapia a lungo termine con macrolidi a basso dosaggio nella prevenzione della recidiva precoce dei polipi nasali dopo la chirurgia endoscopica dei seni paranasali.
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Contesto: Questo studio ha valutato l'efficacia della terapia “a lungo termine” con claritromicina come trattamento aggiuntivo alla terapia di mantenimento con corticosteroidi nasali per prevenire la ricorrenza dei polipi nasali (NP) dopo la chirurgia endoscopica funzionale dei seni paranasali (FESS).
Metodi: Un totale di 66 pazienti con rinosinusite cronica e NP bilaterali sono stati randomizzati in 3 gruppi di studio, 22 pazienti in ciascun gruppo. Dopo FESS, i pazienti nei primi due gruppi sono stati trattati con claritromicina 250 mg/giorno per 12 e 24 settimane, rispettivamente, mentre i pazienti nel terzo gruppo non hanno ricevuto alcuna claritromicina. I pazienti in tutti e 3 i gruppi hanno ricevuto terapia di mantenimento con mometasone furoato 400 μg/giorno. La valutazione dei pazienti è stata condotta prima dell'intervento chirurgico e 6, 12 e 24 settimane dopo l'intervento, utilizzando una scala analogica visiva (VAS), il test di esito sino-nasale a 20 item (SNOT-20), la rinometria acustica, la rinomanometria, il tempo di transito del saccarina, l'endoscopia nasale, la tomografia computerizzata (TC) dei seni paranasali e la misurazione del livello di proteina cationica eosinofila (ECP) nelle loro secrezioni nasali.
Risultati: Lo studio ha confermato l'efficacia della terapia con macrolidi “a lungo termine”, portando a un miglioramento significativo di tutti i parametri tranne che per la rinometria acustica e il VAS in entrambi i gruppi di claritromicina rispetto al controllo. La concentrazione di ECP nelle secrezioni nasali è aumentata drasticamente dopo l'intervento chirurgico, per poi tornare ai livelli di base dopo 12 e 24 settimane di trattamento con claritromicina. Nel gruppo di controllo, il livello di ECP ha continuato ad aumentare ed era significativamente più alto al termine dello studio. Entrambi i gruppi con claritromicina hanno mostrato punteggi endoscopici e CT significativamente migliori rispetto al gruppo di controllo al termine dello studio.
Conclusione: La claritromicina a basso dosaggio “a lungo termine” di 250 mg/giorno è in grado di controllare l'infiammazione eosinofila e prevenire la recidiva precoce di NP dopo FESS 2014 ARS-AAOA, LLC.
La rinocinosite cronica (CRS) si verifica spesso in associazione con polipi nasali (NP). In uno studio, la CRS con NP (CRSwNP) è stata diagnosticata nel 4% dell'intera popolazione ed è associata all'asma bronchiale (BA) nel 7% al 13% dei casi. Inoltre, la malattia respiratoria esacerbata dall'aspirina (AERD) e NP sono presenti in un gran numero di pazienti (variando dal 36% al 96%). Nella CRSwNP la cellula infiammatoria predominante è l'eosinofilo, che si trova sia nel tessuto che nel muco delle vie aeree in quasi tutti i pazienti con CRSwNP. Sebbene il ruolo dell'infezione (infiammazione neutrofila) sia stato indagato, non sembra essere un fattore primario nello sviluppo della CR-SwNP, sebbene la CRSwNP sia associata all'BA. L'allergia sembra essere una condizione comorbida e non un fattore primario nello sviluppo della CRSwNP. Attualmente, né il trattamento medico né quello chirurgico possono garantire un controllo permanente o una cura duratura. Attualmente, l'unico trattamento provato per il controllo efficace della CRSwNP è rappresentato dagli spray nasali steroidei topici con o senza glucocorticoidi sistemici (GCS). La CRSwNP ricorrente non è sempre prevenuta anche con GCS sistemici e gli effetti collaterali possono essere gravi, inclusi cataratte e collasso vertebrale. Poiché il controllo della malattia può essere difficile anche con GCS sistemici, abbiamo deciso di studiare il trattamento con terapia “a lungo termine” (3-6 mesi e oltre) utilizzando antibiotici macrolidi a basso dosaggio. Apparentemente sono le proprietà non antimicrobiche dei macrolidi (eritromicina, roxitromicina, claritromicina) a contribuire ai loro effetti anti-infiammatori, che includono l'inibizione sia dell'infiammazione neutrofila che eosinofila. I macrolidi sono in grado di modulare la risposta immunitaria, inibire la crescita dei polipi, distruggere i biofilm e migliorare le proprietà protettive della mucosa delle vie respiratorie.
L'efficacia dei macrolidi nei pazienti con CRS senza NP è stata confermata; tuttavia, la loro efficacia nei pazienti con CRSwNP non è stata approfonditamente investigata. Pertanto, il nostro studio controllato randomizzato prospettico è stato progettato per valutare l'efficacia e la sicurezza di un trattamento a lungo termine (3 e 6 mesi) con claritromicina a basso dosaggio nei pazienti con CRSwNP dopo intervento chirurgico endoscopico funzionale dei seni paranasali (FESS).
Pazienti e metodi
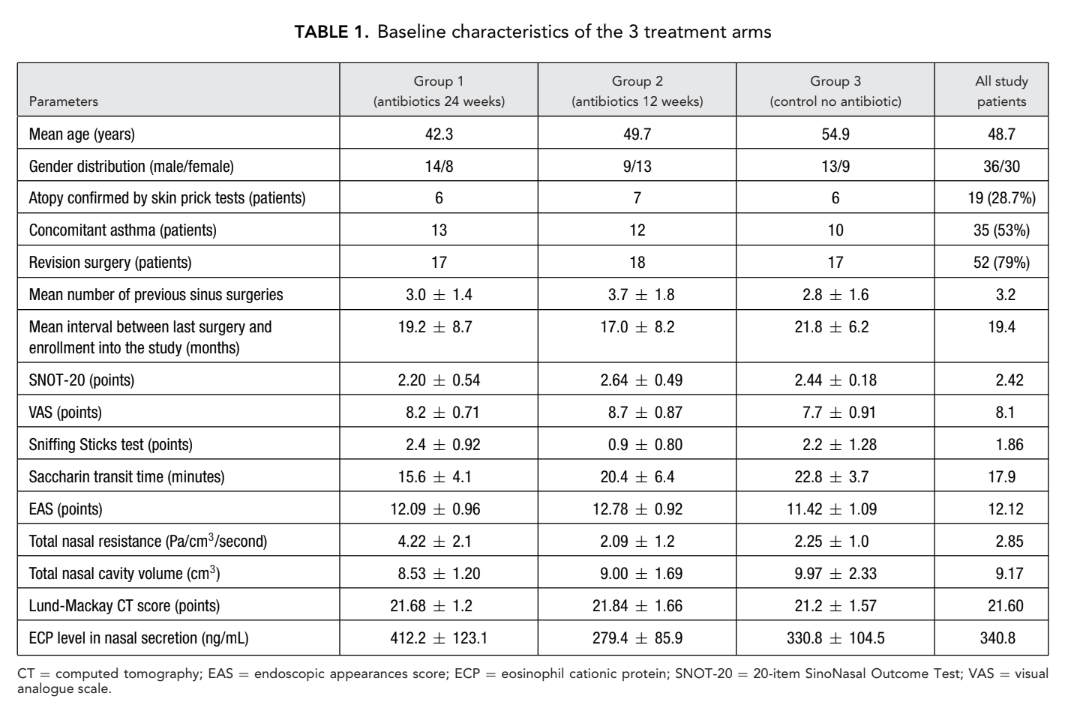
Un totale di 66 pazienti (36 uomini e 30 donne) di età compresa tra 18 e 77 (media, 48,7) anni con CRSwNP bilaterale confermata da endoscopia sono stati reclutati. Il periodo di studio è stato da gennaio 2008 a marzo 2011. Tutti i 66 pazienti sono stati assegnati casualmente (sistema di buste sigillate) a 1 di 3 gruppi di studio (22 pazienti per gruppo) come segue: gruppo 1 (antibiotici per 24 settimane); gruppo 2 (antibiotici per 12 settimane); e gruppo 3 (controllo, senza antibiotici).
Tutti e 3 i gruppi hanno ricevuto spray nasale steroideo topico (furoato di mometasone), 400 μg/giorno per 24 settimane dopo FESS. L'antibiotico macrolide utilizzato nei gruppi 1 e 2 è stato claritromicina 250 mg/giorno (Klacid; Abbott Laboratories, Abbott Park, Illinois, USA). La maggior parte dei pazienti (79%) aveva almeno 1 intervento chirurgico ai seni precedentemente senza successo a lungo termine; il numero medio di interventi precedenti in tutti i 66 pazienti era di 3,2 (Tabella 1).
I criteri di esclusione includevano quanto segue: CR-SwNP unilaterale, intolleranza ai macrolidi, uso di steroidi sistemici, gravidanza, allattamento e gravi malattie somatiche. Abbiamo escluso tutti i pazienti che erano in terapia con steroidi sistemici perché in Russia, la terapia con steroidi sistemici è riservata solo ai pazienti con BA grave. Sarebbe stato non etico interrompere gli steroidi sistemici in questi pazienti con BA; inoltre, gli steroidi sistemici potrebbero avere un impatto negativo sull'affidabilità dei risultati del nostro studio. Il Comitato Etico della Prima Università Statale di Medicina di Mosca Sechenov ha richiesto che tutti i pazienti in tutti e 3 i gruppi mantenessero l'uso di steroidi nasali topici dopo FESS, altrimenti il NP può ripresentarsi rapidamente.
Dopo il reclutamento, tutti i 66 pazienti hanno subito un FESS bilaterale eseguito dallo stesso chirurgo (autore senior Lopatin A.). I pazienti del gruppo 1 (antibiotici per 24 settimane) e del gruppo 2 (antibiotici per 12 settimane) hanno iniziato la terapia a lungo termine con claritromicina 250 mg/giorno il primo giorno post-operatorio e per 24 settimane (6 mesi) o 12 settimane (3 mesi), rispettivamente. Il 7° giorno dopo l'intervento, tutti i pazienti hanno iniziato la terapia di mantenimento con spray nasale di furoato di mometasone (Nasonex, MSD, Merck & Co., Inc., NJ, USA) 400 μg/giorno per un totale di 6 mesi, compresi i pazienti del gruppo 3 (controllo senza antibiotici). Il Comitato Etico ha approvato il protocollo finale dello studio con tutti i 66 pazienti arruolati che hanno firmato i moduli di consenso.
I pazienti sono stati seguiti attentamente e visitati a 6 settimane, 12 settimane e 24 settimane dopo il FESS (Fig. 1). I risultati del trattamento si basavano sulla valutazione dei seguenti test.
Test di esito SinoNasal a 20 item (SNOT-20) Il test di esito SinoNasal a 20 item (SNOT-20) è un questionario per valutare la qualità della vita (QoL) nei pazienti con rinosinusite.
Scala analogica visiva
La gravità della malattia è stata valutata attraverso la valutazione soggettiva dei pazienti sulla scala analogica visiva (VAS) di 10 cm; 1 cm sulla scala rifletteva 1 punto della valutazione del paziente; da 0 a 3 punti corrispondevano a malattia lieve, da 3 a 7 punti corrispondevano a malattia moderata, e da 7 a 10 punti corrispondevano a malattia grave.
Test olfattivo
Il “test Sniffin Sticks,” versione estesa (Burghart Messtechnik GmbH, Wedel, Germania) è stato utilizzato per ogni paziente. L'identificazione degli odori è stata valutata tramite 16 provette con odori diversi. Il numero di risposte corrette era correlato al grado di disturbo olfattivo, con 16 che rappresentava il punteggio massimo possibile. Un punteggio da 0 a 6 riflette l'anosmia, un punteggio da 7 a 12 è definito iposmia, mentre un punteggio che va da 13 a 16 è normale.
Test del tempo di transito della sacarina
Questo test misura il tempo di transito per una particella di sacarina per passare dalla testa anteriore del turbinato nasale inferiore alla faringe quando il paziente sperimenta per la prima volta la sensazione di un sapore dolce.
Endoscopia nasale
L'endoscopia è stata eseguita con un endoscopio rigido da 2,7 mm (Karl Storz, Tuttlingen, Germania) senza decongestione. Sono stati registrati punteggi semiquantitativi per polipi, edema, secrezione, croste e cicatrici alla baseline, 6 settimane, 12 settimane e alla valutazione finale 24 settimane dopo FESS. Questi risultati sono stati valutati utilizzando un punteggio di aspetto endoscopico (EAS). I polipi sono stati classificati per dimensione da 0 a 3 punti; l'assenza di polipi è stata valutata come 0, i polipi che apparivano solo nel meato medio sono stati valutati come 1; i polipi che si estendevano oltre il meato medio ma non ostruivano il naso sono stati valutati come 2; e i polipi che ostruivano completamente il naso sono stati valutati come 3. La secrezione è stata valutata come segue: 0 = nessuna secrezione; 1 = secrezione chiara e sottile; e 2 = secrezione spessa e purulenta. L'edema mucosale è stato valutato come segue: 0 = assente; 1 = lieve; 2 = severo. Croste e cicatrici nella cavità post-operatoria sono state valutate come segue: 0 = assente; 1 = lieve; e 2 = severo; questi risultati sono stati valutati separatamente per la cavità nasale destra e sinistra.
Rinomanometria anteriore attiva e rinometria acustica
La rinomanometria anteriore attiva (AAR) e la rinometria acustica (AR) sono state eseguite con il dispositivo SRE 2000 (Rhinometrics, Lynge, Danimarca), che ha permesso di effettuare entrambi i test: l'AAR ha valutato oggettivamente sia la resistenza nasale che il flusso d'aria nasale, mentre l'AR ha riflesso la geometria e il volume dell'intera cavità nasale.
Tomografia computerizzata multislice La tomografia computerizzata multislice (CT) del naso e dei seni paranasali è stata eseguita prima e 6 mesi dopo FESS su tutti i pazienti. Sono stati ottenuti tagli di mezzo centimetro (5 mm) sia nei piani assiale che coronale. Il grado di opacizzazione di un particolare seno (0-2) e del complesso ostiomeatale (0 = intatto, 2 = occluso) sono stati calcolati utilizzando il sistema di punteggio Lund-Mackay.
Proteina cationica eosinofila
I contenuti di proteina cationica eosinofila (ECP) nella secrezione nasale sono stati misurati utilizzando un kit di raccolta con dati generati dall'analizzatore automatico chemioluminescente IMMULITE 1000 (Siemens Healthcare Diagnostics Inc, NY, USA). Per raccogliere il muco, un pezzo di spugna di gomma piuma sterile di dimensioni 20 × 20 × 5 mm è stato introdotto nel meato medio per 20 minuti. Dopo la rimozione, la spugna è stata posta in un tubo da test di 10 mL e centrifugata per 3 minuti a una velocità di 4000 rpm, consentendo la raccolta di 0,2 a 1,0 mL di muco per ulteriori analisi. La sensibilità del test era di 0,2 ng/mL.
Test microbiologici
È stato prelevato un tampone nasale per test microbiologici dal meato nasale medio prima della FESS e a tutte le visite postoperatorie. I test di coltura e sensibilità (resistenza) sono stati eseguiti utilizzando l'analizzatore batteriologico Walk Away-40 (Dade Behring, Marburg, Germania) e il metodo della diffusione su disco (dischi Becton Dickinson con claritromicina, USA). I risultati sono stati valutati secondo le raccomandazioni del CLSI (clinical and laboratory standards institute).
Test cutanei a puntura
I test cutanei a puntura per allergeni indoor e outdoor sono stati eseguiti in tutti i pazienti utilizzando metodi standard.
Valutazione finale dei risultati del trattamento
La valutazione finale dei risultati del trattamento è stata effettuata utilizzando le variazioni dei punteggi EAS e Lund-Mackay CT a 24 settimane dopo la FESS.
Analisi statistica
Dopo aver consultato un statistico medico, i risultati ottenuti sono stati inseriti in un database informatico e elaborati utilizzando il pacchetto software statistico SPSS versione 17.0 per Windows. Sono stati eseguiti test dei ranghi firmati di Wilcoxon per valutare gli effetti del trattamento in vari punti temporali. I valori sono stati presentati come medie ± deviazioni standard. Le variazioni all'interno e tra i gruppi sono state considerate statisticamente significative quando i valori p erano <0.05.
Risultati
Undici pazienti sono stati esclusi dallo studio per vari motivi: 8 pazienti nel gruppo 2 (antibiotici per 12 settimane) sono stati ritirati. Un paziente ha sviluppato dolore addominale dopo l'inizio della terapia con claritromicina; un secondo paziente è stato ritirato a causa di incubi iniziati 3 giorni dopo l'inizio del trattamento con claritromicina. Una donna nello stesso gruppo ha sviluppato un'esacerbazione di duodenite erosiva 2 mesi dopo l'arruolamento ed è stata ritirata, mentre 5 altri sono stati ritirati a causa di non conformità. Una paziente nel gruppo 3 (controllo senza antibiotici) è stata esclusa a causa di gravidanza e 2 altri in questo gruppo sono stati ritirati a causa di non conformità. Pertanto, 55 pazienti hanno completato lo studio e all'ultimo controllo tutti i 22 pazienti nel gruppo 1 (antibiotici per 24 settimane) hanno completato lo studio, 14 pazienti sono rimasti nel gruppo 2 (antibiotici per 12 settimane) e 19 pazienti sono rimasti nel gruppo 3 (controllo senza antibiotici).
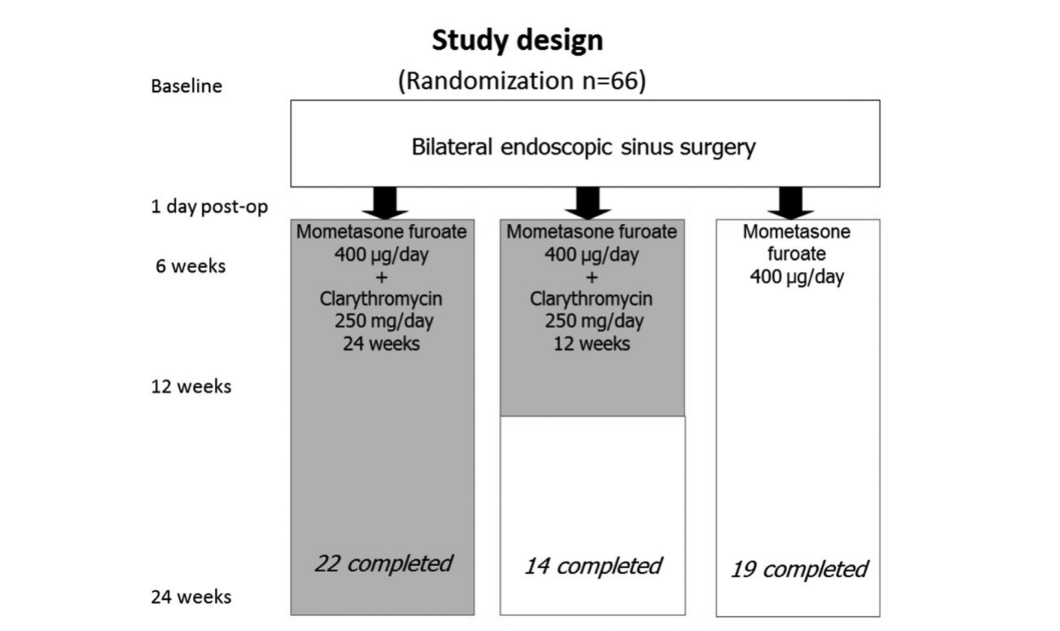
Trentacinque pazienti avevano BA e 27 di questi 35 pazienti presentavano AERD. L'atopia è stata confermata da test cutanei prick in 19 dei 66 pazienti iniziali. Non ci sono state differenze significative tra i 3 gruppi riguardo all'età, sesso, presenza di atopia, gravità della malattia e numero di interventi chirurgici precedenti, così come tutti gli altri parametri iniziali che abbiamo esaminato. Le caratteristiche di base di ciascuno dei 3 gruppi di trattamento: gruppo 1 (antibiotici per 24 settimane), gruppo 2 (antibiotici per 12 settimane) e gruppo 3 (controllo senza antibiotici) sono presentate nella Tabella 1.
I risultati del trattamento sono stati migliori per i pazienti che hanno completato il corso di trattamento a lungo termine con claritromicina nel gruppo 1 (antibiotici per 24 settimane) e nel gruppo 2 (antibiotici per 12 settimane) rispetto ai pazienti del gruppo 3 (controllo senza antibiotici).
Differenze statisticamente significative (p < 0.05) sono state ottenute per tutti i parametri (ma non ad ogni visita) tra i gruppi di farmaci dello studio 1 e 2 e il gruppo 3 (controllo senza antibiotici) con l'unica eccezione per VAS e AR dove non è stata raggiunta evidenza statisticamente significativa.
SNOT-20
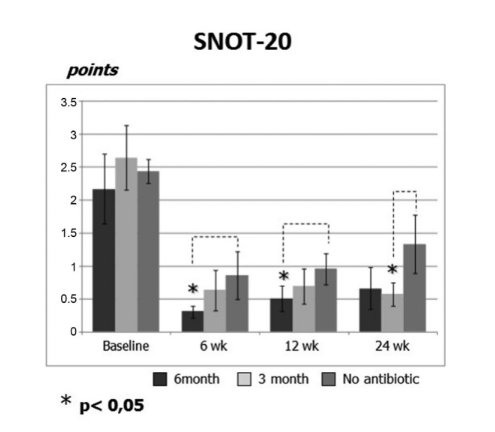
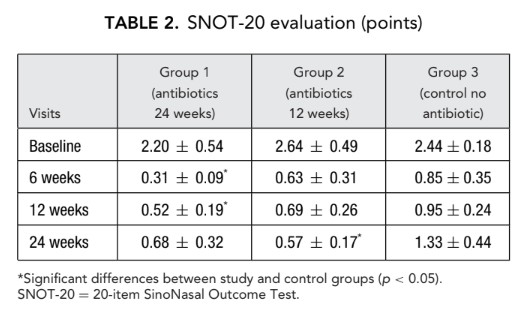
I punteggi iniziali SNOT-20 erano 2.20 ± 0.54 nel gruppo 1 (antibiotici per 24 settimane), 2.64 ± 0.49 nel gruppo 2 (antibiotici per 12 settimane) e 2.44 ± 0.18 nel gruppo 3 (controllo senza antibiotici). Dopo il FESS, la QoL è migliorata e la gravità dei sintomi della rinosinusite è stata alleviata in tutti i soggetti dello studio. Tuttavia, i punteggi SNOT-20 dei pazienti nel gruppo 1 (antibiotici per 24 settimane) alle visite 6 settimane e 12 settimane dopo il FESS (0.31 ± 0.09 e 0.52 ± 0.19, rispettivamente) così come i punteggi SNOT-20 dei pazienti nel gruppo 2 (antibiotici per 12 settimane) all'ultima visita (0.57 ± 0.17) erano significativamente migliori rispetto ai pazienti del gruppo 3 (controllo senza antibiotici) nelle stesse visite; 0.85 ± 0.35, 0.95 ± 0.24 e 1.33 ± 0.44, rispettivamente (p < 0.05), (Fig. 2, Tabella 2).
Punteggi VAS
Le differenze nei cambiamenti dei punteggi VAS tra il gruppo di studio (gruppi 1 e 2) e il gruppo di controllo (gruppo 3 senza antibiotici) non hanno raggiunto significatività statistica (Tabella 3).
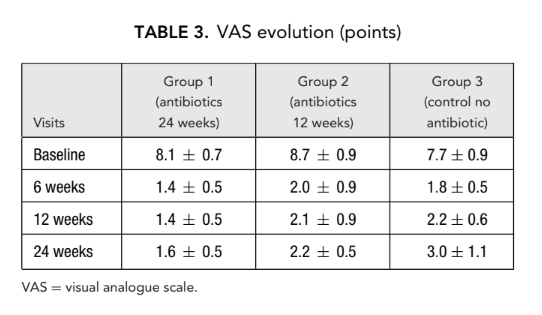
Test olfattivo
Una grave disfunzione olfattiva è stata rilevata in tutti i soggetti dello studio prima della FESS. È stata notata una perdita completa o quasi completa della capacità di identificare gli odori (anosmia) quando il naso era totalmente ostruito (bloccato) da polipi nasali diffusi. Nessuno di questi 66 pazienti ha ricevuto steroidi sistemici prima della FESS. Durante la seconda e la terza visita, l'olfatto è migliorato significativamente in tutti e 3 i gruppi di pazienti, sebbene nessun paziente abbia raggiunto valori normali. Una differenza statisticamente significativa nel numero medio di risposte corrette (p < 0.05) è stata rivelata solo tra il gruppo 1 (antibiotici per 24 settimane) (9.5 ± 1.3) e il gruppo 3 (controllo senza antibiotici) (4.4 ± 0.5) alla seconda visita 6 settimane dopo l'intervento (Tabella 4).
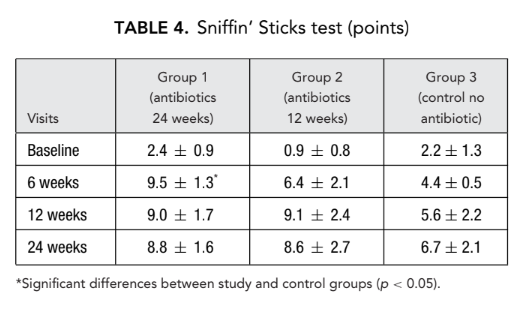
Tempo di transito del saccarina
Allo stesso modo, 12 settimane dopo l'intervento chirurgico è stata osservata una significativa riduzione (miglioramento) del tempo di transito del saccarina nel gruppo 1 (antibiotici per 24 settimane) (13.6 ± 3.0 minuti) rispetto al gruppo 3 (controllo senza antibiotici) (21.0 ± 4.1 minuti) (Tabella 5).
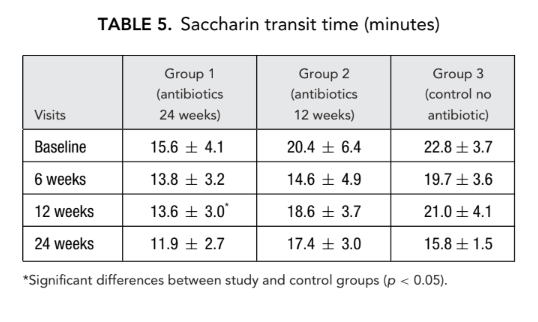
AR e AAR
Non c'era alcuna differenza significativa nei parametri di rinometria acustica (volume della cavità nasale, area minima trasversale) tra tutti i gruppi. Tuttavia, la resistenza nasale misurata mediante rinomanometria anteriore nel gruppo 1 (antibiotici per 24 settimane) e nel gruppo 2 (antibiotici per 12 settimane) era significativamente più bassa (migliore respirazione) (0.23 ± 0.02 e 0.19 ± 0.02 Pa/cm3/secondo, rispettivamente) rispetto al gruppo 3 (controllo senza antibiotici) (1.94 ± 1.50 Pa/cm3/secondo) al termine (Tabelle 6 e 7).
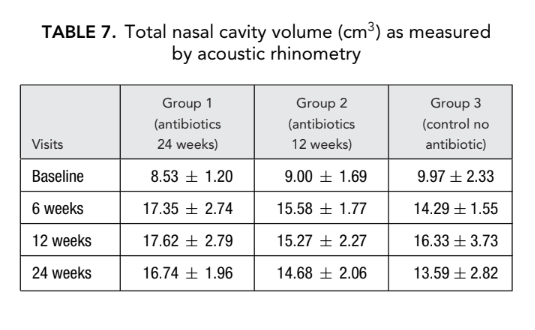
TC scans
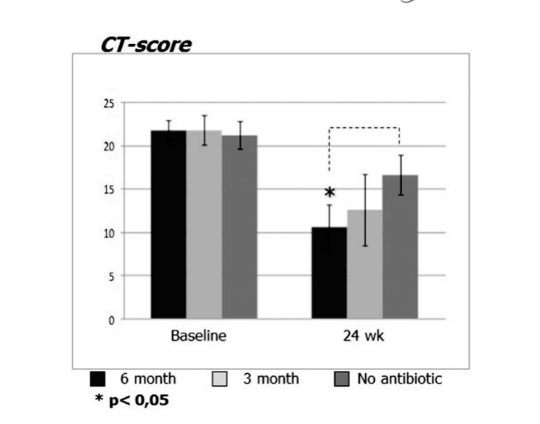
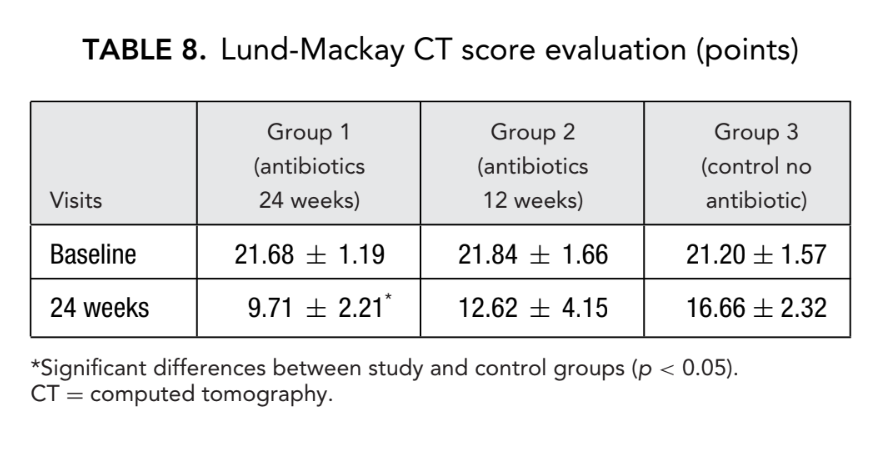
Prima dell'inizio del trattamento, i valori medi per il punteggio di Lund-Mackay nei primi, secondi e terzi gruppi di pazienti non differivano significativamente, essendo rispettivamente 21.68 ± 1.20, 21.84 ± 1.66 e 21.2 ± 1.57. Il punteggio medio di opacificazione dei seni paranasali sulle TC è diminuito drasticamente (migliorato) in tutti e 3 i gruppi 6 mesi dopo FESS. Tuttavia, una differenza significativa è stata osservata solo tra il gruppo 1 (antibiotici per 24 settimane) con un punteggio medio di 9.71 ± 2.21, e il gruppo 3 (controllo senza antibiotici) con un punteggio medio di 16.66 ± 2.32 (p < 0.05). Nel gruppo 2 (antibiotici per 12 settimane) il punteggio medio era 12.62 ± 4.15, ma questa differenza non ha raggiunto significatività statistica (Fig. 3, Tabella 8).
Endoscopia nasale
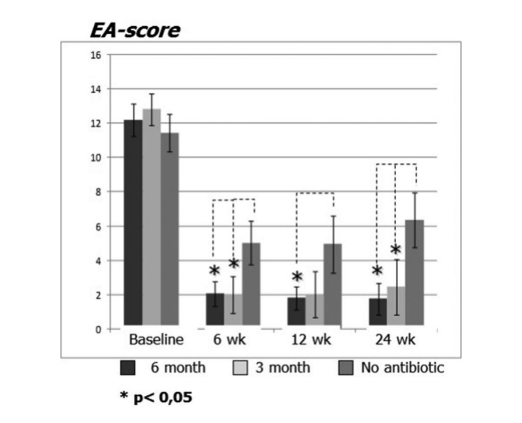
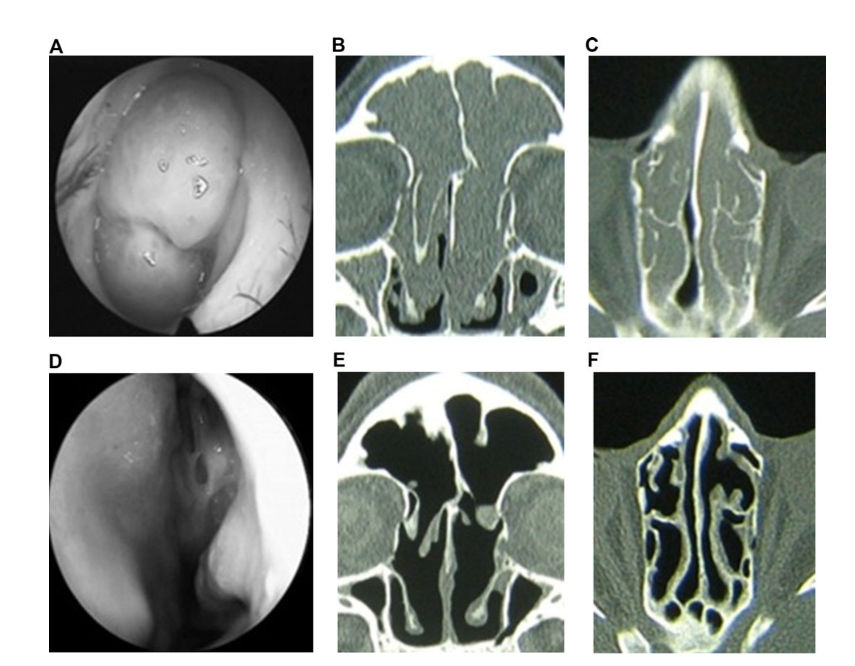
I pazienti in terapia con claritromicina nel gruppo 1 (antibiotici per 24 settimane) e nel gruppo 2 (antibiotici per 12 settimane) hanno mostrato un miglior EAS ad ogni visita rispetto ai pazienti del gruppo 3 che non hanno assunto antibiotici (Fig. 4, Tabella 9). Ventiquattro settimane dopo l'intervento, la media degli EAS era: 1.52 ± 0.87 nel gruppo 1 (antibiotici per 24 settimane) e 2.42 ± 1.61 nel gruppo 2 (antibiotici per 12 settimane), e questi risultati erano significativamente migliori rispetto al gruppo 3 (controllo senza antibiotici) 6.35 ± 1.58 (p < 0.05) (Fig. 4, Tabella 9). Uno dei casi più impressionanti che dimostrano l'efficacia della terapia macrolide a lungo termine post-operatoria è presentato nella Figura 5.
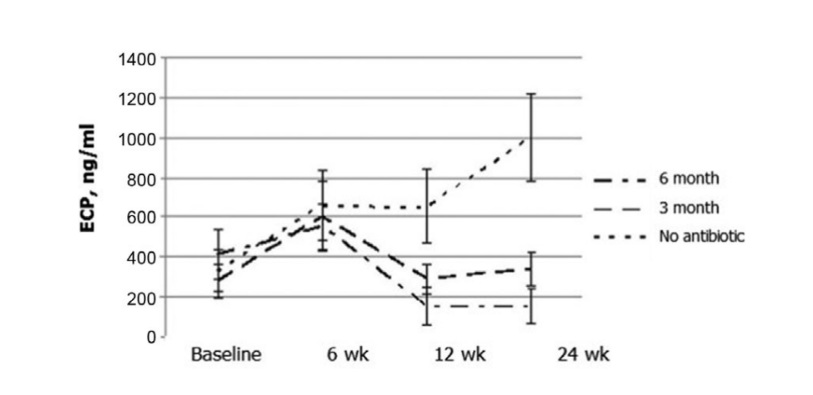
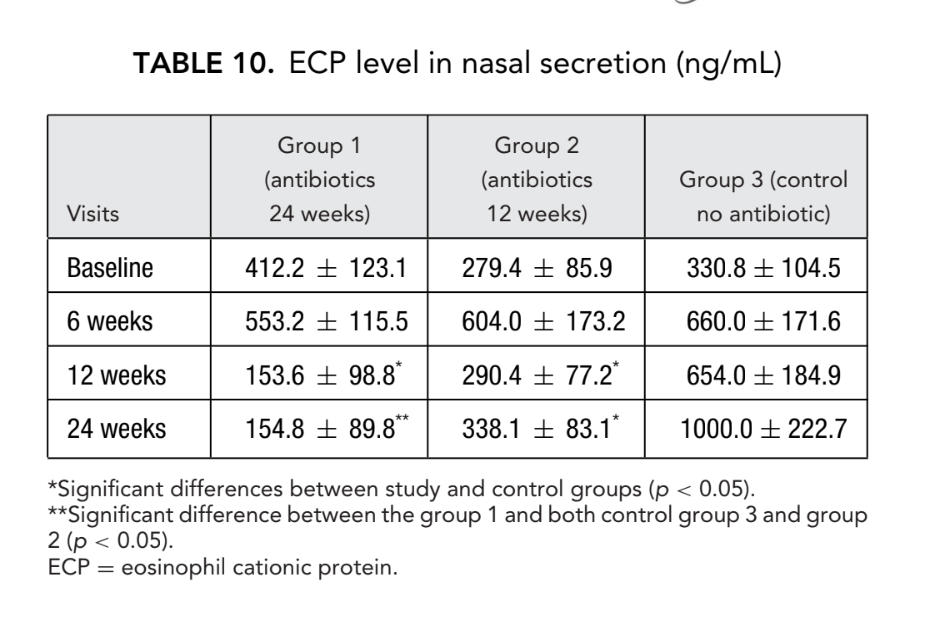
I risultati più notevoli si sono verificati nella valutazione della concentrazione di ECP post-operatori. Prima dell'intervento, i valori mediani delle concentrazioni di ECP nei 3 gruppi di pazienti non differivano significativamente, essendo rispettivamente 412.2 ± 123.1, 279.4 ± 85.9 e 330.8 ± 104.5. Sei settimane dopo l'intervento, il livello di ECP nelle secrezioni nasali è aumentato in tutti i pazienti dello studio, essendo 553.2 ± 115.5, 604.0 ± 173.2 e 660.0 ± 171.6 ng/mL nei gruppi 1, 2 e 3, rispettivamente. Dodici settimane dopo la FESS, è stata chiaramente osservata una significativa diminuzione del livello di ECP nelle secrezioni nasali nel gruppo 1 (antibiotici per 24 settimane): 153.6 ± 98.8 ng/mL (p = 0.028), e nel gruppo 2 (antibiotici per 12 settimane): 290.4 ± 77.2 ng/mL (p = 0.036). Il livello di ECP nelle secrezioni nasali nei pazienti del gruppo 3 (controllo senza antibiotici) non è cambiato significativamente ed è stato registrato come 654.0 ± 184.9 ng/mL (p = 0.25). Solo nel gruppo 1 (antibiotici per 24 settimane) la concentrazione di ECP è rimasta allo stesso basso livello (154.8 ± 89.8 ng/mL) a 24 settimane. Nel gruppo 2 (antibiotici per 12 settimane) c'è stato un leggero aumento dei livelli di ECP fino a 338.1 ± 83.1 ng/mL (p = 0.084) quando questi pazienti sono stati studiati a 24 settimane (3 mesi dopo la sospensione degli antibiotici); tuttavia, con un valore di p di 0.084, la differenza non era statisticamente significativa. Il livello medio di ECP nelle secrezioni nasali nel gruppo 3 (controllo senza antibiotici) è aumentato significativamente a 1000.0 ± 222.7 ng/mL (p = 0.041) (Fig. 6, Tabella 10).
È importante notare che il livello di ECP nei pazienti trattati con i macrolidi per un intero periodo di 6 mesi (gruppo 1) era significativamente più basso rispetto ai pazienti del gruppo 2, che hanno interrotto la terapia antibiotica dopo 3 mesi di trattamento.
Effetti collaterali erano rari, con interruzione della terapia antibiotica richiesta solo in 3 pazienti. I livelli degli enzimi epatici (alanina transaminasi [ALT], aspartato aminotransferasi [AST] e fosfatasi alcalina [ALP]) sono rimasti normali in tutti i pazienti.
Lo studio microbiologico dei tamponi prelevati dal meato medio ha rivelato un ampio spettro di batteri. L'organismo più comune era Staphylococcus aureus (30% dei pazienti), seguito da Staphylococcus epidermidis (25%), Streptococcus haemolyticus (11%), Escherichia coli (9%), Pseudomonas aeruginosa (6%) e Enterobacter aerogenes (6%). Lo spettro batterico è cambiato significativamente dopo l'intervento chirurgico, ma la proporzione tra ceppi resistenti alla claritromicina (13%) e ceppi sensibili alla claritromicina (87%) è rimasta la stessa. Alla conclusione dello studio, alcuni ceppi batterici sensibili ai macrolidi hanno acquisito resistenza alla claritromicina. È interessante notare che si è verificato anche un fenomeno opposto; inizialmente alcuni ceppi batterici resistenti ai macrolidi sono stati sostituiti da alcuni ceppi batterici sensibili ai macrolidi. In generale, il numero di ceppi resistenti alla claritromicina (13%) è rimasto costante durante tutto il corso del trattamento a lungo termine con claritromicina.
Discussione
Le attuali evidenze supportano l'idea che il trattamento a lungo termine a basse dosi con macrolidi sia efficace quando riservato ai pazienti con CRS non atopico recalcitrante nei quali gli steroidi nasali topici e le irrigazioni saline non sono riusciti a controllare i sintomi. Nei pazienti con CRSwNP atopico, la terapia con macrolidi per BA e AERD non è stata utile.
Nella letteratura più recente, la terapia a lungo termine con macrolidi a basse dosi è stata riportata come efficace nel CRS, inclusi quei pazienti con livelli elevati di immunoglobulina E (IgE) e BA. Uno studio prospettico recente ha dimostrato che un ciclo di terapia con claritromicina di 8 settimane era altrettanto efficace sia nei pazienti atopici che in quelli non atopici con poliposi nasale. In uno studio retrospettivo, i pazienti con CRS e atopia hanno risposto bene al trattamento a lungo termine con macrolidi, mentre i pazienti fumatori hanno avuto il peggior esito terapeutico.
I risultati del nostro studio hanno dimostrato che la terapia a lungo termine con macrolidi a basse dosi previene la recidiva precoce dei polipi nasali dopo FESS, inclusi i pazienti con atopia e BA. C'era una chiara correlazione tra atopia e gravità della malattia poiché i nostri pazienti atopici avevano punteggi VAS più elevati (coefficiente di correlazione di rango di Spearman 0.332; p = 0.01). La presenza di atopia era correlata a livelli più elevati di ECP nella secrezione nasale (0.834; p = 0.01). Questi risultati suggeriscono che la gravità dei sintomi è direttamente correlata all'intensità dell'infiammazione eosinofila. Sfortunatamente, non abbiamo indagato i livelli totali di IgE nella maggior parte dei pazienti; pertanto, l'analisi dei sottogruppi di quei pazienti con bassi livelli di IgE non è stata possibile.
Un risultato di studio particolarmente notevole è stato il cambiamento dei livelli di ECP nelle secrezioni nasali dopo FESS e durante il periodo post-operatorio con terapia macrolide. Nel gruppo 3 (controllo senza antibiotici) abbiamo notato un aumento di quasi 3 volte del livello medio di ECP 6 settimane dopo l'intervento. Questo risultato di un livello elevato di ECP dopo FESS in questi pazienti del gruppo 3 riflette un'esacerbazione dell'infiammazione eosinofila causata dall'intervento che non poteva essere adeguatamente controllata solo con steroidi topici intranasali. D'altra parte, nei gruppi di trattamento 1 (antibiotici per 24 settimane) e 2 (antibiotici per 12 settimane) c'è stata una graduale diminuzione dei livelli di ECP con il trattamento a lungo termine con claritromicina a basso dosaggio, che riflette il controllo e la riduzione dell'infiammazione eosinofila.
Uno degli obiettivi di questo lavoro era studiare l'efficacia di un trattamento più lungo (6 mesi) rispetto a un corso relativamente breve (3 mesi) di terapia macrolide a basso dosaggio. I dati suggerivano qualche beneficio da un corso antibiotico più lungo, ma la differenza tra il gruppo 1 (antibiotico 24 settimane) e il gruppo 2 (antibiotico per 12 settimane) non ha raggiunto la significatività statistica nella maggior parte dei pazienti. Tuttavia, ci sono alcune evidenze che una durata di trattamento più lunga nel gruppo 1 (antibiotici 24 settimane) sembra essere più efficace rispetto a un corso più breve osservato nel gruppo 2 (antibiotici per 12 settimane).
I punteggi CT per il gruppo 1 (antibiotici 24 settimane) erano 9.71 ± 2.21, che era significativamente inferiore rispetto al gruppo 3 (controllo senza antibiotici), con letture di 16.66 ± 2.32 al termine. La differenza tra il gruppo 2 (antibiotici per 12 settimane) e il gruppo 3 (controllo senza antibiotici) non ha raggiunto la significatività statistica (Tabella 8). Ci sono state differenze significative nei livelli medi di ECP nei gruppi
1 e 2 al termine, confermando indirettamente che un ciclo di antibiotici di 6 mesi riduce l'infiammazione eosinofila, prevenendo così la recidiva precoce dei polipi nasali. Ovviamente, l'uso di steroidi orali sarebbe certamente considerato lo standard di cura negli Stati Uniti e in alcuni altri paesi occidentali, specialmente nel contesto di un'esacerbazione postoperatoria dell'infiammazione eosinofila. Tuttavia, in paesi come la Russia, dove la terapia corticosteroidea sistemica nella CRSwNP è estremamente rara, la terapia a lungo termine con macrolidi potrebbe essere un'opzione alternativa poiché comporta un rischio minore di effetti collaterali sistemici.
Non abbiamo riscontrato un aumento delle colture batteriche resistenti ai macrolidi dal meato medio dopo un trattamento a lungo termine a basso dosaggio di 250 mg/giorno di terapia con claritromicina, in accordo con studi precedenti che non hanno trovato microorganismi resistenti dopo un trattamento a lungo termine con azitromicina ed eritromicina. Naturalmente, il rischio di sviluppare ceppi batterici resistenti agli antibiotici indotti dalla terapia a lungo termine con macrolidi è sempre possibile.
Sebbene un braccio placebo non fosse stato progettato nel nostro protocollo e i pazienti non fossero stati accecati durante la ricezione di terapie aggiuntive, abbiamo valutato 6 diversi metodi oggettivi in tutti e 3 i gruppi di studio. Tutti gli investigatori erano accecati durante la valutazione e la classificazione dei risultati dell'endoscopia nasale, delle scansioni TC e di tutti gli altri test. Uno studio futuro randomizzato, in doppio cieco e controllato con placebo, con un ampio campione, sarebbe necessario per determinare l'efficacia della terapia a lungo termine con macrolidi, in particolare nella prevenzione della ricorrenza dei polipi nasali dopo FESS. Inoltre, tale studio potrebbe auspicabilmente prevedere quali pazienti con CRSwNP trarrebbero beneficio dal trattamento antibiotico a lungo termine e se questo trattamento aumenti il rischio di indurre una resistenza batterica significativa.
Conclusione
I risultati di questo studio hanno dimostrato l'efficacia e la relativa sicurezza della terapia a lungo termine (6 mesi) con macrolidi a bassa dose (250 mg/giorno) (claritromicina) per prevenire la recidiva precoce di polipi nasali nei pazienti con CRSwNP dopo FESS. Nonostante i dati clinici limitati, le nostre evidenze suggeriscono che i pazienti con CRSwNP ricorrente (fallimenti chirurgici) meritano un tentativo di trattamento con claritromicina a bassa dose (250 mg al giorno per 3-6 mesi), che può essere iniziato immediatamente dopo FESS insieme alla terapia di mantenimento con steroidi nasali topici.
Riferimenti
- Hedman J, Kaprio J, Poussa T, Nieminen MM. Prevalenza di asma, intolleranza all'aspirina, poliposi nasale e broncopneumopatia cronica ostruttiva in uno studio basato sulla popolazione. Int J Epidemiol. 1999;28:717–722.
- Settipane G. Epidemiologia dei polipi nasali. In: Settipane G, Lund VJ, Bernstein JM, Tos M, eds. Polipi Nasali: Epidemiologia, Patogenesi e Trattamento. Providence, RI: Oceanside Publications; 1997:17– 24.
- Ogino S, Harada T, Okawachi I, Irifune M, Matsunaga T, Nagano T. Asma indotta da aspirina e polipi nasali. Acta Otolaryngol Suppl. 1986;430:21– 27.
- Fokkens W, Lund V, Mullol J. Gruppo di lavoro sulla posizione europea su rinosinusite e polipi nasali. Documento di posizione europeo sulla rinosinusite e polipi nasali 2007. Rhinol Suppl. 2007;(20):1–136.
- Desrosiers MY, Kilty SJ. Alternative terapeutiche per la rinosinusite cronica persistente dopo ESS: cosa fare quando antibiotici, steroidi e chirurgia falliscono. Rhinology. 2008;46:3–14.
- Kudoh S, Uetake T, Hagiwara K, et al. Effetto clinico della chemioterapia a lungo termine con eritromicina a bassa dose sulla bronchiolite panvascolare diffusa (Abstract in inglese). Jpn J Thorac Dis. 1984;25:632–642.
- Kudoh S, Asuma A, Yamamoto M, Izumi T, Ando M. Miglioramento della sopravvivenza nei pazienti con bronchiolite panvascolare diffusa trattati con eritromicina a bassa dose. Am J Respir Crit Care Med. 1998;157:1829– 1832.
- Cervin A, Wallwork B. Terapia con macrolidi per la rinosinusite cronica. Rhinology. 2007;45:259– 267.
- Cervin A, Wallwork B, Mackay-Sim A, Coman WB, Greiff L. Effetti del trattamento a lungo termine con claritromicina sui marcatori di infiammazione nel lavaggio in rinosinusite cronica. Clin Physiol Funct Imaging. 2009;29:136–142.
- Stjarne P, Ollson P, Alenius M. Uso di mometasone furoato per prevenire la recidiva di polipi dopo chirurgia endoscopica dei seni. Arch Otolaryngol Head Neck Surg. 2009;135:296–302.
- Piccirillo J, Merritt M, Richards M. Validità psicometrica e clinimetrica del test di esito sino-nasale a 20 item (SNOT-20). Otolaryngol Head Neck Surg. 2001;126:41–47.
- Hummel T, Kobal G, Gudziol H, Mackay-Sim A. Dati normativi per i “Sniffin’ Sticks” inclusi test di identificazione degli odori, discriminazione degli odori e soglie olfattive: un aggiornamento basato su un gruppo di oltre 3.000 soggetti. Eur Arch Otorhinolaryngol. 2007;264:237–243.
- Lund VJ, Mackay IS. Staging nella rinosinusite. Rhinology. 1993;31:183–184.
- Fokkens WJ, Lund VJ, Mullol J, et al. Documento di posizione europeo sulla rinosinusite e polipi nasali 2012.
- Rhinol Suppl. 2012;(23):3 p prima dell'indice, 1–298.
- Wallwork B, Coman W, Mackay-Sim A, Greiff L, Cervin A. Uno studio in doppio cieco, randomizzato, controllato con placebo sui macrolidi nel trattamento della rinosinusite cronica. Laryngoscope. 2006;116:189– 193.
- Haruna S, Shimada C, Ozawa M, Fukami S, Moriyama H. Uno studio sui rispondenti scarsi per la somministrazione a lungo termine di macrolidi a bassa dose per la sinusite cronica. Rhinology. 2009;47:66–71.
- Videler WJ, Badia L, Harvey RJ, et al. Mancanza di efficacia dell'azitromicina a lungo termine e a bassa dose nella rinosinusite cronica: studio controllato randomizzato. Allergy. 2011;66:1457–1468.
- Peric A, Vojvodic D, Baletic N, Peric A, Miljanovic O. Influenza dell'allergia sugli effetti immunomodulatori e clinici del trattamento a lungo termine con macrolidi a bassa dose della poliposi nasale. Biomed Pap Med Fac Univ Palacky Olomouc Repubblica Ceca. 2010;154:327–334.
- Videler WJ, van Hee SM, Reinartz C, Georgalas FW, Meulen K, Fokkens WJ. Antibiotici a lungo termine e a bassa dose nella rinosinusite cronica recalcitrante: un'analisi retrospettiva. Rhinology. 2012;50:45–55.
- Cervin A, Kalm O, Sandkull P, Lindberg S. Trattamento con eritromicina a bassa dose per un anno della sinusite cronica persistente dopo chirurgia sinusale: esito clinico ed effetti sui parametri mucociliari e ossido nitrico nasale. Otolaryngol Head Neck Surg. 2002;126:481–489.
