Scaffold in poli(ε-caprolattone) e diacrilato di polietilene glicole per impianti bioingegnerizzati del disco ATM
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract
Il'articolazione temporomandibolare (ATM), articolazione tra il condilo mandibolare e l'osso temporale, è divisa in due compartimenti (superiore e inferiore) da un disco fibrocartilagineo. Il disco dell'ATM è composto da un tessuto avascolare e non innervato, con comportamento viscoelastico. Meccanicamente, il disco dell'ATM subisce forze di trazione, compressione e taglio. Lo spostamento o la degenerazione del disco dell'ATM potrebbero portare a gravi disturbi intra-articolari dell'articolazione temporomandibolare (TMD). Nonostante il gran numero di terapie/trattamenti attuali, ci sono opzioni di trattamento limitate per il TMD intra-articolare grave. Una strategia per risolvere questo problema potrebbe essere l'uso di un materiale interposizionale per sostituire il disco dell'ATM danneggiato, che degraderà gradualmente e darà origine a nuovo tessuto. In questo lavoro sono state utilizzate e testate tre opzioni, una utilizzando un materiale termoplastico, poli(ε-caprolattone) (PCL), un'altra utilizzando un idrogel fotopolimerizzato, diacrilato di polietilene glicole (PEGDA) e la terza utilizzando la combinazione dei due materiali. I risultati ottenuti hanno dimostrato che la combinazione di diversi materiali potrebbe rappresentare un vantaggio significativo nella TE del disco dell'ATM e nella TE della cartilagine in generale.
Introduzione
Il temporomandibolare (TMJ) è un'articolazione bilaterale tra il processo condiloide della mandibola e la fossa mandibolare e il tubercolo articolare dell'osso temporale. Un disco fibrocartilagineo è interposto tra le strutture ossee attaccate alla capsula fibrosa al suo margine, che divide l'articolazione in due cavità: superiore e inferiore.
Il disco TMJ è composto da un tessuto fibrocartilagineo avascolare e non innervato, con comportamento viscoelastico. Il disco presenta una forma ellittica, più lunga nella direzione mediolaterale rispetto a quella anteroposteriore (19 e 13 mm rispettivamente, negli esseri umani). Anatomicalmente, il disco TMJ può essere diviso in tre regioni: banda anteriore, zona intermedia e banda posteriore. La zona intermedia è considerevolmente più sottile delle bande (≈1 mm, negli esseri umani), e la banda posteriore è la regione più spessa del disco (≈4 mm, negli esseri umani). La frazione principale del disco TMJ è composta da acqua (≈73 %). Oltre all'acqua, il disco TMJ è composto da cellule (fibroblasti, fibrocyti e cellule simili a condrociti, con una forma rotonda) e una matrice extracellulare (ECM) di fibre di collagene dense (≈80 % per peso secco), fibre elastiche (≈2 %) e glicosaminoglicani.
Questa forma biconcava si adatta all'anatomia ossea dell'articolazione ed è essenziale per le funzioni dell'ATM. Come in altre articolazioni, il disco dell'ATM riduce l'attrito nell'articolazione e distribuisce il carico intra-articolare. Inoltre, aiuta l'allineamento e la stabilizzazione dell'articolazione durante la rotazione e la traslazione grazie a una certa flessibilità fornita dalla regione intermedia. Il disco dell'ATM ha un comportamento viscoelastico e subisce forze di trazione, compressione e taglio. Le proprietà di compressione riportate del disco dell'ATM sono altamente inconsistenti, variando da decine a decine di migliaia di kPa. Per quanto riguarda le diverse regioni, le bande anteriore e posteriore sembrano avere proprietà di compressione superiori rispetto alla zona intermedia.
La degenerazione e lo spostamento del disco dell'ATM possono portare a disturbi dell'ATM (TMD). Si stima che il 25% della popolazione possa sperimentare sintomi di TMD, come: dolore nell'articolazione e nei muscoli circostanti; scatti; disagio nel muovere la mandibola; digrignare dei denti. La maggior parte dei TMD viene trattata con successo con trattamenti non invasivi (ad es.: fisioterapia, splint/aggiustamenti occlusali e farmacologia), ma, in alcuni casi, è necessario ricorrere alla chirurgia (ad es.: artrocentesi, artroscopia, discopexia, discectomia e sostituzione totale dell'articolazione).
L'anatomia equivalente all'ATM umano è stata studiata in diversi animali. Alcuni dei modelli più comuni includono maiale, pecora, capra, mucca, cane, ratto e coniglio. In questo lavoro, la geometria degli impianti del disco dell'ATM è stata ottenuta tramite ingegneria inversa del disco dell'ATM delle pecore Black Merino (Ovies aries).
Negli ultimi due decenni, il campo dell'Ingegneria Tissutale (TE) del disco dell'ATM è cresciuto come una soluzione promettente per i TMD, mirando alla riparazione e rigenerazione del disco. Sono stati sviluppati diversi approcci, utilizzando o meno impalcature, una varietà di materiali diversi e l'inclusione di alcuni fattori di crescita.
Le impalcature utilizzate nella TE del disco dell'ATM sono state prodotte in poliammide, acido poliglicolico (PGA), poli(glicerolo sebacato) (PGS), acido polilattico (PLA), acido poli-L-lattico (PLLA), politetrafluoroetilene (PTFE) e altri biomateriali naturali, come idrogeli di collagene e da dischi dell'ATM di maiale decellularizzati. Negli ultimi anni, a causa della loro lenta degradazione, le impalcature e le schiume di poli(ɛ-caprolattone) (PCL) sono state ampiamente investigate, considerando il lento tasso di rigenerazione del fibrocartilagineo.
Questo lavoro si concentra sullo sviluppo di un'impalcatura basata su PCL e PEGDA per un impianto di disco bioingegnerizzato dell'ATM, con proprietà simili ai tessuti nativi, prodotto con tecniche di prototipazione rapida e un approccio chirurgico fattibile.
Materiali & Metodi
Diversi impalcature sono state prodotte utilizzando tecniche di ingegneria inversa e produzione additiva, al fine di sostituire e promuovere la rigenerazione della matrice extracellulare del disco dell'ATM. In questa indagine sono stati prodotti tre tipi di matrici 3D: i) idrogelo PEGDA attraverso fotopolimerizzazione, ii) impalcature PCL utilizzando modellazione a deposizione fusa (FDM), iii) combinazione di entrambi.
Produzione di impalcature in poli (ɛ-caprolattone)
Il poli (ɛ-caprolattone) (PCL) è un poliestere biocompatibile e biodegradabile (12-24 mesi), che ha dimostrato di essere in grado di supportare una vasta varietà di tipi cellulari ed è un materiale approvato dalla Food and Drug Administration (FDA). Il processo di estrusione o modellazione a deposizione fusa (FDM) consiste nell'estrusione di un materiale (termo)plastico o cera, in questo caso PCL (come filamento o pellet), attraverso un ugello che disegna il livello desiderato strato per strato. Riscaldatori resistivi che coprono il canale di alimentazione e l'ugello vengono utilizzati per mantenere il materiale appena sopra il suo punto di fusione (circa 60ºC per PCL). Questo consente al materiale di fluire facilmente attraverso l'ugello, legandosi allo strato sottostante e raggiungendo una rapida solidificazione.
Nel primo esperimento, è stata studiata l'influenza della temperatura dell'ugello sul comportamento meccanico degli scaffold. Così, sono stati prodotti scaffold in PCL 6500 (Perstorp) (n=4) utilizzando la macchina BioExtruder (CDRSP, Leiria, Portogallo) con una temperatura dell'ugello di 80ºC (gruppo T80) e 86ºC (gruppo T60). Inoltre, le temperature del sistema di deposito e di corsa/sgocciolamento erano, rispettivamente, 80ºC e 100ºC, l'ugello utilizzato aveva un diametro di 300 μm e le velocità di deposizione e della testa trasversale erano di 14,5 rpm e 10 mm∙s-1, rispettivamente. Gli scaffold finali in PCL, la cui geometria è stata ottenuta tramite ingegneria inversa di un disco TMJ di pecora, avevano una base di 278 ± 2 mm2 e uno spessore della fetta di 280 μm.
Produzione di idrogeli PEGDA
Il polietilenglicole, PEG, è una catena polimerica biocompatibile, idrofila, neutra e altamente mobile che è stata utilizzata nella TE di ossa e cartilagine, tra le altre applicazioni biomediche, come i sistemi di rilascio controllato di farmaci. Il diacrilato di polietilenglicole, PEGDA, è un derivato del PEG che può essere facilmente manipolato in idrogeli tramite fotopolimerizzazione utilizzando fotoiniziatori biocompatibili, come il DMPA (2,2-Dimetossie-2-fenil-acetofenone), e l'esposizione a luce UV a lunghezza d'onda lunga, inducendo la reticolazione.
I idrogeli PEGDA (Sigma-Aldrich) (n=4) sono stati prodotti con due diverse concentrazioni, 20% (gruppo H20) e 30% w/V (gruppo H30), con un tampone di acido 2-[4-(2-idrossietil) piperazin-1-ile]etano-solfonico (HEPES) (Sigma-Aldrich). La fotopolimerizzazione è stata indotta utilizzando un fotoiniziatore 2,2-dimetossi-1,2-difeniletanone (DMPA, Sigma-Aldrich) allo 0,1% w/V con esposizione a luce UV (365 nm). Una forma adeguata del disco ATM è stata ottenuta attraverso l'uso di uno strumento da taglio creato esclusivamente per questo scopo.
Trattamento della superficie
Per migliorare l'idrofilicità degli scaffold in PCL, sono state eseguite due strategie principali: i) 4 scaffold (dal gruppo T86) sono stati posti in una soluzione di idrossido di sodio (NaOH) 1M per circa 24 ore (PNaOH); ii) altri 4 scaffold (dal gruppo T80) sono stati posti in una soluzione di PEGDA prima della fotopolimerizzazione (PH).
Test meccanici
Il comportamento meccanico degli scaffold e degli idrogeli è stato valutato mediante test di compressione uniaxiale non confinata utilizzando una macchina di prova universale con un tasso di estensione di 1 mm.min-1. Prima dei test meccanici, l'area di ciascun scaffold è stata determinata utilizzando il software ImageJ2. La forza, F (N) e la deformazione (mm) sono state registrate in qualsiasi momento durante i test e i valori di stress e deformazione sono stati determinati per tracciare i grafici stress-deformazione. Così, il modulo elastico di compressione è stato stimato in base alla pendenza della regione lineare iniziale delle curve tracciate.
Analisi statistica
Le statistiche descrittive univariate (media e deviazione standard) del comportamento meccanico sono state determinate per ciascun gruppo. Le differenze significative tra i gruppi sono state valutate mediante ANOVA unidirezionale. Sono stati condotti test post-hoc (test di Tukey) per identificare eventuali differenze significative (p<0.05) per diverse temperature degli ugelli durante la produzione e per il trattamento superficiale, negli scaffold, e per le diverse concentrazioni di PEGDA nel caso degli idrogeli. Questi test sono stati eseguiti su GraphPad Prism 6 (GraphPad Software, Inc.) ed Excel 2016 (Microsoft Corporation). ImageJ2 (dominio pubblico) è stato utilizzato per determinare le aree degli scaffold e degli idrogeli.
Risultati & Discussione
Utilizzando il Bioestrusore siamo in grado di produrre con successo scaffold riproducibili (26 x 13 x 4 mm massimo) con la geometria prevista ottenuta attraverso l'uso dell'ingegneria inversa di un disco nativo (Fig. 1).

Valutazione dell'influenza della temperatura dell'ugello
Gli scaffold del disco TMJ in PCL sono stati ottenuti con successo utilizzando le due diverse temperature dell'ugello. I risultati ottenuti attraverso prove di compressione uniaxiale non confinata indicano che ci sono differenze significative tra i due gruppi (p<0.05) (vedi Fig. 3). I gruppi T80 e T86 hanno presentato un modulo di compressione di 31.8 ± 1.5 MPa e 23.9 ± 1.8 MPa, rispettivamente.
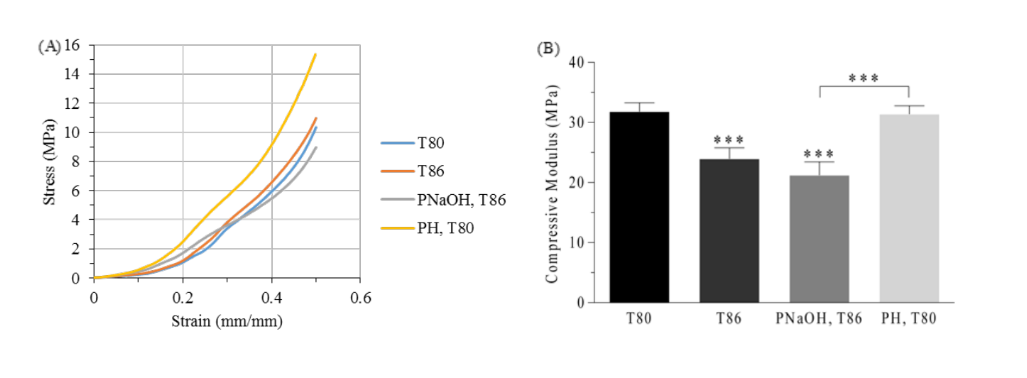
Secondo la letteratura, la temperatura influisce direttamente sulla larghezza della strada, influenzando la porosità finale (temperature più elevate portano a una porosità inferiore) delle strutture e, di conseguenza, il loro comportamento meccanico. Una temperatura più bassa consente al materiale di solidificarsi più rapidamente, riducendo possibili cambiamenti nella geometria dei supporti. Questi cambiamenti possono verificarsi a temperature di produzione più elevate perché il materiale, essendo in uno stato viscoso, è influenzato dalla gravità e i supporti diventano leggermente piatti. Questo esperimento è in concordanza con il risultato atteso.
Valutazione dell'influenza della concentrazione di PEGDA sulle proprietà meccaniche degli idrogeli
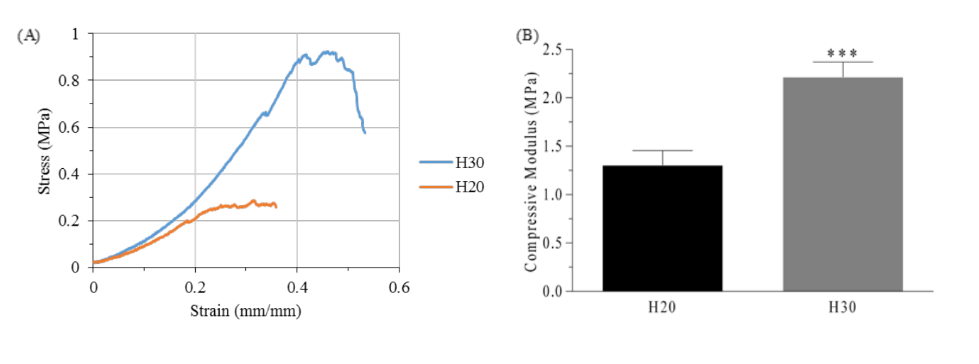
Come mostrato nella figura 2, sono presenti differenze significative tra i due gruppi di idrogeli (p<0.05). Gli idrogeli prodotti con una concentrazione di PEGDA del 20% w/V presentavano quasi la metà del modulo di compressione e un terzo della resistenza ultima (1.30 ± 0.15 MPa e 0.30 ± 0.03 MPa, rispettivamente) rispetto agli idrogeli prodotti con il 30% w/V di PEGDA (2.21 ± 0.16 MPa e 1.01 ± 0.11 MPa). Nonostante ciò, gli idrogeli del gruppo H30 si sono dimostrati altamente fragili durante la flessione o la trazione. Pertanto, per produrre i supporti del gruppo PH, sono stati utilizzati idrogeli simili a quelli del gruppo P20.
Influenza del trattamento superficiale
Il trattamento superficiale degli scaffold in PCL non ha portato a differenze significative nel comportamento meccanico degli scaffold. Il modulo di compressione del gruppo PNaOH (21.2 ± 2.2 MPa) è leggermente diminuito rispetto al gruppo di controllo (T86), ma queste differenze non erano significative (p>0.05). La leggera diminuzione delle proprietà meccaniche è dovuta alla degradazione superficiale promossa dalla soluzione di NaOH - diminuzione del diametro dei filamenti che diventano irregolari lungo la fibra. Pertanto, gli scaffold perdono massa e la loro porosità aumenta, portando a una diminuzione delle proprietà meccaniche in compressione.
D'altra parte, l'aggiunta di idrogelo nel gruppo PH non ha causato differenze significative sui moduli elastici di compressione (31.4 ± 1.4 MPa) rispetto al gruppo di controllo (T80). Inoltre, l'idrogelo sembra aumentare significativamente la lubrificazione e la flessibilità degli scaffold e potrebbe aiutare nell'adesione cellulare, grazie all'aumento della sua idrofobicità.
L'uso del PCL nella TE della cartilagine, specificamente nel tessuto fibrocartilagineo del disco TMJ, è recente. Sebbene l'idrofobicità originale del PCL, il trattamento superficiale con NaOH può migliorare la sua idrofila e l'adesione cellulare grazie all'irregolarità della superficie. Inoltre, l'incorporazione di idrogel PEGDA è un approccio all'avanguardia e potrebbe indicare la giusta direzione per un impianto di disco bioingegnerizzato TMJ di successo. La combinazione di due diversi biomateriali (e relative tecnologie di produzione) può portare a benefici significativi nella TE del disco TMJ. In questo approccio, il PCL fornisce la resistenza meccanica necessaria e il suo tasso di degradazione lenta è compatibile con il tasso di crescita lenta del tessuto fibrocartilagineo, mentre l'idrogel PEGDA promuove l'adesione cellulare, aumenta la lubrificazione dell'impianto e consente l'integrazione di fattori di crescita. Sebbene il PCL presenti una rigidità maggiore rispetto al tessuto nativo del disco TMJ, questo potrebbe essere vantaggioso in chirurgia, poiché consente un posizionamento più facile dell'impianto, riducendo i tempi e permettendo una chirurgia meno invasiva.
Conclusione
Il disco TMJ TE ha l'obiettivo di offrire un'alternativa ai trattamenti attuali per i TMD a causa della degenerazione del disco. Pertanto, combinando diversi materiali è possibile produrre un impianto bioingegnerizzato che mimica meglio le proprietà del tessuto nativo.
In questo studio, abbiamo prodotto con successo un'impalcatura basata su PCL e PEGDA per l'impianto del disco bioingegnerizzato TMJ. A causa del lento tasso di degradazione del PCL, questo materiale è compatibile con il lento tasso di crescita del tessuto del disco TMJ. Inoltre, il PCL fornisce importanti proprietà meccaniche all'impalcatura e la sua relativa rigidità potrebbe rappresentare un vantaggio durante l'intervento chirurgico. D'altra parte, il gel idrofilo PEGDA promuove l'adesione cellulare e fornisce lubrificazione. Pertanto, le funzioni del disco TMJ sono assicurate: i) la lubrificazione consente una riduzione dell'attrito nell'articolazione; ii) la distribuzione del carico intra-articolare è assicurata dalla geometria dell'impalcatura e dalle proprietà meccaniche dei materiali; ii) la geometria dell'impianto consente l'allineamento e la stabilizzazione dell'articolazione.
In sintesi, questo lavoro ha dimostrato che la combinazione di diversi materiali potrebbe rappresentare un progresso significativo nella TE del disco dell'ATM e nella TE della cartilagine in generale.
Autori: Luís Francisco, Carla Moura, Tânia Viana, David Ângelo, Pedro Morouço, Nuno Alves
Riferimenti:
- VanPutte, C., Regan, J., Russo, A., Seeley, R., Stephens, T. e Tate, P., Anatomia e Fisiologia di Seeley, 10ª Edizione, New York, USA, 2014
- Athanasiou, K. A., Almarza, A. A., Detamore, M. S. e Kalpakci, K. N., Ingegneria Tissutale della Cartilagine dell'Articolazione Temporomandibolare, 2009
- Stankovic, S., Vlajkovic, S., Boskovic, M., Radenkovic, G., Antic, V. e Jevremovic, D., Caratteristiche morfologiche e biomeccaniche del disco dell'articolazione temporomandibolare: una panoramica delle recenti scoperte, Arch Oral Biol, 58 (2013) 1475-82
- Kalpakci, K. N., Willard, V. P., Wong, M. E. e Athanasiou, K. A., Un confronto interspecie del disco dell'articolazione temporomandibolare, J Dent Res, 90 (2011) 193-8
- Matuska, A. M., Muller, S., Dolwick, M. F. e McFetridge, P. S., Risultati biomeccanici e biochimici della deformazione del disco dell'articolazione temporomandibolare suina, Arch Oral Biol, 64 (2016) 72-9
- Fazaeli, S., Ghazanfari, S., Everts, V., Smit, T. H. e Koolstra, J. H., Il contributo delle fibre di collagene alle proprietà meccaniche compressive del disco dell'articolazione temporomandibolare, Osteoarthritis Cartilage, 24 (2016) 1292-301
- Kuo, J., Zhang, L., Bacro, T. e Yao, H., Le proprietà viscoelastiche biphasiche dipendenti dalla regione dei dischi dell'articolazione temporomandibolare umana sotto compressione confinata, J Biomech, 43 (2010) 1316-21
- Tanaka, E. e Eijden, T. v., Comportamento biomeccanico del disco dell'articolazione temporomandibolare, Crit Rev Oral Biol Med, 14 (2003) 138-150
- Beek, M., Aarnts, M. P., Koolstra, J. H., Feilzer, A. J. e Eijden, T. M. G. J. v., Proprietà dinamiche del disco dell'articolazione temporomandibolare umano, J Dent Res, 80 (2001) 876-880
- Willard, V. P., Kalpakci, K. N., Reimer, A. J. e Athanasiou, K. A., Il contributo regionale dei glicosaminoglicani alle proprietà compressive del disco dell'articolazione temporomandibolare, J Biomech Eng, 134 (2012) 011011
- Ingawale, S. e Goswami, T., Articolazione temporomandibolare: disturbi, trattamenti e biomeccanica, Ann Biomed Eng, 37 (2009) 976-96
- Murphy, M. K., MacBarb, R. F., Wong, M. E., A., K. e Athanasiou, K. A., Disturbi dell'Articolazione Temporomandibolare: Una Revisione dell'Etiologia, della Gestione Clinica e delle Strategie di Ingegneria Tissutale, Int J Oral Maxillofac Implants, 28 (2013) e393–e414
- Herring, S. W., Anatomia dell'ATM e modelli animali, J Musculoskelet Neuronal Interact, 3 (2003) 391
- Bermejo, A., González, O. e González, J. M., Il maiale come modello animale per esperimenti sul complesso articolare temporomandibolare, Oral Surc Oral Med Oral Pathol, 75 (1993) 18-23
- Angelo, D. F., Morouco, P., Alves, N., Viana, T., Santos, F., Gonzalez, R., Monje, F., Macias, D., Carrapico, B., Sousa, R., Cavaco-Goncalves, S., Salvado, F., Peleteiro, C. e Pinho, M., Scegliere le pecore (Ovis aries) come modello animale per la ricerca sull'articolazione temporomandibolare: Caratterizzazione morfologica, istologica e biomeccanica del disco articolare, Morphologie, 100 (2016) 223-233
- Mehrotra, D., Bioingegneria dell'ATM: una revisione, J Oral Biol Craniofac Res, 3 (2013) 140-5
- Hunter, C. J., Ingegneria dei Tessuti di Fibrocartilagine, in: J. A. Burdick e R. L. Mauck (Eds.), Biomateriali per Applicazioni di Ingegneria Tissutale: Una Revisione delle Tendenze Passate e Future, Springer, NewYork, 2011, pp. 363-389
- Allen, K. D. e Athanasiou, K. A., Selezione di Scaffold e Fattori di Crescita nell'Ingegneria del Disco dell'Articolazione Temporomandibolare, J Dent Res, 87 (2008) 180-185
- Juran, C. M., Dolwick, M. F. e McFetridge, P. S., Microporosità ingegnerizzata: migliorare il potenziale rigenerativo precoce dei dischi dell'articolazione temporomandibolare decellularizzati, Tissue Eng Part A, 21 (2015) 829-39
- Springer, I. N. G., Fleiner, B., Jepsen, S. e Açil, Y., Coltivazione di cellule ottenute dalla cartilagine dell'articolazione temporomandibolare su scaffold non assorbibili, Biomaterials, 22 (2001) 2569–2577
- Hagandora, C. K., Gao, J., Wang, Y. e Almarza, A. J., Poli (glicerolo sebacato): un nuovo materiale per scaffold per l'ingegneria del disco dell'articolazione temporomandibolare, Tissue Eng Part A, 19 (2013) 729-37
- Brown, B. N., Chung, W. L., Almarza, A. J., Pavlick, M. D., Reppas, S. N., Ochs, M. W., Russell, A. J. e Badylak, S. F., Approccio induttivo, basato su scaffold, di medicina rigenerativa per la ricostruzione del disco dell'articolazione temporomandibolare, J Oral Maxillofac Surg, 70 (2012) 2656-68
- Kobayashi, E., Nakahara, T., Inoue, M., Shigeno, K., Tanaka, A. e Nakamura, T., Studio Sperimentale sull'Ingegneria Tissutale In Situ del Disco dell'Articolazione Temporomandibolare utilizzando Midollo Osseo Autologo e Scaffold in Spugna di Collagene, Journal of Hard Tissue Biology, 24 (2015) 211 -218
- Olubamiji, A. D., Izadifar, Z., Si, J. L., Cooper, D. M., Eames, B. F. e Chen, D. X., Modulazione del comportamento meccanico di scaffold mimetici della cartilagine stampati in 3D: influenza del peso molecolare e geometria dei pori, Biofabrication, 8 (2016) 025020
- Legemate, K., Tarafder, S., Jun, Y. e Lee, C. H., Ingegnerizzazione dei dischi dell'ATM umani con scaffold stampati in 3D a rilascio di proteine, J Dent Res, 95 (2016) 800-7
- Ratner, B. D., Hofffman, A. S., Schoen, F. J. e Lemons, J. E., Scienza dei Biomateriali - Un'Introduzione ai Materiali in Medicina, San Diego, California, 1996
- Ebnesajjad, S., Manuale dei Biopolimeri e Plastica Biodegradabile - Proprietà, Lavorazione e Applicazioni, Regno Unito, 2013
- Domingos, M., Chiellini, F., Gloria, A., Ambrosio, L., Bartolo, P. e Chiellini, E., Effetto dei parametri di processo sulle proprietà morfologiche e meccaniche degli scaffold in poli(ε‐caprolattone) bioestrusi in 3D, Rapid Prototyping Journal, 18 (2012) 56-67
- Sun, H., Mei, L., Song, C., Cui, X. e Wang, P., La degradazione, l'assorbimento e l'escrezione in vivo dell'impianto a base di PCL, Biomaterials, 27 (2006) 1735-40
