Una valutazione istologica comparativa della biocompatibilità dei materiali utilizzati nella chirurgia apicale
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract
Obiettivo: Valutare le proprietà biologiche di una varietà di materiali che potrebbero essere utilizzati nella chirurgia apicale.
Metodologia: È stata utilizzata la tecnica dell'impianto intraosseo raccomandata dalla FDI (1980) e dall'ADA (1982) per testare i seguenti materiali: ossido di zinco-eugenolo (ZOE), aggregato minerale di triossido (MTA) e resina composita Z-100 fotopolimerizzabile. Trenta porcellini d'India, 10 per ciascun materiale, divisi in periodi sperimentali di 4 e 12 settimane, hanno ricevuto un impianto su ciascun lato della sinfisi mandibolare. La risposta del tessuto connettivo lungo la parete laterale al di fuori della coppa ha servito come controllo negativo per la tecnica. Alla fine dei periodi di osservazione, gli animali sono stati uccisi e i campioni preparati per l'esame istologico di routine per valutare la loro biocompatibilità.
Risultati: La reazione del tessuto ai materiali è diminuita nel tempo. Il cemento ZOE era altamente tossico durante il periodo sperimentale di 4 settimane, ma questo profilo è cambiato significativamente dopo 12 settimane, quando ha mostrato caratteristiche biocompatibili. MTA e Z-100 hanno mostrato biocompatibilità in questo modello di test in entrambi i periodi di tempo.
Conclusioni: MTA e composito Z-100 erano biocompatibili a 4 e 12 settimane in questo modello sperimentale.
Introduzione
Il successo nel trattamento canalare dipende dalla rimozione del contenuto infetto del canale, seguita dal riempimento del canale utilizzando un materiale di adeguata compatibilità per evitare irritazioni ai tessuti periapicali. Nonostante l'evoluzione costante dei concetti, delle nuove tecniche endodontiche e dello sviluppo di materiali e strumenti più efficaci, la risoluzione della patosi periapicale viene talvolta raggiunta solo attraverso procedure chirurgiche (Tassery et al. 1999).
La chirurgia apicale, tuttavia, dovrebbe essere eseguita solo quando il trattamento canalare convenzionale ha fallito. Il materiale ideale per il riempimento apicale della radice dovrebbe avere caratteristiche biocompatibili, stabilità dimensionale, adesività, bassa solubilità e la capacità di creare un sigillo del terzo apicale del canale per isolare il sistema canalare dalla regione periapicale (Gartner & Dorn 1992). È stato dimostrato che la biocompatibilità è uno dei fattori più importanti (Pascon et al. 2001).
Quando si considerano le proprietà biologiche dei materiali endodontici, ci sono una vasta gamma di caratteristiche che dovrebbero essere prese in considerazione. Le metodologie per valutare questi parametri comprendono test iniziali, test secondari e studi di utilizzo. La valutazione iniziale dovrebbe comprendere metodi di base in vitro per valutare le proprietà biologiche. Le valutazioni secondarie dovrebbero essere eseguite in vivo su animali da laboratorio e possono includere esperimenti di impianto. Gli studi di utilizzo vengono effettuati su primati o esseri umani (Spångberg 1969, Stanley 1985).
Un gran numero di materiali è stato raccomandato per il riempimento apicale della radice. L'obiettivo di questo studio era valutare la reazione dei tessuti di una varietà di materiali potenzialmente utili utilizzati come riempimento della radice utilizzando il modello sperimentale raccomandato dalla FDI (1980) e ADA (1982).
Materiali e metodi
I materiali valutati erano ossido di zinco-eugenolo (ZOE) (S.S.White, Rio de Janeiro, Brasile), aggregato di triossido minerale (MTA) (ProRootTM MTA; Dentsply Endodontics, Tulsa, OK, USA) e resina composita a polimerizzazione con luce Z-100 (3M, St Paul, MN, USA). Tutti i materiali sono stati preparati nel modo consigliato dal produttore per il loro uso clinico e caricati in portatori in Teflon® (Politetrafluoroetilene; DuPont, HABIA, Knivsta, Svezia), assicurandosi che l'aria non fosse intrappolata.
L'impianto intraosseo nella mandibola del porcellino d'India (Spångberg 1969) e i metodi standardizzati per valutare le reazioni biologiche raccomandati dalla FDI (1980) e dall'ADA (1982) sono stati utilizzati. Sono stati selezionati trenta porcellini d'India (del peso di ~800 g) e ogni animale ha ricevuto due impianti dello stesso materiale. Dieci campioni sono stati utilizzati per ciascun materiale e periodo di osservazione (Tabella 1). Inoltre, la risposta del tessuto connettivo lungo la parete laterale al di fuori della coppa in Teflon® ha servito come controllo negativo per la tecnica.
Gli animali sono stati anestetizzati intraperitonealmente con 0,6 mL di ketamina (100 mg mL–1), contenente acepromazina (0,5 mg mL–1). Nella piega mucobuccale della regione degli incisivi mandibolari, sono stati iniettati 0,6 mL di xylocaine al 2% con epinefrina (1 : 100 000), per prevenire il disagio locale. I porcellini d'India sono stati rasati nell'area sottomandibolare e la pelle disinfettata con una tintura di iodio al 5%. La regione simfisi ventrale distale della mandibola è stata esposta chirurgicamente in condizioni antisettiche attraverso un'incisione nella pelle e nel tessuto muscolare. L'osso mandibolare su entrambi i lati della simfisi è stato esposto e sono stati preparati fori cilindrici allargati a un diametro di 2 mm e una profondità di 2 mm con frese sotto irrigazione di soluzione salina fisiologica sterile. Coppe cilindriche in Teflon®, sterilizzate, aperte a un'estremità e con le loro superfici esterne filettate per fornire scanalature di ritenzione, sono state riempite in condizioni sterili con i materiali e inserite nelle cavità ossee in modo tale che i materiali di riempimento fossero a contatto con il tessuto osseo. I cilindri sono stati
2,0 mm di lunghezza e aveva un diametro interno di 1,3 mm e un diametro esterno di 2,0 mm. Quando i bicchieri erano in posizione, i tessuti molli furono ripristinati e suturati indipendentemente con un materiale riassorbibile 3-0. I periodi di osservazione furono di 4 e 12 settimane, quando i porcellini d'India furono uccisi, la mandibola fu dissezionata e l'osso adiacente ai bicchieri in situ fu sezionato in blocchi di 10 mm. I campioni furono immersi in una soluzione di formalina tamponata al 10% e preparati per esame istologico di routine. Sezioni seriali (spesse 5 μm) furono tagliate e colorate con ematossilina-eosina (H & E) per il riconoscimento cellulare.
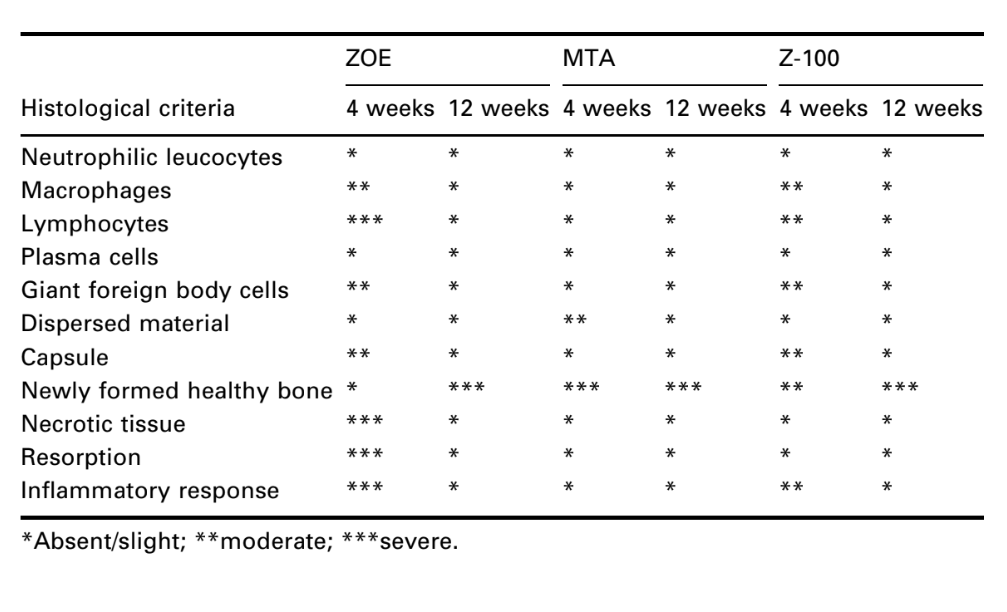
L'interfaccia all'apertura del bicchiere, tra il materiale e l'osso, fu esaminata e valutata per l'intensità dell'infiammazione. Dieci criteri istologici furono utilizzati per determinare i livelli infiammatori – presenza o assenza di leucociti neutrofili, macrofagi, linfociti, cellule plasmatiche, cellule giganti di corpo estraneo, materiale disperso, capsula, osso sano di nuova formazione, tessuto necrotico e riassorbimento.
Due osservatori indipendenti sono stati utilizzati per valutare le reazioni tissutali. Il livello complessivo della reazione tissutale è stato quindi classificato come assente a lieve, moderato e severo secondo i criteri istologici definiti in precedenza. È stato considerato biologicamente accettabile che il materiale mostrasse una reazione assente a lieve in entrambi i periodi sperimentali di 4 e 12 settimane, o una reazione moderata a 4 settimane che diminuiva a 12 settimane.
Risultati
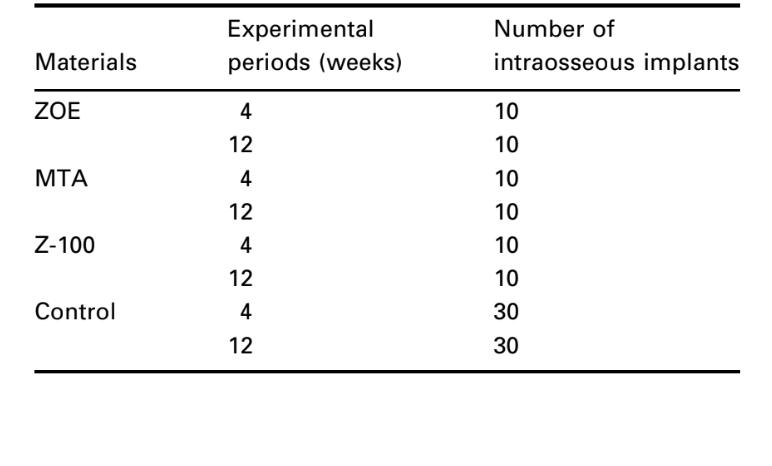
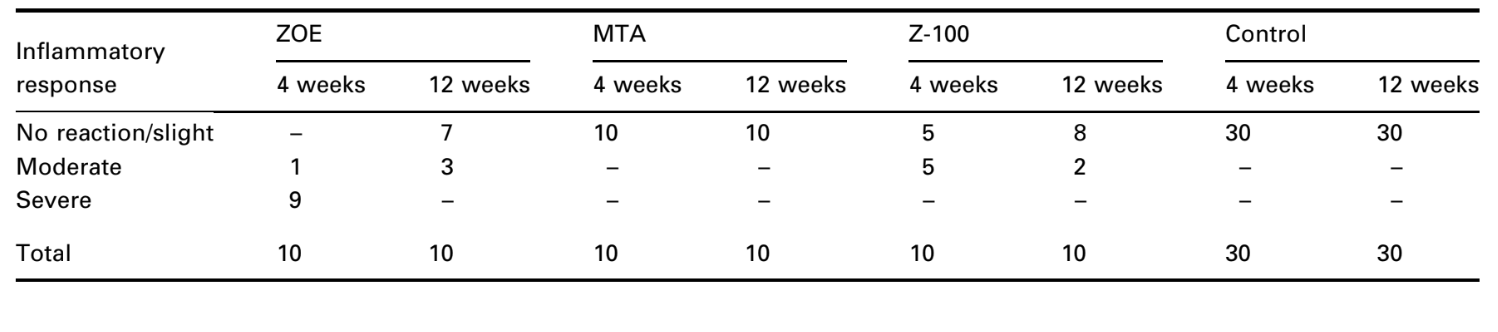
Il numero di impianti intraossei e l'intensità della risposta infiammatoria sono presentati nella Tabella 2. Le valutazioni istologiche dei materiali a 4 e 12 settimane sono riassunte nella Tabella 3.
Osservazioni a quattro settimane
Controllo negativo
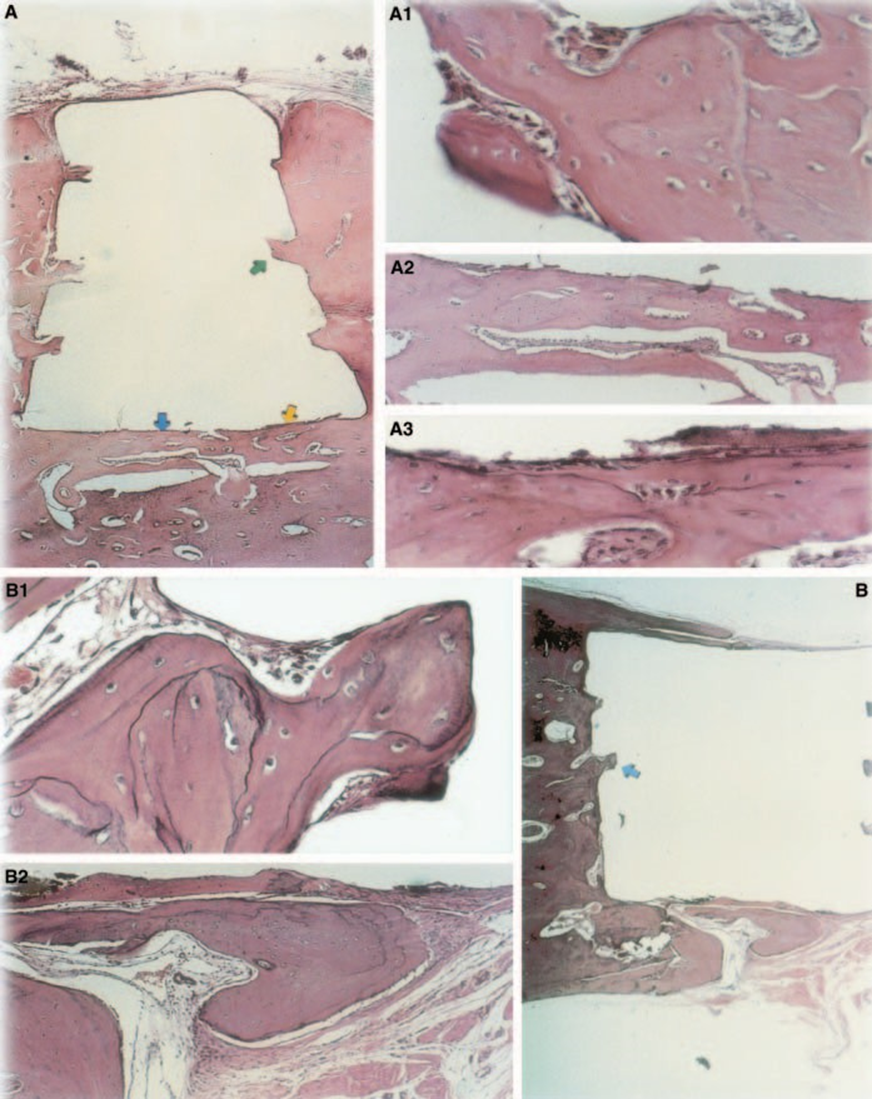
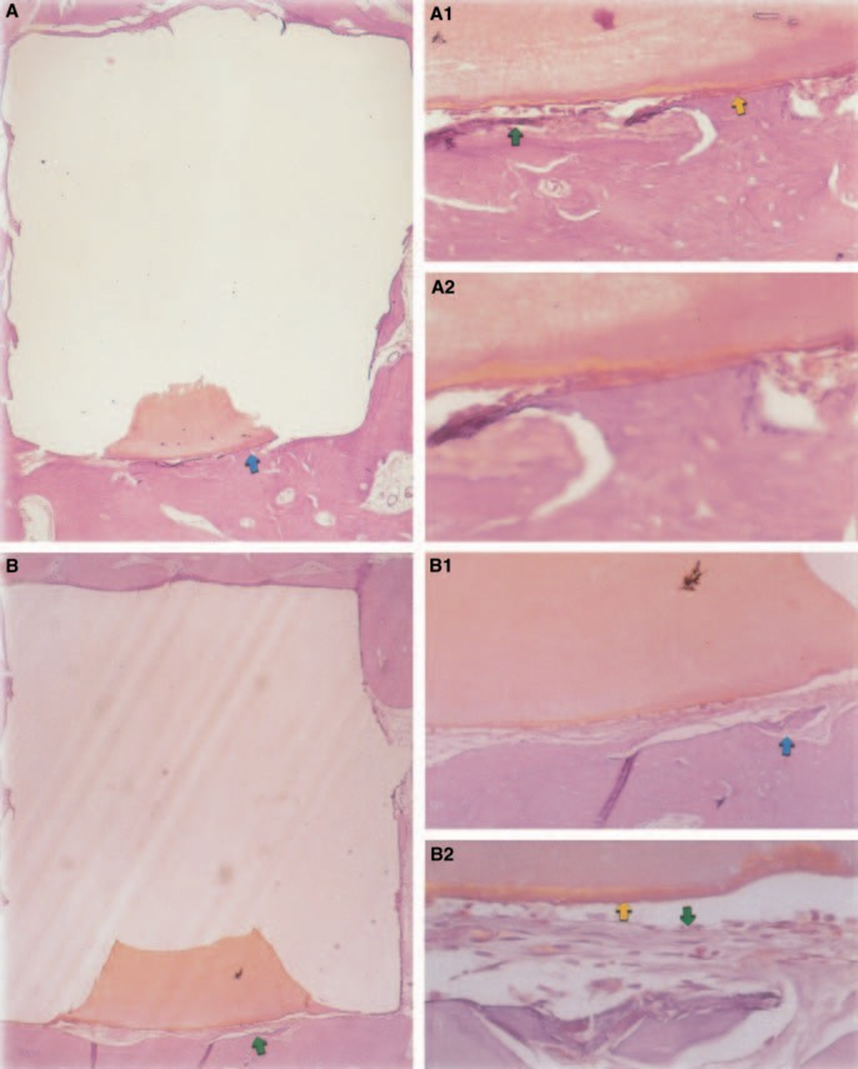
La risposta del tessuto connettivo lungo la parete laterale esterna delle coppe in Teflon® di tutti i campioni ha servito come controllo negativo per la tecnica. Le scanalature nella superficie esterna delle coppe erano riempite con nuovo tessuto osseo, e sottili strati di tessuto connettivo senza reazione infiammatoria potevano essere visti tra la coppa e l'osso in tutti i periodi di osservazione in tutti i campioni (Fig. 6A1,A2).
Ossido di zinco-eugenolo
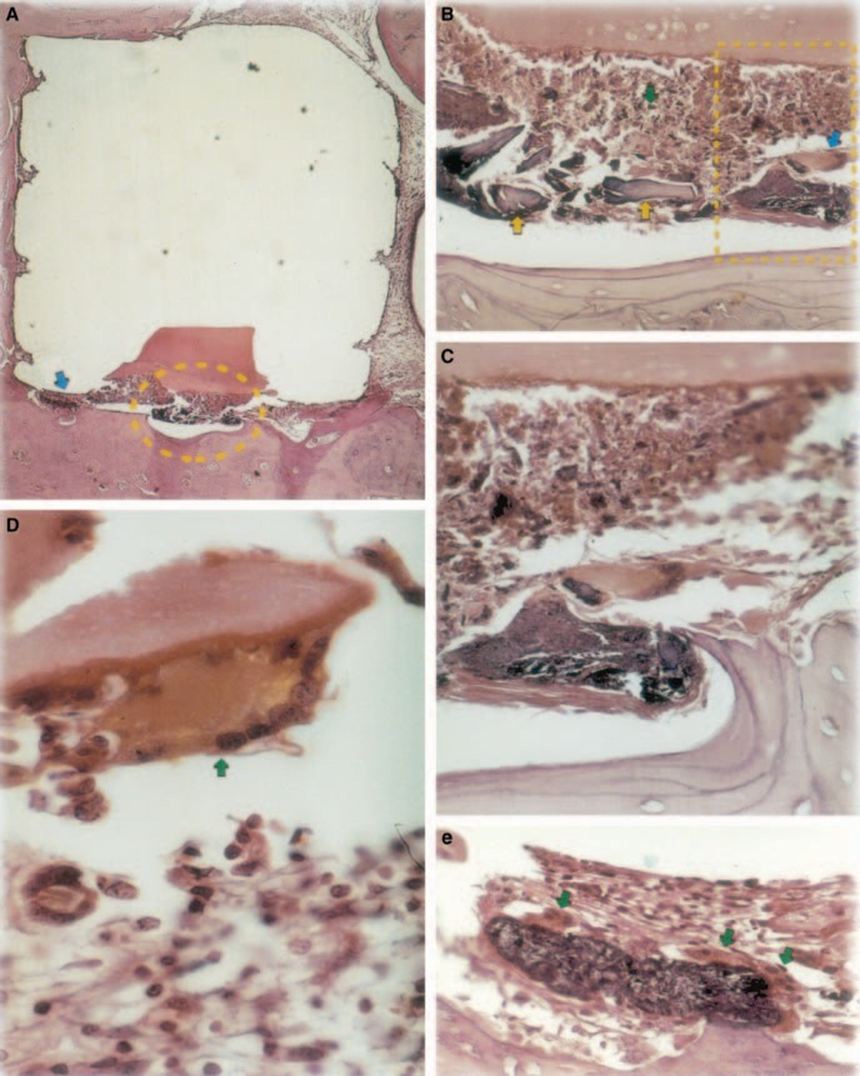
La reazione è stata severa con necrosi ossea, riassorbimento, infiltrato infiammatorio mononucleare dimostrato dalla presenza di linfociti, macrofagi e cellule giganti di corpo estraneo (Fig. 1C). La presenza di agglomerati di cellule giganti di corpo estraneo contenenti materiale nel citoplasma e tessuto necrotico era comune (Fig. 1D). C'era una maggiore deposizione di fibre di collagene più vicine al tessuto osseo rispetto al materiale e bassa presenza di cellule infiammatorie (Fig. 1B).
Aggregato di triossido minerale
La risposta infiammatoria è stata classificata come assente a lieve. Si è formata una sana osso in stretto contatto con il materiale (Fig. 3).
Z-100
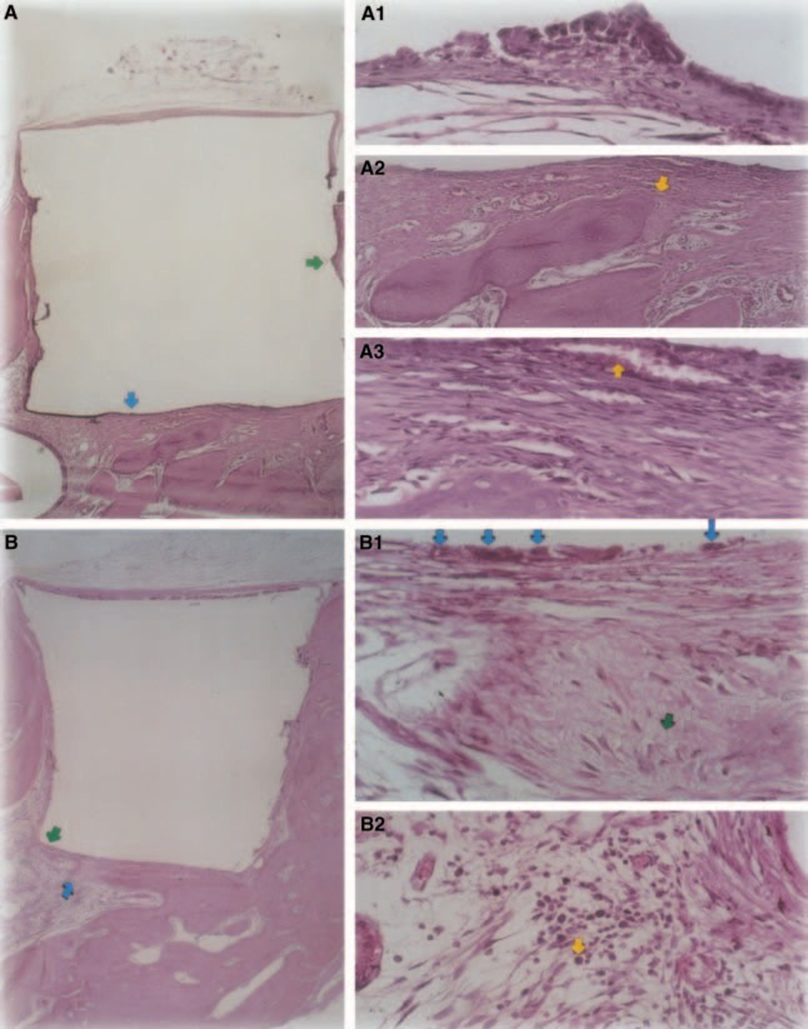
È stata osservata una risposta infiammatoria da lieve a moderata con formazione di tessuto connettivo denso all'interfaccia materiale/tessuto osseo (Fig. 5A2,B1). Questo tessuto connettivo fibroso era ricco di fibroblasti; si potevano osservare vasi, nessun infiltrato infiammatorio e deposizione di tessuto minerale, dimostrando la formazione di osso (Fig. 5A3). La presenza di macrofagi e cellule giganti da corpo estraneo vicino al materiale era un riscontro costante (Fig. 5A1,B1). È stato osservato un infiltrato infiammatorio cronico moderato vicino al materiale (Fig. 5B2).
Osservazioni di dodici settimane
Controllo negativo
La risposta del tessuto connettivo lungo la parete laterale esterna delle coppe in Teflon® di tutti i campioni ha servito come controllo negativo per la tecnica. È stato possibile osservare che le scanalature sulla superficie esterna delle coppe erano riempite con nuovo tessuto osseo, e uno strato sottile di tessuto connettivo senza reazione infiammatoria poteva essere visto tra la coppa e l'osso in tutti i periodi di osservazione in tutti i campioni (Fig. 6A1,A2).
Ossido di zinco-eugenolo
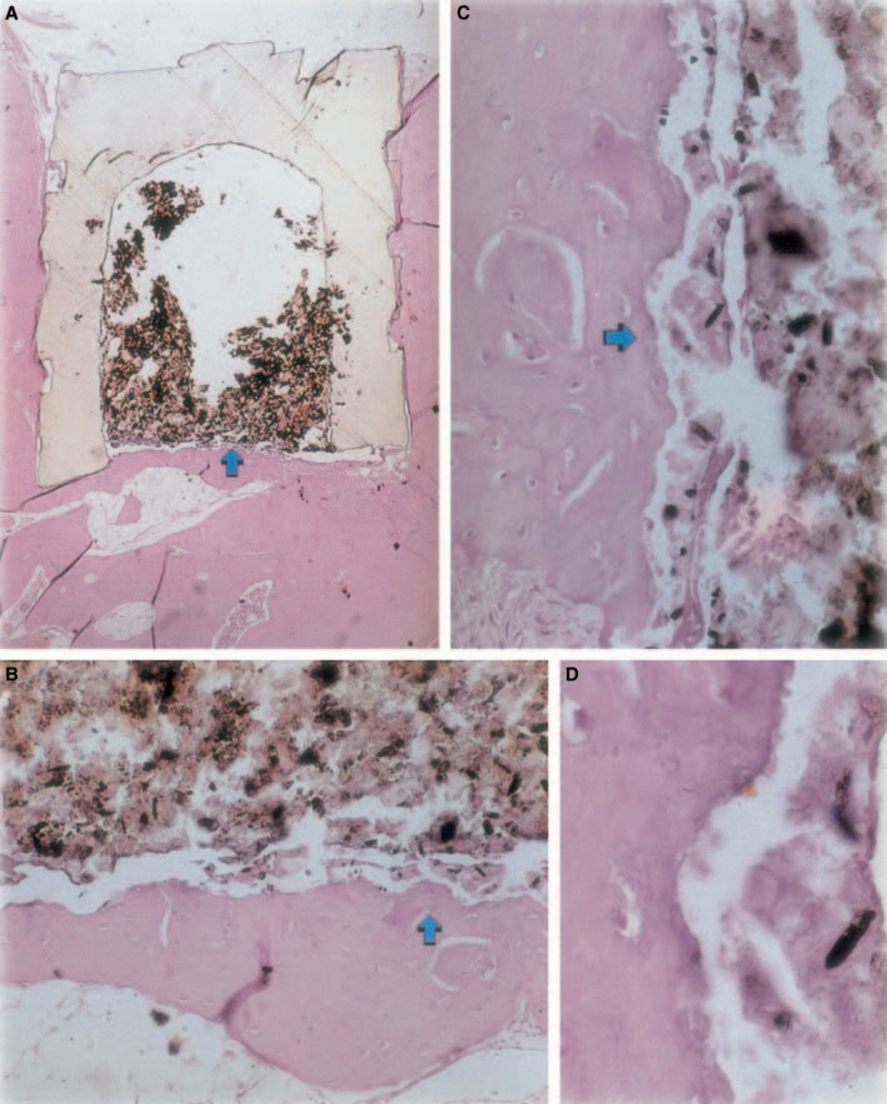
La reazione infiammatoria variava da assente a lieve durante il periodo sperimentale. C'era formazione ossea nell'interfaccia (Fig. 2A,B). L'osso attorno alla coppa era sano e la copriva completamente. In alcuni casi, c'era uno strato sottile di tessuto connettivo tra il materiale impiantato e il nuovo tessuto osseo (Fig. 2A1,A2,B1). Tuttavia, era ancora presente una certa riassorbimento (Fig. 2B2).
Aggregato di triossido minerale
Nuovo tessuto osseo si era formato all'interfaccia materiale/tessuto. Non c'era una reazione infiammatoria significativa e, quando presente, i macrofagi e le cellule giganti del corpo estraneo si trovavano nella regione periferica, in stretto contatto con la coppa di Teflon®. È stato osservato anche osso sano contenente osteoblasti in stretto contatto con il materiale (Fig. 4C).
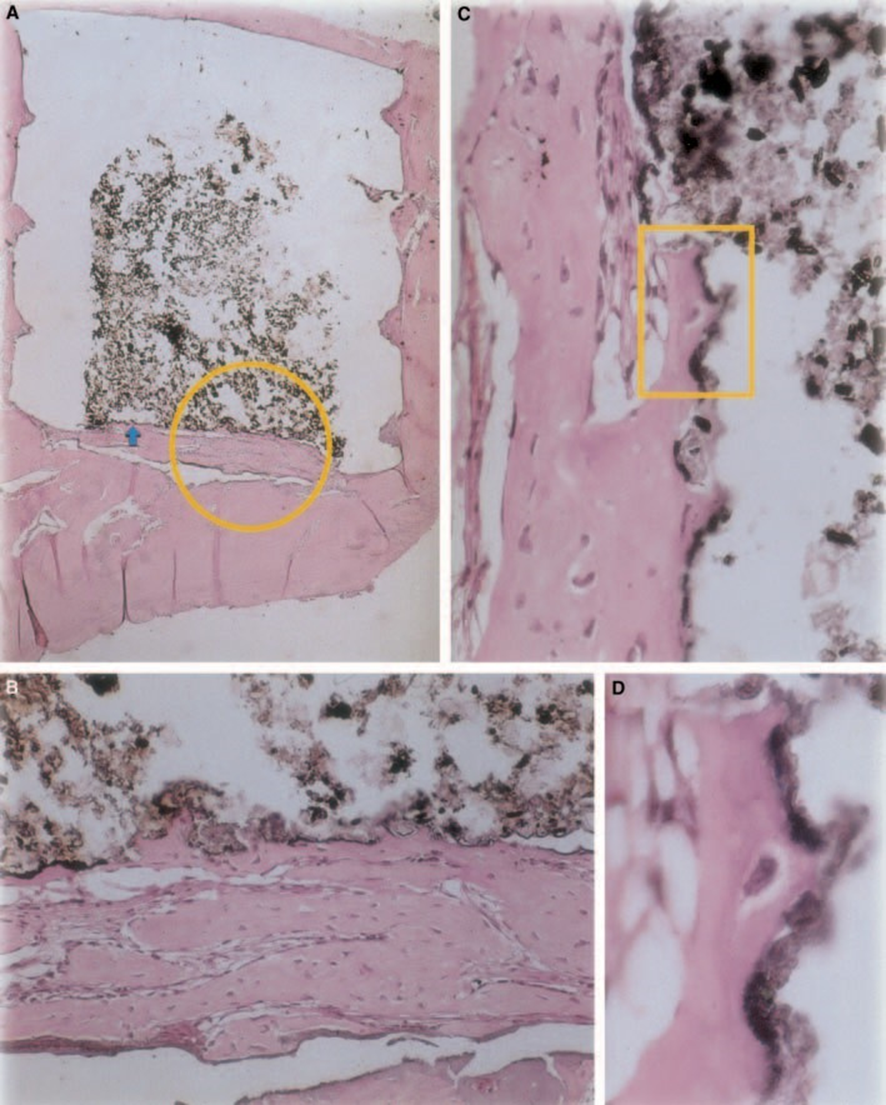
Z-100
Lo spessore del tessuto connettivo è stato significativamente ridotto all'interfaccia (Fig. 6A,B). La presenza di cellule infiammatorie era bassa, tranne che per le cellule giganti da corpo estraneo (Fig. 6A3).
Discussione
La biocompatibilità è una delle proprietà più importanti di un materiale utilizzato nel riempimento apicale della radice perché sarà in contatto permanente con i tessuti vivi nella regione periapicale. Uno degli obiettivi della chirurgia periradicolare è creare una barriera tra la regione periapicale e qualsiasi agente fisico e/o batterico all'interno del sistema del canale radicolare. L'uso di un materiale di riempimento della radice non compatibile interferirà con la guarigione in quell'area. I materiali utilizzati nel riempimento apicale della radice, oltre ai necessari test preliminari, devono avere le loro caratteristiche di biocompatibilità investigate (Torabinejad & Pitt Ford 1996).
Il test dell'impianto nel tessuto osseo di porcellino d'India raccomandato dalla FDI (1980) consente di testare il materiale così come viene utilizzato nell'ambiente clinico, preparato seguendo le raccomandazioni del produttore. Sebbene i risultati non possano essere direttamente estrapolati agli esseri umani, il test è standardizzato e consente un confronto diretto tra i materiali. La letteratura in questo campo fornisce risultati in vari laboratori utilizzando gli stessi materiali per consentire il confronto dei dati (Pascon et al. 1987, Andreana et al. 1989, Pascon & Langeland 1989, Barbosa et al. 1993). I risultati ottenuti in questo studio hanno confermato le scoperte di altri che qualsiasi materiale posto in contatto con i tessuti provoca una reazione da corpo estraneo (Figs 1D, 5B1 e 6A3).
Le reazioni lungo la periferia esterna della coppa in Teflon® riflettono il trauma causato dalle procedure chirurgiche necessarie per l'introduzione del Teflon® e dei suoi contenuti. Il Teflon® stesso causa un'irritazione insignificante nei tessuti (Stanley 1985) ed è stato utilizzato come portatore a causa della sua biocompatibilità (Spångberg 1969, ADA 1982). Questo è stato confermato dall'assenza di reazioni infiammatorie sulla parete laterale dei portatori in entrambi i periodi di osservazione.
La risposta infiammatoria al ZOE è stata significativamente maggiore rispetto agli altri materiali per entrambi i periodi di osservazione (Figs 1 e 2). Questa grave risposta al ZOE è stata descritta in letteratura (Pascon & Langeland 1989, Gulati et al. 1991, Guigand et al. 1999). È stato anche dimostrato che qualsiasi materiale che contiene eugenolo provoca una grave reazione tissutale a causa della depressione della respirazione cellulare (Hume 1984). Serene et al. (1988) hanno scoperto che i sigillanti ZOE attivano il sistema del complemento e quindi una reazione infiammatoria. La risposta infiammatoria prolungata al ZOE si verifica perché la reazione tra il materiale e i fluidi tissutali libera infine eugenolo dal materiale.
I risultati presentati hanno confermato le scoperte riportate da Torabinejad et al. (1997, 1998) riguardo alla risposta infiammatoria dell'MTA (Figs 3 e 4). Questi autori hanno testato questo materiale nelle tibie e mandibole di porcellini d'India, e come materiale di riempimento apicale in scimmie, riportando la sua biocompatibilità. Non è stata osservata alcuna risposta infiammatoria significativa.
Stabholz et al. (1985) hanno introdotto le resine composite come materiali di riempimento apicale e hanno confrontato le loro proprietà fisiche con quelle dell'amalgama d'argento, Cavit e fosfato di zinco. Tuttavia, nel loro lavoro non ci sono state preoccupazioni riguardo alla risposta dei tessuti. Quando le resine sono state utilizzate come materiali apicali, i risultati sono variati da infiammazione severa (Bruce et al. 1993) a un alto grado di guarigione (Rud et al. 1991).
I risultati del presente studio sono simili a quelli di Rud et al. (1991), che hanno suggerito che le composite avessero una biocompatibilità promettente. Sebbene fosse una scoperta di routine, la crescita ossea in stretto contatto con lo Z-100 si è verificata, probabilmente a causa del suo basso grado di tossicità (Fig. 6A2,B2).
Conclusioni
- Il livello di tossicità dei materiali testati è diminuito nel tempo.
- Il cemento a base di ZOE era altamente tossico durante il periodo sperimentale di 4 settimane, ma questo profilo è cambiato significativamente dopo 12 settimane, quando ha mostrato caratteristiche biocompatibili.
- Tutti i materiali studiati, ad eccezione dello ZOE, hanno presentato livelli di biocompatibilità accettabili, nei due periodi analizzati.
- L'MTA ha mostrato eccellenti qualità biologiche con crescita ossea in stretto contatto con il materiale e senza tessuto connettivo interposto.
- L'MTA e lo Z-100 hanno indicato biocompatibilità in questo test secondario.
Autori: C. J. A. Sousa, A. M. Loyola, M. A. Versiani, J. C. G. Biffi, R. P. Oliveira, E. A. Pascon
Riferimenti
- ADA (1982) Valutazione biologica dei materiali dentali. American Dental Association, New York, Documento n. 41.
- Andreana S, Pascon EA, Langeland K (1989) Risposta del tessuto osseo all'emofibrina [Abstract]. Journal of Dental Research 68, 381.
- Barbosa SV, Araki K, Spångberg LS (1993) Citotossicità di alcuni sigillanti per canali radicolari modificati e dei loro componenti solubili. Oral Surgery, Oral Medicine and Oral Pathology 75, 357–61.
- Bruce GR, McDonald NJ, Sydiskis RJ (1993) Citotossicità dei materiali di retrofill. Journal of Endodontics 19, 288–92.
- FDI (1980) Pratiche standard raccomandate per la valutazione biologica dei materiali dentali. Federation Dentaire Internationale, Londra, Rapporto tecnico n. 9.
- Gartner AH, Dorn, SO (1992) Progressi nella chirurgia endodontica. Dental Clinics of North America 36, 357–78.
- Guigand M, Pellen-Mussi P, LeGolff A, Vulcain J-M, Bonnaure-Mallet M (1999) Valutazione della citocompatibilità di tre materiali endodontici. Journal of Endodontics 25, 419–23.
- Gulati N, Chandra S, Aggarwal PK, Jaiswal JN, Singh M (1991) Citotossicità dell'eugenolo in un sigillante contenente ossido di zinco. Endodontics and Dental Traumatology 7, 181–5.
- Hume WR (1984) Effetto dell'eugenolo sulla respirazione e divisione della polpa umana, fibroblasti murini e cellule epatiche in vitro. Journal of Dental Research 63, 1262–5.
- Pascon EA, Langeland K (1989) Citotossicità di un nuovo sigillante endodontico [Abstract]. Journal of Dental Research 68, 244.
- Pascon EA, Spångberg L, Langeland K (1987) Citotossicità dei sigillanti endodontici [Abstract]. Journal of Dental Research 66, 200.
- Pascon EA, Sousa CJA, Langeland K (2001) Biocompatibilità dei materiali endodontici: citotossicità di una resina poliuretanica derivata dall'olio di ricino. Brazilian Endodontic Journal 5, 5–12.
- Rud J, Munksgaard EC, Andreasen JO, Rud V, Asmussen E (1991) Riempimento retrogrado della radice con composito e un agente di adesione dentinale. Parte 1. Endodontics and Dental Traumatology 7, 118–25.
- Serene TP, Vesely J, Boackle RJ (1988) Attivazione del complemento come possibile indicazione in vitro del potenziale infiammatorio dei materiali endodontici. Oral Surgery, Oral Medicine and Oral Pathology 65, 354–7.
- Spångberg L (1969) Effetti biologici dei materiali di riempimento per canali radicolari. Parte 7. Reazione del tessuto osseo al materiale di riempimento per canali radicolari impiantato nei porcellini d'India. Odontologisk Tidskrift 77, 133–59.
- Stabholz A, Friedman S, Abed J (1985) Adattamento marginale dei riempimenti retrogradi e sua correlazione con la sigillabilità. Journal of Endodontics 11, 218–23.
- Stanley HR (1985) Test di tossicità dei materiali dentali, 1a ed. Miami, FL, USA: CRC Press.
- Tassery H, Pertot WJ, Camps J, Proust JP, Déjou J (1999) Confronto di due siti di impianto per testare la biocompatibilità intraossea. Journal of Endodontics 25, 615–8.
- Torabinejad M, Pitt Ford TR (1996) Materiali di riempimento dell'estremità della radice: una revisione. Endodontics and Dental Traumatology 12, 161–78.
- Torabinejad M, Pitt Ford TR, McKendry DJ, Abedi HR, Miller DA, Kariyawasam SP (1997) Valutazione istologica dell'aggregato di triossido minerale come riempimento dell'estremità della radice nei primati. Journal of Endodontics 23, 225–8.
- Torabinejad M, Pitt Ford TR, Abedi, HR, Kariyawasam SP, Tang HM (1998) Reazione dei tessuti ai materiali di riempimento dell'estremità della radice impiantati nella tibia e nella mandibola dei porcellini d'India. Journal of Endodontics 24, 468–71.
