Confronto della biocompatibilità intraossea dei sigillanti per canali radicolari AH Plus, EndoREZ ed Epiphany
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract
Valutare la biocompatibilità intraossea di AH Plus, EndoREZ ed Epiphany come sigillanti per canali radicolari, come raccomandato dal Rapporto Tecnico #9 della Fédération Dentaire Internationale (FDI). Trenta porcellini d'India, 10 per ciascun materiale, divisi in periodi sperimentali di 4 e 12 settimane, hanno ricevuto un impianto su ciascun lato della sinfisi della mandibola. Alla fine dei periodi di osservazione, gli animali sono stati uccisi e i campioni preparati per l'esame istologico di routine. Dopo aver analizzato entrambi i periodi, la reazione del tessuto infiammatorio a EndoREZ è stata considerata severa. Nel gruppo AH Plus, la reazione è cambiata da severa a moderata, mentre è stata osservata una compatibilità biologica con Epiphany con formazione ossea e nessuna o leggera reazione infiammatoria. Si è concluso che il sigillante per canali radicolari Epiphany era l'unico materiale che presentava biocompatibilità intraossea nei due periodi analizzati. (J Endod 2006;32:656 – 662)
Il successo nel trattamento del canale radicolare dipende dalla completa rimozione dei contenuti infetti del canale, seguita dall'otturazione utilizzando un materiale di adeguata compatibilità per evitare possibili irritazioni ai tessuti periradicolari. Poiché il danno tissutale indotto da procedure intracanalari può comportare risposte sfavorevoli al trattamento, la scelta del professionista sulle procedure da utilizzare durante il trattamento del canale radicolare dovrebbe basarsi su quelle che sono note per causare il minor danno possibile. È stato dimostrato che materiali estranei, come i sigillanti per canali radicolari, intrappolati nei tessuti periradicolari dopo il trattamento endodontico possono perpetuare la parodontite apicale.
È stato anche dimostrato che la biocompatibilità con i tessuti periradicolari è il requisito più importante, poiché qualsiasi materiale non biologicamente accettabile può essere responsabile di fallimenti. Per quanto riguarda le proprietà biologiche dei materiali endodontici, c'è un'ampia gamma di caratteristiche che dovrebbero essere considerate. Le metodologie per valutare i parametri comprendono test iniziali, test secondari e studi di utilizzo. La valutazione iniziale dovrebbe comprendere metodi in vitro per valutare il profilo di tossicità del materiale. I test secondari dovrebbero essere eseguiti in vivo, su animali da laboratorio, e possono includere esperimenti di impianto. Gli studi di utilizzo vengono effettuati su primati o esseri umani.
I materiali attualmente utilizzati nella pratica clinica comprendono sigillanti endodontici a base di resina, ossido di zinco-eugenolo, ionomero di vetro, idrossido di calcio e silicone. I materiali di riempimento in resina hanno guadagnato costantemente popolarità e sono ora accettati come sigillanti per canali radicolari e i miglioramenti nella tecnologia adesiva hanno favorito tentativi di ridurre le perdite apicali e coronali legando le pareti del canale radicolare. Pertanto, i nuovi sigillanti in resina a base di metacrilato EndoREZ ed Epiphany sono stati recentemente sviluppati. Le proprietà biologiche di EndoREZ sono state precedentemente investigate riguardo alla sua citotossicità e biocompatibilità tissutale. Al contrario, le proprietà biologiche di Epiphany, un sigillante composito dentale duale curabile, sono poco investigate.
È stato affermato che la base biologica per la terapia canalare è in ritardo rispetto ai notevoli progressi tecnologici in Endodonzia. Tuttavia, sebbene sia necessaria prima di essere promossa per l'uso clinico, la maggior parte dei materiali manca anche di test di sicurezza di base.
Ad oggi, non sono stati condotti studi per analizzare istologicamente l'effetto dell'impianto di Epiphany nell'osso. Pertanto, lo scopo di questo studio era valutare le proprietà biologiche dei nuovi sigillanti per canali radicolari a base di metacrilato EndoREZ ed Epiphany, confrontandoli con un sigillante per canali radicolari a resina epossidica-amina AH Plus, utilizzando il protocollo raccomandato dalla Fédération Dentaire Internationale (FDI).
Materiali e Metodi
I materiali valutati erano AH Plus (Dentsply, DeTrey, Konstanz, Germania), EndoREZ (Ultradent Products, Inc., South Jordan, UT) ed Epiphany (Pentron Clinical Technologies, Wallingford, CT) sigillanti per canali radicolari. Tutti i materiali sono stati preparati secondo le raccomandazioni del produttore per il loro uso clinico e caricati in portatori in Teflon (Politetrafluoroetilene, DuPont, HABIA, Knivsta, Svezia), assicurando che l'aria non fosse intrappolata. Il protocollo per questo esperimento è stato esaminato e approvato dal Comitato Etico per la Ricerca dell'Università di Uberlândia e l'esperimento è stato condotto in conformità con i 'Principi di Cura degli Animali da Laboratorio' (NIH, No. 86-23, 1985).
L'impianto intraosseo nella mandibola del porcellino d'India e i metodi standardizzati per valutare le proprietà biologiche raccomandati dal Rapporto Tecnico #9 FDI sono stati utilizzati. Sono stati selezionati trenta porcellini d'India (del peso di ~800 g) e ciascun animale ha ricevuto due impianti dello stesso materiale. Dieci campioni sono stati utilizzati per ciascun materiale e periodo di osservazione. Inoltre, la risposta del tessuto connettivo lungo la parete laterale al di fuori della coppa di Teflon ha servito come controllo negativo per la tecnica.
Gli animali sono stati anestetizzati intraperitonealmente con 0,6 ml di ketamina contenente acepromazina in proporzione 1:1. Per prevenire il disagio locale, sono stati iniettati 0,6 ml di xilocaina al 2% con epinefrina (1:100.000) nella piega mucobuccale della regione degli incisivi mandibolari. L'area sottomandibolare è stata rasata e la pelle disinfettata con una tintura di iodio al 5%. La regione simfisi ventrale distale della mandibola è stata esposta chirurgicamente in condizioni antisettiche attraverso un'incisione nella pelle e nel tessuto muscolare. L'osso mandibolare su entrambi i lati della simfisi è stato esposto, e sono stati preparati fori cilindrici con un diametro di 2 mm e una profondità di 2 mm con frese, sotto irrigazione di soluzione salina fisiologica sterile. Coppe cilindriche di Teflon sterilizzate, aperte a un'estremità e con le loro superfici esterne filettate per fornire scanalature di ritenzione, sono state riempite in condizioni sterili con i materiali e inserite nelle cavità ossee in modo che i materiali di riempimento fossero a contatto con l'osso, preservando la condizione sterile. I cilindri erano lunghi 2,0 mm e avevano un diametro interno di 1,3 mm e un diametro esterno di 2,0 mm. Campioni casuali dei cilindri sono stati posti in tubi di terreno tioglicolato di Brewer e incubati aerobicamente per 4 giorni per determinare la loro sterilità.
Quando i coppe erano in posizione, i tessuti molli sono stati ripristinati e suturati indipendentemente con un materiale riassorbibile 3-0. I periodi di osservazione erano di 4 e 12 settimane, quando i porcellini d'India sono stati uccisi, la mandibola è stata dissezionata e l'osso adiacente alle coppe in situ è stato sezionato in blocchi di 10 mm. I campioni sono stati immersi in una soluzione di formalina tamponata al 10% e preparati per l'esame istologico di routine. Sezioni seriali, con il microtomo impostato a uno spessore di 5 µm, sono state tagliate e colorate con ematossilina ed eosina (H&E) per il riconoscimento cellulare. Vetrini selezionati sono stati colorati utilizzando le tecniche di Tricromia di Masson e Brown e Brenn per il riconoscimento del collagene e della contaminazione batterica.
L'interfaccia all'apertura della coppa, tra il materiale e l'osso, è stata esaminata e valutata per l'intensità dell'infiammazione. La valutazione dei criteri FDI è esclusivamente qualitativa e non è stato utilizzato alcun indice di punteggio. Pertanto, il livello complessivo della reazione tissutale è stato classificato come assente a lieve, moderato e severo a seconda della presenza o assenza di leucociti neutrofili, macrofagi, linfociti, cellule plasmatiche, cellule giganti di corpo estraneo, materiale disperso, capsula, osso sano recentemente formato, tessuto necrotico e riassorbimento.
Due osservatori indipendenti hanno valutato in modo cieco le reazioni. Tuttavia, in precedenza, ogni investigatore è stato calibrato valutando due volte un set standard di 50 diapositive riguardo all'intensità e al tipo di reazione infiammatoria. L'accordo inter-esaminatore, calcolato come kappa di Cohen, variava da 0,8 a 0,95. La riproducibilità intra-esaminatore è stata valutata mediante una doppia valutazione di 25 diapositive selezionate casualmente a intervallo di 1 mese. In questo caso, il kappa di Cohen variava da 0,85 a 0,91. È stato considerato biologicamente accettabile quando il materiale mostrava nessuna o leggera reazione in entrambi i periodi sperimentali, o una reazione moderata a 4 settimane che diminuiva a 12 settimane.
Risultati
Il numero di impianti intraossei e l'intensità della risposta infiammatoria sono presentati in Tabella 1. La valutazione istologica dei materiali a 4 e 12 settimane è riassunta in Tabella 2.

Nessuno dei vetrini colorati con la tecnica di Brown e Brenn ha mostrato la presenza di colonizzazione batterica in nessuno degli impianti sperimentali. I cilindri conservati con quelli che producevano crescita nei mezzi di coltura erano negativi. La risposta del tessuto connettivo lungo la parete laterale al di fuori delle coppe di Teflon di tutti i campioni ha servito come controllo negativo per la tecnica. È stato possibile osservare che le scanalature sulla superficie esterna delle coppe erano riempite con nuovo tessuto osseo, e uno strato sottile di tessuto connettivo, senza reazione infiammatoria, poteva essere visto tra la coppa e l'osso in tutti i periodi di osservazione in tutti i campioni testati.
Osservazioni a Quattro Settimane
AH Plus
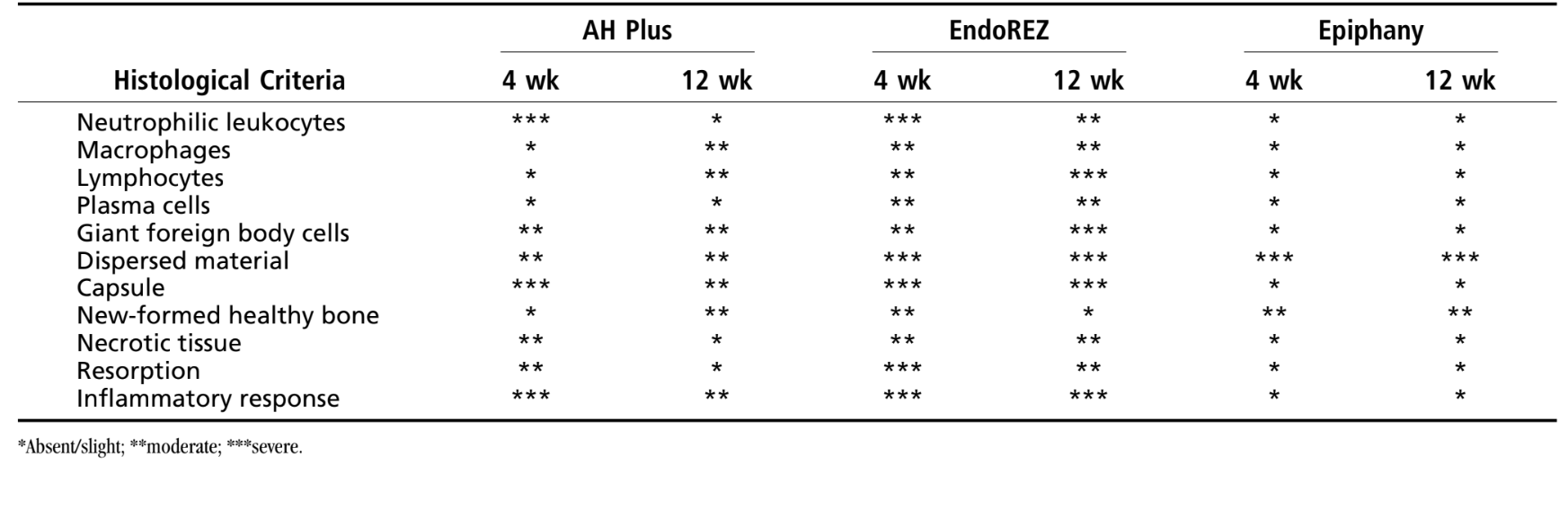
La reazione è stata considerata severa. C'era uno strato sottile di tessuto connettivo che si interponeva tra il materiale e l'osso (Fig. 1b) e l'intensa infiltrazione infiammatoria mostrava la presenza di linfociti, macrofagi e cellule giganti di corpo estraneo, frammenti ossei necrotici (Fig. 1c).

EndoREZ
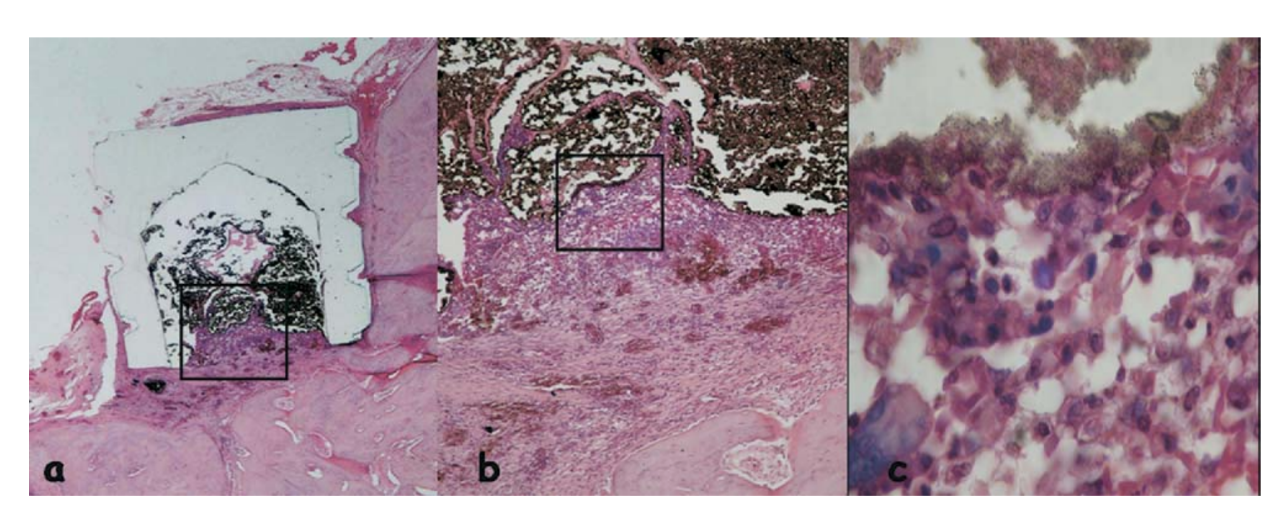
La reazione è stata considerata severa con un intenso infiltrato infiammatorio cronico, con prevalenza di linfociti, macrofagi e cellule giganti di corpo estraneo (Fig. 3c). C'erano alcuni materiali dispersi e la formazione di uno spesso strato di tessuto connettivo che si interponeva tra il materiale e l'osso (Fig. 3d).
e l'osso (area delineata in a) (H&E, ingrandimento originale 40x); (c) tessuto connettivo con alcuni materiali dispersi (freccia verde in b) (H&E, ingrandimento originale 100x); (d) infiltrato infiammatorio cronico e cellule con frammenti del materiale testato (freccia blu in a) (H&E, ingrandimento originale 400x).
Epifania
La risposta infiammatoria è stata classificata come assente a lieve. È stato osservato un tessuto connettivo organizzato in stretto contatto con il materiale testato (Fig. 5b), alcune cellule infiammatorie e del materiale disperso (Fig. 5c).
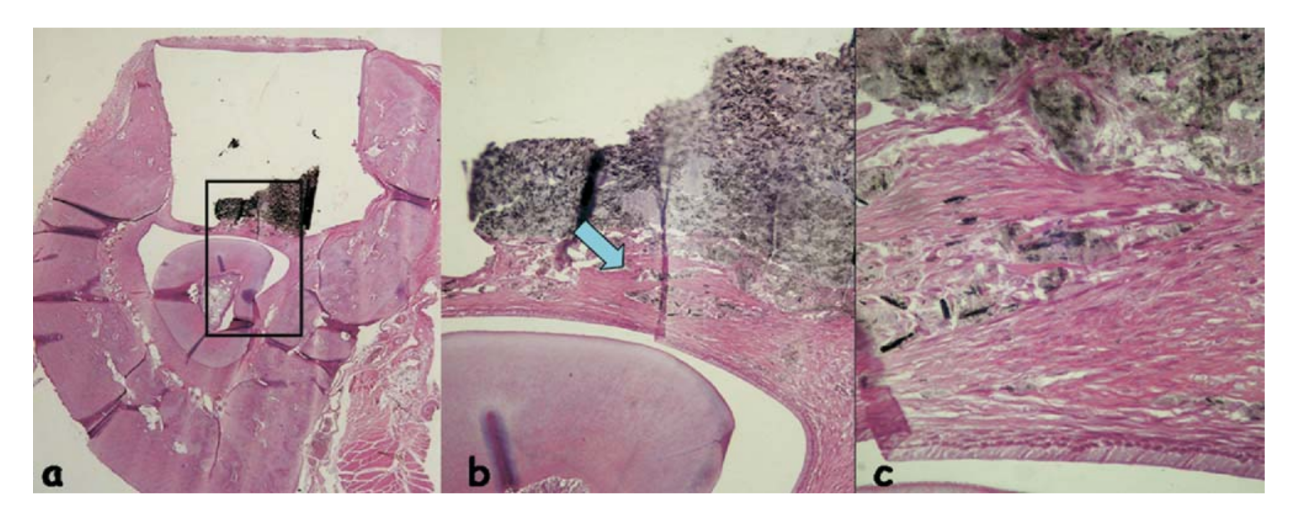
Osservazioni a Dodici Settimane
AH Plus
È stata osservata una reazione infiammatoria cronica classificata come moderata. È stata osservata la presenza di alcune cellule giganti estranee e uno strato sottile di tessuto connettivo interposto tra l'osso newly formato e il materiale impiantato (Fig. 2c).
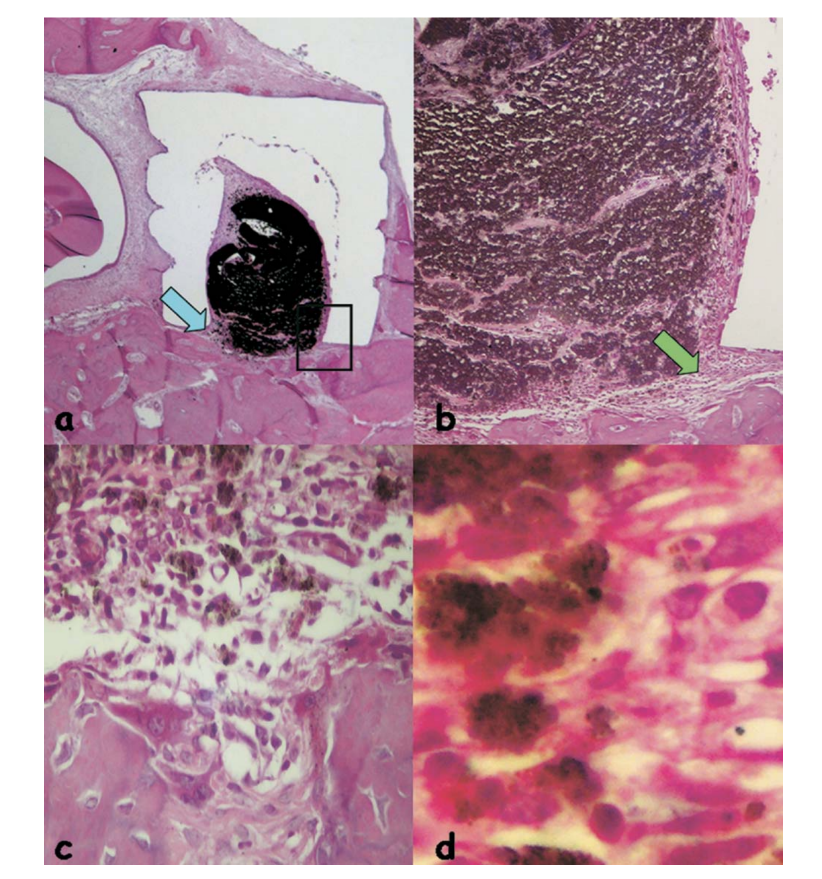
EndoREZ
La reazione infiammatoria era ancora grave con un intenso infiltrato infiammatorio cronico, con prevalenza di linfociti, macrofagi e cellule giganti estranee (Fig. 4b). È stata osservata la presenza di materiale disperso, aree emorragiche e vasi iperemici (Fig. 4c).
Epifania
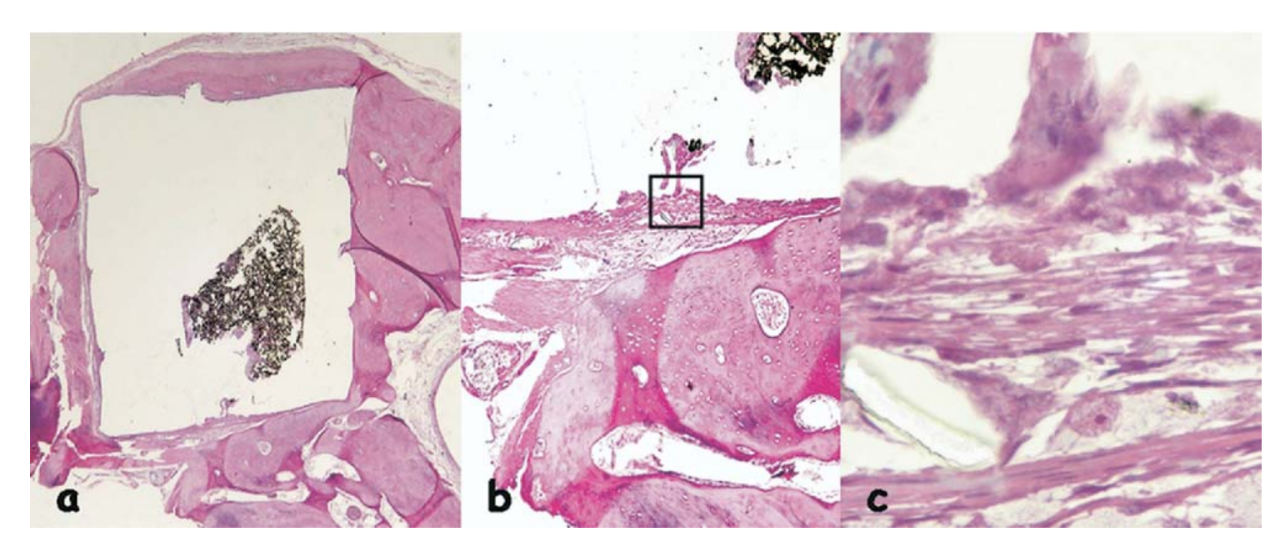
La reazione infiammatoria è stata classificata come assente a lieve. È stata osservata l'apposizione di un osso sano neoformato vicino al materiale (Fig. 6b) e uno strato sottile di tessuto connettivo adiacente al materiale testato senza cellule infiammatorie (Fig. 6c, d).
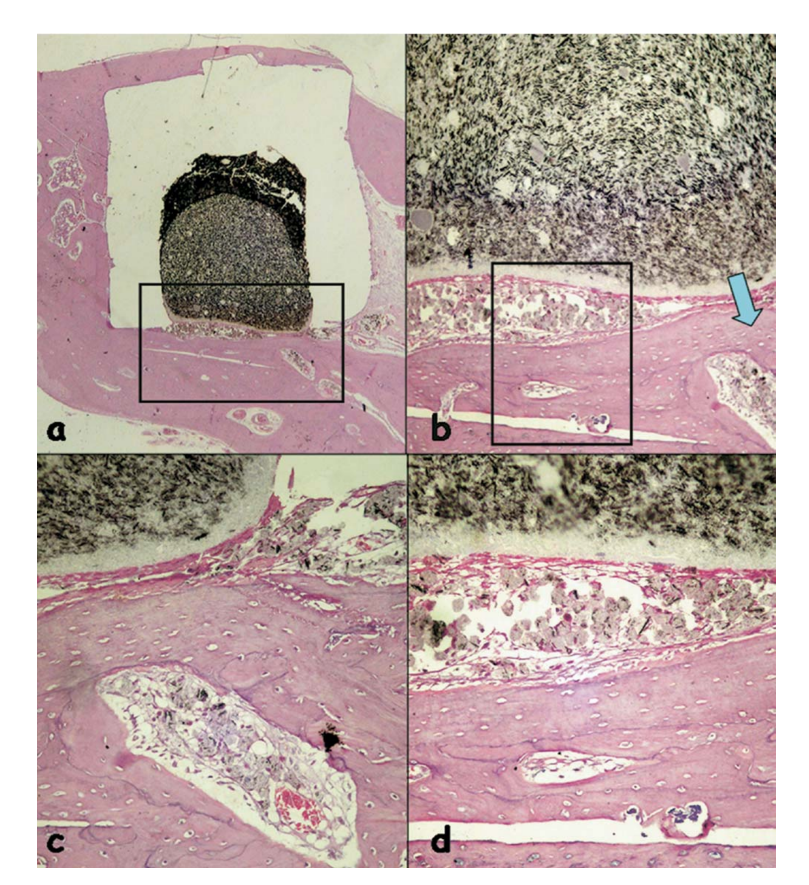
(b) apposizione di un osso sano neoformato vicino al materiale (area delineata in a) (H&E, ingrandimento originale 40x); (c) dettaglio dell'osso sano neoformato
(freccia blu in b) (H&E, ingrandimento originale 100x); (d) strato sottile di tessuto connettivo giustapposto al materiale testato (area delineata in b) (H&E, ingrandimento
originale 200x).
Discussione
Quando un nuovo materiale viene introdotto sul mercato, o un materiale esistente viene proposto per un'applicazione diversa, le sue proprietà devono essere investigate e i risultati ottenuti devono essere confrontati con i risultati ottenuti da altri ricercatori. Negli Stati Uniti, la Food and Drug Administration (FDA) aveva la responsabilità di valutare e analizzare gli effetti biologici di tutti i farmaci, materiali e dispositivi utilizzati negli esseri umani, compresi la maggior parte dei prodotti e dispositivi dentali. La FDA ha anche previsto il riconoscimento degli standard stabiliti da organizzazioni private, come l'ANSI/ADA. La revisione delle prime Pratiche Standard Raccomandate per la Valutazione Biologica dei Materiali Dentali è stata ritardata per incorporare gli elementi essenziali delle raccomandazioni della FDA. Questo nuovo documento non intendeva scoraggiare lo sviluppo industriale di nuovi e migliorati prodotti dentali richiedendo test biologici eccessivi. Tuttavia, in quest'era di preoccupazione per i rischi chimici, dovrebbe essere sviluppato un profilo di tossicità per tutti i nuovi e migliorati materiali per ottenere dati pertinenti sulla sicurezza e sull'efficacia. Anche se nessuna quantità di studio sperimentale può garantire una sicurezza assoluta per qualsiasi sostanza, le indagini tossicologiche forniscono dati dai quali possono essere fatte proiezioni e previsioni ragionevoli sulle condizioni sotto le quali l'agente può essere utilizzato in sicurezza.
Sebbene molti test come la citotossicità, l'emolisi, il test di Ame, la trasformazione cellulare di Styles, le impiantazioni sottocutanee e ossee, la sensibilizzazione e il test di utilizzo endodontico siano elencati per vari livelli di test, non sono tutti richiesti per ciascun prodotto. Deve essere fatta una valutazione su quali test siano rilevanti. I test iniziali servono a fornire un profilo di tossicità in un sistema biologico, in modo che, su base comparativa, il produttore possa avere un'idea generale e una realizzazione di dove si colloca il suo prodotto. I dispositivi regolamentati dalla FDA rientrano in tre classi, tuttavia, uno di quelli che include la maggior parte dei dispositivi e degli apparecchi dentali non sarebbe soggetto alla definizione di standard per l'autorizzazione pre-commerciale. In altre parole, a volte, anche i test di sicurezza di base non sono richiesti prima che i prodotti possano essere promossi per uso clinico.
La biocompatibilità dei materiali dentali è un requisito importante perché i componenti tossici presenti in questi materiali potrebbero produrre irritazione o addirittura degenerazione dei tessuti circostanti, specialmente quando accidentalmente estrusi nei tessuti periradicolari.
Reazioni severe sono state segnalate dopo l'estrusione di alcune sostanze comunemente utilizzate nei tessuti periradicolari. I sigillanti per canali radicolari eccessivamente estesi rappresentano anche un'irritazione chimica, poiché praticamente tutti i sigillanti endodontici sono altamente tossici quando appena preparati. Inoltre, il loro effetto irritante aumenta concepibilmente man mano che aumenta l'area di contatto materiale/tessuto. Pertanto, maggiore è il volume del materiale eccessivamente esteso, maggiore è la superficie di contatto tra il sigillante e il tessuto, e maggiore è l'intensità del danno chimico.
Il test dell'impianto nel tessuto osseo di porcellino d'India, come raccomandato dalla FDI, consente di testare il materiale così come viene utilizzato nella configurazione clinica. Sebbene i risultati non possano essere direttamente estrapolati agli esseri umani, il test è standardizzato e può essere stabilita una comparazione diretta tra i materiali. Le reazioni lungo le pareti esterne della coppa rifletteranno il trauma causato dalle procedure chirurgiche, necessarie per l'impianto. Il teflon stesso ha dimostrato di causare solo un'irritazione insignificante dei tessuti ed è stato utilizzato come portatore a causa della sua biocompatibilità. I nostri risultati hanno confermato l'assenza di reazioni infiammatorie sulla parete laterale dei portatori in entrambi i periodi di osservazione.
AH Plus, un sigillante per canali radicolari a due componenti, basato sulla reazione di polimerizzazione di resina epossidica-ammina, è stato testato per confronto. Il sigillante AH Plus ha mostrato una reazione severa nel periodo di osservazione di 4 settimane che è diminuita a moderata a 12 settimane (Fig. 1 e 2). Il meccanismo che potrebbe spiegare la risposta infiammatoria riguardante il sigillante AH Plus è il rilascio di formaldeide che ha dimostrato di indurre risposte non neoplastiche, come la degenerazione epiteliale e un'infiltrazione di cellule infiammatorie miste, oltre a reazioni allergiche e necrosi del tessuto connettivo. Un altro studio ha dimostrato che alcuni sigillanti presentavano rischi biologici significativi, particolarmente in condizioni appena miscelate. Tuttavia, anche dopo il periodo di indurimento, la tossicità potrebbe ancora esistere. Quindi, le ammine, presenti nella composizione di AH Plus, che accelerano la polimerizzazione, potrebbero essere anche la causa della forte tossicità iniziale. Inoltre, l'attività infiammatoria insieme a un apporto sanguigno intatto nel processo di riparazione dei tessuti potrebbe eliminare la tossicità iniziale del materiale.
Recentemente, è stato introdotto un nuovo sigillante endodontico a base di metacrilato, EndoREZ, come sigillante per canali radicolari. EndoREZ è un materiale idrofilo, a due componenti, a indurimento chimico contenente ossido di zinco, solfato di bario, resine e pigmenti in una matrice di resina dimetacrilato di urethane. Nello studio presente, EndoREZ ha causato una grave reazione infiammatoria in tutti i periodi sperimentali (Fig. 3 e 4). Utilizzando cellule coltivate, è stato dimostrato che EndoREZ diventava più citotossico con il tempo di esposizione e presentava rischi citotossici significativi quando appena mescolato. La reazione del tessuto connettivo ai tubi di silicone riempiti con EndoRez impiantati nel tessuto sottocutaneo dei ratti ha mostrato una reazione severa che ha cambiato significativamente il suo profilo dopo 30 giorni, con una reazione moderata dopo 3 mesi e assenza di infiammazione nel quarto mese di osservazione. Tuttavia, è stato anche riportato che, in alcuni animali, la risposta infiammatoria è persistere in tutti i periodi sperimentali. Si è ritenuto che dopo l'impianto sottocutaneo di EndoREZ fresco, componenti come zinco e bario fossero in contatto diretto con il tessuto, causando quella grave reazione iniziale. In contrasto con i risultati della presente ricerca, Zmener et al. hanno dimostrato una risposta soddisfacente del tessuto osseo nel periodo di osservazione di 60 giorni di EndoREZ impiantato nelle tibie dei ratti. La lenta degradazione del sigillante EndoREZ, illustrata dal materiale disperso, e la successiva endocitosi da parte dei macrofagi potrebbero essere state la causa di tale infiammazione cronica persistente. Inoltre, la terapia canalare eseguita con coni di gutta-percha condensati lateralmente in combinazione con EndoRez sembra presentare un buon tasso di successo complessivo dopo una valutazione di richiamo di 14-24 mesi.
Nel nostro studio, AH Plus ed EndoREZ non hanno mostrato caratteristiche biocompatibili perché la reazione è stata severa in tutti i periodi e, secondo i criteri FDI, il materiale è considerato inaccettabile. Epiphany è un sigillante composito a base di resina dentale dual-curabile la cui matrice di resina è una miscela di bisfenolo-A-glicidil metacrilato, bis-GMA etossilato, resina dimetacrilato urethanico e metacrilati difunzionali idrofili. I risultati ottenuti in questo lavoro hanno dimostrato risposte biologiche ottimali in entrambi i periodi sperimentali per questo materiale (Fig. 5 e 6). Recentemente, in uno studio in vivo, Epiphany è stato associato a una minore parodontite apicale. Gli autori hanno correlato questa scoperta alla superiore resistenza alla perdita coronale di Epiphany, dimostrata in un lavoro precedente. Tuttavia, Versiani et al., testando la solubilità di Epiphany, hanno dimostrato che era superiore a quella stabilita dalla Specifica ANSI/ADA 57. L'acqua distillata deionizzata utilizzata per il test di solubilità è stata sottoposta a spettrometria di assorbimento atomico e ha mostrato un'ampia liberazione di calcio (41,46 mg/L). Questa elevata liberazione di calcio da parte di Epiphany potrebbe spiegare la ridotta parodontite apicale osservata clinicamente e i risultati del presente lavoro. Il rilascio di ioni calcio ha dimostrato di favorire un pH ambientale più alcalino, portando a effetti biochimici che culminano nell'accelerazione del processo di riparazione.
Conclusione
Secondo i criteri FDI, i risultati ottenuti in questo studio hanno permesso di concludere che il sigillante per canali radicolari Epiphany è stato l'unico materiale che ha presentato biocompatibilità intraossea nei due periodi analizzati.
Autori: Cássio J. A. Sousa, Cristiana R. M. Montes, Elizeu A. Pascon, Adriano M. Loyola, Marco A. Versiani
Riferimenti:
- Sousa CJA, Loyola AM, Versiani MA, Biffi JCG, Oliveira RP, Pascon EA. Una valutazione istologica comparativa della biocompatibilità dei materiali utilizzati nella chirurgia apicale. Int Endod J 2004;37:738 – 48.
- Siqueira JF Jr. Reazione dei tessuti periradicolari al trattamento canalare: benefici e svantaggi. Endod Topics 2005;10:123– 47.
- Nair PNR. Patogenesi della parodontite apicale e le cause dei fallimenti endodontici. Crit Rev Oral Biol Med 2004;15:348 – 81.
- Spångberg L. Effetti biologici dei materiali di riempimento dei canali radicolari. Parte 7. Reazione del tessuto osseo al materiale di riempimento dei canali radicolari impiantato nei porcellini d'India. Odontol Tidsk 1969;77:133–59.
- Stanley HR. Test di tossicità dei materiali dentali. Stati Uniti: CRC Press, 1985.
- Zmener O, Banegas G, Pameijer CH. Risposta del tessuto osseo a un sigillante endodontico a base di metacrilato: uno studio istologico e istometrico. J Endod 2005;31:457–9.
- Dichiarazione sui compositi a base di resina posteriori. Consiglio delle Affari Scientifici ADA: Consiglio ADA sui Programmi di Beneficio Dentale 1998;129:1627– 8.
- Tay FR, Loushine RJ, Weller RN, et al. Valutazione ultrastrutturale del sigillo apicale in radici riempite con un materiale di riempimento per canali radicolari a base di policaprolattone. J Endod 2005;31:514 –9.
- Boiullaguet S, Wataha JC, Lockwood PE, Galgano C, Golay A, Krejci I. Citotossicità e proprietà di sigillatura di quattro classi di sigillanti endodontici valutate mediante attività della succinato deidrogenasi e microscopia confocale a scansione laser. Eur J Oral Sci 2004;112:182–7.
- Louw NP, Pameijer CH, Norval G. Valutazione istopatologica di un sigillante per canali radicolari in primati subumani [Abstract]. J Dent Res 2001;80:654
- Zmener O. Risposta dei tessuti a un nuovo sigillante per canali radicolari a base di metacrilato: osservazioni preliminari nel tessuto connettivo sottocutaneo dei ratti. J Endod 2004;30:348 –51.
- Zmener O, Pameijer CH. Valutazione clinica e radiografica di un sigillante per canali radicolari a base di resina. Am J Dent 2004;17:19 –22.
- Shipper G, Teixeira FB, Arnold RR, Trope M. Infiammazione periapicale dopo inoculazione microbica coronale di radici canine riempite con guttaperca o Resilon. J Endod 2005;31:91– 6.
- Bergenholtz G, Spångberg L. Controversie in endodonzia. Crit Rev Oral Biol Med 2004;15:99 –114.
- Fédération Dentaire Internationale. Pratiche standard raccomandate per la valutazione biologica dei materiali dentali. Int Dent J 1980;30:174 – 6.
- Huang FM, Tsai CH, Yang SF, Chang YC. Induzione dell'espressione genica di interleuchina-6 e interleuchina-8 da parte dei sigillanti per canali radicolari in cellule osteoblastiche umane. J Endod 2005;31:679 – 83.
- Lindgren P, Eriksson K-F, Ringberg A. Grave ischemia facciale dopo trattamento endodontico. J Oral Maxillofac Surg 2002;60:576 –9.
- Spångberg L, Pascon EA. L'importanza della preparazione del materiale per l'espressione di citotossicità durante la valutazione in vitro dei biomateriali. J Endod 1988;14:247–50.
- Cohen BI, Pagnillo MK, Musikant BL, Dentsch AS. Valutazione del rilascio di formaldeide per tre materiali di riempimento endodontico. Oral Health 1998;88:37–9.
- Leonardo MR, de Silva LAB, Filho MT, de Silva RS. Rilascio di formaldeide da 4 sigillanti endodontici. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999;88:221–5.
- Morgan KT, Gross EA, Patterson DL. Distribuzione, progressione e recupero dell'inibizione acuta della funzione mucociliare nasale indotta da formaldeide nei ratti F-344. Toxicol Appl Pharmacol 1983;86:161–76.
- Kaplan AE, Ormaechea MF, Picca M, Canzobre MC, Ubios AM. Proprietà reologiche e biocompatibilità dei sigillanti endodontici. Int Endod J 2003;36:527–32.
- Di Felice R, Lombardi T. Necrosi gengivale e dell'osso mandibolare causata da una pasta contenente paraformaldeide. Endod Dent Traumatol 1998;14:196 – 8.
- Matsumoto K, Inoue K, Matsumoto A. L'effetto di nuovi sigillanti per canali radicolari sul tessuto polpa dentale di ratto in coltura primaria. J Endod 1989;15:60 –7.
- Zmener O, Spielberg C, Lamberghini F, Rucci M. Proprietà di sigillatura di un nuovo sigillante per canali radicolari a base di resina epossidica. Int Endod J 1997;30:332– 4.
- Miletić I, Devčić N, Anić I, Borčić J, Karlović Z, Osmak M. La citotossicità di Roeko-Seal e AH Plus confrontata durante diversi periodi di indurimento. J Endod 2005;31:307–9.
- Zmener O, Pameijer CH. Valutazione clinica e radiografica di un sigillante per canali radicolari a base di resina. Am J Dent 2004;17:19 –22.
- Teixeira FB, Teixeira ECN, Thompson JY, Trope M. Resistenza alla frattura di radici trattate endodonticamente con un nuovo materiale di riempimento in resina. J Am Dent Assoc 2004;135:646 –52.
- Shipper G, Trope M. Perdita microbica in vitro di denti trattati endodonticamente utilizzando nuove e standard tecniche di otturazione. J Endod 2004;30:154 – 8.
- Versiani MA, Carvalho-Júnior JR, Sasaki E, et al. Uno studio comparativo delle proprietà fisico-chimiche dei sigillanti per canali radicolari AH Plus™ e Epiphany™. Int Endod J (in press).
- ANSI/ADA Specification No. 57. Materiale di sigillatura endodontica. Washington: USA. 2000.
- Seux D, Couble ML, Hartmann DJ, Gauthier JP, Magloire H. Citodifferenziazione simile agli odontoblasti della polpa dentale umana ‘in vitro’ in presenza di un cemento contenente idrossido di calcio. Arch Oral Biol 1991;36:117–28.
