Analisi Batteriologica e Micro–Tomografica Correlativa dei Canali Mesiali dei Molari Mandibolari Preparati con File Autoadattabili, Reciproc e Sistemi a File Ritorti
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo) .
Abstract
Introduzione: Questo studio ex vivo ha valutato la capacità disinfettante e di modellamento di 3 protocolli utilizzati nella preparazione dei canali radicolari mesiali dei molari mandibolari mediante analisi batteriologica e micro-tomografica (mCT) correlative.
Metodi: I canali mesiali di molari mandibolari estratti sono stati contaminati con Enterococcus faecalis per 30 giorni e assegnati a 3 gruppi in base alla loro configurazione anatomica come determinato dall'analisi mCT secondo la tecnica di preparazione (Self-Adjusting File [ReDent-Nova, Ra’anana, Israele], Reciproc [VDW, Monaco, Germania] e Twisted File [SybronEndo, Orange, CA]). In tutti i gruppi, il 2,5% di NaOCl è stato l'irrigante. I campioni dei canali sono stati prelevati prima (S1) e dopo la strumentazione (S2), e la quantificazione batterica è stata eseguita utilizzando la coltura. Successivamente, le radici mesiali sono state sottoposte a un'ulteriore analisi mCT per valutare il modellamento dei canali.
Risultati: Tutti i protocolli di strumentazione hanno promosso una riduzione batterica intracanalare altamente significativa (P< .001). I confronti quantitativi e qualitativi tra i gruppi non hanno rivelato differenze significative (P> .05). Per quanto riguarda il modellamento, non è stata osservata alcuna differenza statistica tra le tecniche riguardo alla percentuale media di aumento del volume, l'aumento dell'area superficiale, l'area superficiale non preparata e l'area superficiale relativa non preparata (P> .05). L'analisi correlative non ha mostrato alcuna relazione statisticamente significativa tra la riduzione batterica e la percentuale media di aumento dei parametri analizzati (P> .05).
Conclusioni: I 3 sistemi di strumentazione hanno prestazioni simili di disinfezione e modellamento nella preparazione dei canali mesiali dei molari mandibolari. (J Endod 2013;39:1044–1050)
Gli obiettivi principali della preparazione chimico-meccanica sono la pulizia e il modellamento del canale radicolare. Sebbene distinti, questi obiettivi vengono raggiunti simultaneamente durante la preparazione attraverso l'uso di strumenti e irriganti. Nei canali radicolari infetti, è necessaria anche la disinfezione, e il miglior risultato terapeutico si ottiene solitamente quando l'infezione del canale radicolare è eradicata o ridotta a livelli compatibili con la guarigione periradicolare. Considerando che l'infezione residua è un importante fattore di rischio per la parodontite apicale post-trattamento, la preparazione chimico-meccanica assume un ruolo fondamentale nel trattamento poiché agisce meccanicamente e chimicamente sulle comunità batteriche che colonizzano il canale principale.
Numerosi studi hanno dimostrato che, indipendentemente dalla tecnica di strumentazione e dagli strumenti/irriganti utilizzati, le procedure chimico-meccaniche non sono in grado di promuovere una pulizia, disinfezione e modellamento approfonditi del canale radicolare, specialmente nei canali curvi o nei casi con anatomie insolite. Sebbene il canale principale e le irregolarità anatomiche minori siano generalmente incorporate nella preparazione, i residui di tessuto e i batteri presenti in altre aree come istmi, canali laterali e ramificazioni apicali rimangono solitamente non influenzati dalla preparazione a causa delle limitazioni fisiche intrinseche degli strumenti e del breve tempo di permanenza degli irriganti all'interno del canale radicolare. Inoltre, anche aree del canale radicolare principale hanno dimostrato di rimanere intatte dagli strumenti.
Al fine di aggirare tali limitazioni e rendere la pulizia, la disinfezione e la modellazione più prevedibili, sono state ideate modifiche agli strumenti e alle tecniche. Il File Auto-Regolante (SAF) (ReDent-Nova, Ra’anana, Israele) è un esempio di strumento modificato progettato per adattarsi all'anatomia principale del canale radicolare. Studi hanno dimostrato che il SAF promuove una maggiore pulizia, disinfezione e modellazione rispetto agli strumenti endodontici convenzionali. Si raccomanda di utilizzare il SAF come tecnica a strumento singolo e, in questa stessa linea, sono stati introdotti anche altri sistemi, come Reciproc (VDW, Monaco, Germania). A differenza del SAF, questi strumenti hanno un albero elicoidale e non sono sostanzialmente diversi dagli strumenti rotatori convenzionali, ma si propone che vengano utilizzati in movimento reciproco. Studi hanno dimostrato che le tecniche di strumentazione a file singola che utilizzano questi strumenti elicoidali possono promuovere effetti di pulizia e modellazione comparabili con l'istrumentazione con un'intera serie di strumenti rotatori. Non ci sono molti studi che valutano la capacità disinfettante dei sistemi a file singola, ma uno recente ha mostrato che non ci sono differenze significative nella riduzione batterica intracanalare indotta da Reciproc e da un'intera serie di strumenti, a condizione che il volume degli irriganti e il tempo di irrigazione siano mantenuti simili.
La tomografia computerizzata micro–tomografica (mCT) è stata ampiamente utilizzata per valutare ex vivo la capacità di modellamento degli strumenti e delle tecniche. L'imaging mCT offre una tecnica non invasiva e riproducibile per la valutazione tridimensionale (3D) del sistema dei canali radicolari prima e dopo la preparazione, e può essere applicata sia in modo quantitativo che qualitativo. Utilizzando questa metodologia, è stato dimostrato che una vasta area delle pareti del canale radicolare principale rimane intatta dopo la preparazione, indipendentemente dalla tecnica di strumentazione o dallo strumento utilizzato. Di conseguenza, i biofilm batterici aderenti alle pareti possono rimanere non influenzati in queste regioni. Per la valutazione della capacità disinfettante degli strumenti, delle tecniche e degli irriganti, è stato ampiamente utilizzato un modello di disinfezione del canale ex vivo che ha impiegato denti estratti con canali contaminati da Enterococcus faecalis. Sebbene molto utile per confronti tra diversi protocolli, questo modello sperimentale fornisce informazioni sulla persistenza batterica, ma la posizione dell'infezione persistente non può essere accertata. La microscopia potrebbe essere aggiunta per questa analisi, ma la sua natura distruttiva preclude l'analisi del canale radicolare prima dell'istrumentazione. Inoltre, poiché non fornisce un'immagine 3D, la qualità della preparazione non può essere valutata. Lo scopo di questo studio ex vivo era di valutare la capacità disinfettante e di modellamento di 3 protocolli di strumentazione utilizzati nella preparazione dei canali radicolari mesiali dei molari mandibolari estratti mediante un'analisi batteriologica e mCT correlativa.
Materiali e Metodi
Selezione e Preparazione dei Campioni
Questo studio ha utilizzato radici mesiali dritte o leggermente curve di molari mandibolari estratti per motivi non correlati a questo studio. L'approvazione per il protocollo dello studio è stata ottenuta dal Comitato Etico dell'Università Estácio de Sá, Rio de Janeiro, RJ, Brasile. I denti sono stati inizialmente selezionati sulla base di radiografie effettuate sia in direzione buccolinguale che mesiodistale. Sono stati inclusi solo denti con 2 canali mesiali e senza calcificazioni significative. Sono state preparate cavità d'accesso e sono state eseguite emiresezioni dei molari utilizzando dischi diamantati. La sezione mesiale (radice e corona) è stata utilizzata nello studio. Le cuspidi sono state ridotte fino a quando tutti i campioni non erano di circa 13 mm di lunghezza. I canali radicolari mesiali sono stati esplorati utilizzando file K di dimensione 08 e 10, e solo quelle radici con 2 forami apicali indipendenti sono state mantenute nello studio.
Tutti i canali radicolari sono stati strumenti 1 mm oltre il forame apicale fino a una file K manuale di dimensione 20 in movimenti rotatori alternati sotto irrigazione continua con acqua. Questo è stato eseguito per standardizzare il diametro iniziale del canale radicolare e creare spazio per ulteriori contaminazioni dei canali. Lo strato di smear è stato rimosso utilizzando irrigazione con EDTA al 17% e ipoclorito di sodio (NaOCl) al 2,5%. Il NaOCl è stato inattivato con tiosolfato di sodio al 10%.
Analisi mCT dei Canali Radicolari
L'analisi morfometrica del canale radicolare è stata eseguita utilizzando l'imaging mCT. Dal campione iniziale, 18 campioni sono stati selezionati casualmente, essiccati, montati su un attacco personalizzato e scansionati utilizzando uno scanner mCT (SkyScan 1174v2; Bruker-microCT, Kontich, Belgio) a una risoluzione isotropica di 16,7 mm. La scansione è stata eseguita con una rotazione di 180° attorno all'asse verticale con un passo di rotazione di 1,0 utilizzando un filtro in alluminio spesso 0,5 mm. Le immagini di ciascun campione sono state ricostruite con un software dedicato (NRecon v.1.6.3, Bruker-microCT) fornendo sezioni trasversali assiali della struttura interna dei campioni. Il software CTAn v.1.12 (Bruker-microCT) è stato utilizzato per la valutazione 3D del canale radicolare riguardo al volume e all'area superficiale. Il volume è stato calcolato come il volume degli oggetti binarizzati all'interno del volume di interesse. Per la misurazione dell'area superficiale, sono stati utilizzati 2 componenti della superficie: (1) i perimetri degli oggetti binarizzati su ciascun livello di sezione trasversale e (2) le superfici verticali esposte dalle differenze di pixel tra sezioni trasversali adiacenti. Il software CTVol v.2.2.1 (Bruker-microCT) è stato utilizzato per la visualizzazione e la valutazione qualitativa della configurazione del sistema del canale radicolare.
I campioni sono stati abbinati in terne sulla base della configurazione anatomica del canale radicolare valutata tramite imaging mCT. Un campione di ciascun terzetto è stato assegnato casualmente a 1 dei 3 gruppi sperimentali. Dopo aver verificato l'assunzione di normalità (il test di Shapiro-Wilk), è stato valutato il grado di omogeneità (di base) dei 3 gruppi, rispetto ai suddetti parametri 3D, utilizzando un'analisi della varianza a un fattore con un livello di confidenza fissato al 5%. Successivamente, è stata utilizzata una moneta per definire quale gruppo di denti sarebbe stato trattato con ciascuna delle seguenti tecniche di preparazione del canale radicolare: sistemi SAF, Reciproc o Twisted File (TF; SybronEndo, Orange, CA).
Contaminazione Batterica
Le 18 radici mesiali selezionate tramite screening mCT sono state utilizzate nell'analisi batteriologica/mCT correlativa. Per rafforzare il potere statistico dell'analisi batteriologica, sono stati inclusi altri 18 campioni, selezionati sulla base di radiografie. Entrambi i canali mesiali sono stati utilizzati nell'esperimento, per un totale di 36 radici (72 canali) per l'analisi batteriologica (24 canali per gruppo sperimentale). Cinque radici mesiali sono state utilizzate come controlli: 3 per l'esperimento batteriologico e 2 per la microscopia elettronica a scansione.
I canali radicolari sono stati riempiti con brodo di trypticase soy preparato di fresco (Difco, Detroit, MI), immersi nello stesso brodo e sottoposti a ultrasuoni per 1 minuto per rilasciare aria intrappolata e consentire la penetrazione del mezzo di coltura nelle irregolarità del canale radicolare. Successivamente, i campioni dentali sono stati sterilizzati in un autoclave. Il ceppo E. faecalis della American Type Culture Collection 29212 è stato utilizzato per la contaminazione del canale radicolare per 30 giorni a 37°C sotto agitazione delicata, con il mezzo di coltura che veniva rifornito ogni settimana. Dopo il periodo di contaminazione, tutti i denti avevano l'eccesso di mezzo di coltura gocciolato e la loro superficie radicolare esterna pulita con garza sterile. Due denti sono stati fissati in formalina tamponata al 10% e processati per analisi al microscopio elettronico a scansione per confermare la colonizzazione batterica del canale radicolare come descritto in precedenza. Sei canali mesiali contaminati ma non strumentati, che sono stati irrigati con le stesse sostanze e volumi dei gruppi sperimentali, hanno servito come gruppo di controllo positivo.
Le foramine apicali di ciascun dente mesiale sono state sigillate con resina epossidica a rapida essiccazione per prevenire perdite batteriche apicali e creare un canale a fondo chiuso che produce l'effetto di blocco del vapore. I denti sono stati montati verticalmente fino alla regione cervicale in blocchi realizzati con un materiale per impressioni in silicone (President Jet; Coltène AG, Cuyahoga Falls, OH). La corona del dente, comprese le pareti della camera pulpare, e la superficie in silicone sono state disinfettate con NaOCl al 2,5% seguita dall'inattivazione di questa sostanza con tiosolfato di sodio al 10%. Successivamente, è stata determinata la lunghezza di lavoro (WL) introducendo un file K di dimensione 10 nel canale fino a raggiungere il forame apicale, e sono stati prelevati campioni batteriologici iniziali (S1) da tutti i canali prima della preparazione come segue. Il canale radicolare è stato risciacquato con 1 mL di soluzione salina sterile al 0,85% per rimuovere le cellule non attaccate, e un campione iniziale è stato prelevato mediante l'uso sequenziale di 3-5 punti di carta posizionati fino alla WL.
Ogni punto di carta è rimasto nel canale per 1 minuto. I punti di carta sono stati trasferiti in tubi contenenti 1 mL di soluzione salina sterile e immediatamente elaborati per analisi colturale.
Prima dell'strumentazione, tutti i canali radicolari hanno ricevuto un'irrigazione iniziale con 2 mL di NaOCl al 2,5% seguita da un ingrandimento coronale utilizzando un file RaCe di dimensione 25, con un cono di 0,08 mm/mm (BR0; FKG Dentaire, La Chaux-de-Fonds, Svizzera). Successivamente, i canali radicolari sono stati nuovamente irrigati con 2 mL di NaOCl al 2,5% e un file K di tipo 15 è stato utilizzato fino alla lunghezza di lavoro (WL) per confermare la pervietà. I passaggi seguenti differivano a seconda di ciascun gruppo sperimentale.
Gruppo SAF
I canali sono stati strumentati fino alla WL utilizzando un file RaCe di dimensione 25, con un cono di 0,04 mm/mm (FKG Dentaire). Dopo l'irrigazione con 2 mL di NaOCl al 2,5%, lo strumento SAF è stato inserito nel canale e azionato con un movimento di entrata e uscita fino alla WL per un totale di 3 minuti. È stato utilizzato un SAF di diametro 1,5 mm in un manipolo vibrante (GENTLEpower; KaVo, Bieberach an der Riß, Germania) combinato con una testa RDT3 (ReDent-Nova) a una frequenza di 5000 movimenti al minuto e un'ampiezza di 0,4 mm. L'irrigazione continua con NaOCl al 2,5% è stata applicata durante tutta la procedura a una portata di 2 mL/min (totale = 6 mL per canale) utilizzando un apparecchio di irrigazione speciale (VATEA, ReDent-Nova).
Gruppo Reciproc
Lo strumento Reciproc R25 è stato utilizzato in un movimento reciproco alimentato da un motore elettrico a coppia limitata (VDW Silver) utilizzando le impostazioni preimpostate. Lo strumento è stato introdotto nel canale fino a quando non si è avvertita resistenza e poi attivato. È stato spostato in direzione apicale utilizzando un movimento di picchiettamento in entrata e uscita di circa 3 mm di ampiezza con leggera pressione apicale. Dopo 3 movimenti di picchiettamento, lo strumento è stato rimosso e pulito, e il canale è stato irrigato con 2 mL di NaOCl. La pervietà del canale è stata controllata utilizzando un file K di tipo 15 fino alla WL. Questo protocollo è stato ripetuto fino a quando lo strumento R25 ha raggiunto la WL. L'irrigazione è stata eseguita con siringhe monouso e aghi NaviTip da 30-G (Ultradent, South Jordan, UT) portati fino a 4 mm prima della WL.
Gruppo TF
In questo gruppo, i canali radicolari sono stati preparati utilizzando la seguente sequenza di strumenti TF: 25/0.08, 25/0.06 e 25/0.04 in modo crown-down, operati a 500 rpm, in rotazione continua oraria, con il motore VDW Silver. Ogni strumento è stato introdotto nel canale mentre ruotava fino a quando non ha ingaggiato la dentina. Poi, è stato ritirato e il canale è stato irrigato con 2 mL di NaOCl e controllato per la pervietà apicale con un file K di tipo 15. L'irrigazione è stata eseguita come nel gruppo Reciproc. La preparazione è stata completata lavorando con il TF 25/0.06 alla WL e il canale irrigato con 2 mL di NaOCl.
Dopo che la preparazione è stata completata, il film di smear è stato rimosso risciacquando il canale con 2 mL di EDTA al 17% per 1 minuto, seguito da 2 mL di NaOCl al 2,5%. Il NaOCl è stato inattivato risciacquando il canale con 1 mL di tiosolfato di sodio al 10%, che è stato lasciato nel canale per 5 minuti. Dopo un ulteriore irrigazione con 1 mL di tiosolfato di sodio, è stato prelevato un campione batteriologico post-preparazione (S2) come descritto per S1. In tutti i gruppi, è stato utilizzato un volume totale di 14 mL di NaOCl al 2,5% per canale.
Quantificazione Batterica
I campioni sono stati diluiti in serie 10 volte in soluzione salina (fino a 10—5 in S1 e 10—3 in S2). Successivamente, aliquote di 100 mL sono state inoculate su piastre di agar Mitis-Salivarius (Difco) e incubate a 37°C per 48 ore. Le unità formanti colonia cresciute sono state contate e una reazione a catena della polimerasi specifica per specie è stata eseguita per confermare l'identificazione di E. faecalis in tutti i campioni positivi.
Analisi mCT della Preparazione del Canale Radicolare
Dopo la preparazione chemomeccanica e il prelievo di S2, i 18 campioni scansionati nella prima parte di questo studio sono stati sterilizzati in autoclave, asciugati e sottoposti a una nuova scansione mCT applicando le stesse impostazioni di parametro. La sovrapposizione delle immagini pre e post-preparazione dei canali radicolari è stata eseguita mediante un software di registrazione precedentemente convalidato (Mosaic 0.05; Istituto di Comunicazione e Sistemi Informatici, Atene, Grecia). I modelli di canale radicolare codificati a colori (il verde indica le superfici del canale preoperatorie e il rosso quelle postoperatorie) hanno consentito un confronto qualitativo dei canali radicolari abbinati prima e dopo la modellazione con il software CTVol v.2.2.1 (Bruker-microCT). CTAn v.1.12 (Bruker-microCT) è stato utilizzato per analisi di volume e area superficiale.
La percentuale media di aumento (%D) di ciascun parametro analizzato è stata calcolata come segue: ([Pa — Pb]/Pb)*100, dove Pb e Pa sono il volume totale o l'area superficiale del canale radicolare prima e dopo la preparazione, rispettivamente. I modelli di superficie registrati spazialmente delle radici, prima e dopo la preparazione, sono stati confrontati per valutare la percentuale di area superficiale non preparata rimanente. Questa variabile è stata calcolata utilizzando le distanze tra la superficie dei canali radicolari prima e dopo la preparazione che erano state determinate in ogni punto della superficie.
Quando era presente un istmo, il suo volume e area relativi sono stati valutati. In questo studio, l'istmo è stato definito come la struttura a forma di nastro o sottile tra i 2 canali radicolari mesiali dopo la preparazione. Il suo contributo al volume totale e all'area superficiale del canale radicolare è stato determinato come la percentuale di volume relativo (%RV) e la percentuale di area superficiale relativa (%RA) dell'istmo. Il %RV è stato calcolato come segue: ([Va — RV]/Vb)*100, dove Vb e Va sono il volume totale del canale radicolare prima e dopo la preparazione, rispettivamente, e il RV (volume relativo) è il volume dopo la preparazione senza istmo. Il %RA è stato calcolato con la formula (A — RA/A)*100, dove A è l'area superficiale totale del canale radicolare dopo la preparazione e RA è l'area superficiale dei canali radicolari preparati senza istmo.
Analisi Statistica
Il test dei ranghi congiunti di Wilcoxon è stato utilizzato per confrontare la riduzione intragruppo dei conteggi batterici da S1 a S2. Inoltre, il confronto intergruppo è stato effettuato utilizzando il test di Kruskall-Wallis. Per questo, è stata calcolata la proporzione S2/S1 per ciascun canale e utilizzata per il confronto tra i gruppi. Il calcolo della dimensione del campione ha rivelato che 21 campioni per gruppo sarebbero sufficienti per mostrare una differenza del 5% nelle proporzioni S2/S1, con una potenza del 90%. Ogni gruppo sperimentale è stato confrontato con il gruppo di controllo utilizzando il test di Mann-Whitney U . Per le analisi qualitative intragruppo e intergruppo a coppie (presenza/assenza), è stato utilizzato il test esatto di Fisher.
Nell'analisi mCT, poiché la normalità non poteva essere verificata (test di Shapiro-Wilk, P < .05), la percentuale media di aumento del volume, l'aumento dell'area superficiale, l'area superficiale non preparata, RV e RA sono stati confrontati tra i gruppi utilizzando il test di Kruskal-Wallis e all'interno dei gruppi utilizzando il test t per campioni appaiati. L'analisi di correlazione di Pearson è stata utilizzata per verificare le relazioni tra la riduzione batterica e la percentuale media di aumento dei parametri analizzati utilizzando l'imaging mCT. Le analisi statistiche sono state eseguite con STATISTICA versione 8 (StatSoft, Tulsa, OK) e SPSS versione 17.0 (SPSS Inc, Chicago, IL) con un livello di confidenza fissato al 5%.
Risultati
L'analisi al microscopio elettronico a scansione ha rivelato che E. faecalis colonizzava le pareti del canale radicolare, formando solitamente strutture simili a biofilm (dati non mostrati). La colonizzazione del canale radicolare è stata ulteriormente confermata da risultati positivi in coltura per i campioni S1 di tutti i denti utilizzati nell'esperimento di disinfezione del canale.
Tabella 1 mostra la media, la mediana e l'intervallo dei conteggi di unità formanti colonia (dati quantitativi) osservati per i 3 gruppi di test e il gruppo di controllo. I dati sperimentali sono mostrati per i 18 denti (36 canali) sottoposti ad analisi batteriologiche e mCT e per i complessivi 36 denti (72 canali) che sono stati indagati batteriologicamente. Dei 18 denti sottoposti ad analisi correlativa, solo 7 (39%) hanno mostrato una coltura negativa per entrambi i canali mesiali, indipendentemente dalla tecnica (2 denti dal gruppo Reciproc, 2 dal gruppo SAF e 3 dal gruppo TF). Complessivamente, l'incidenza di colture positive in S2 è stata di 6 su 24 (25%) per il file Reciproc, 7 su 24 (29%) per il SAF e 9 su 24 (37,5%) per il TF. L'analisi quantitativa intragruppo che valuta la riduzione batterica da S1 a S2 in tutti i gruppi ha mostrato che la preparazione chemomeccanica utilizzando i 3 sistemi di strumentazione ha promosso una riduzione batterica altamente significativa (P< .001). Non sono state osservate differenze significative tra i gruppi né per l'analisi quantitativa né per quella qualitativa (P> .05). Tutte le tecniche sono state significativamente migliori rispetto al gruppo di controllo (irrigazione senza strumentazione) nella riduzione dei livelli batterici (P< .001).
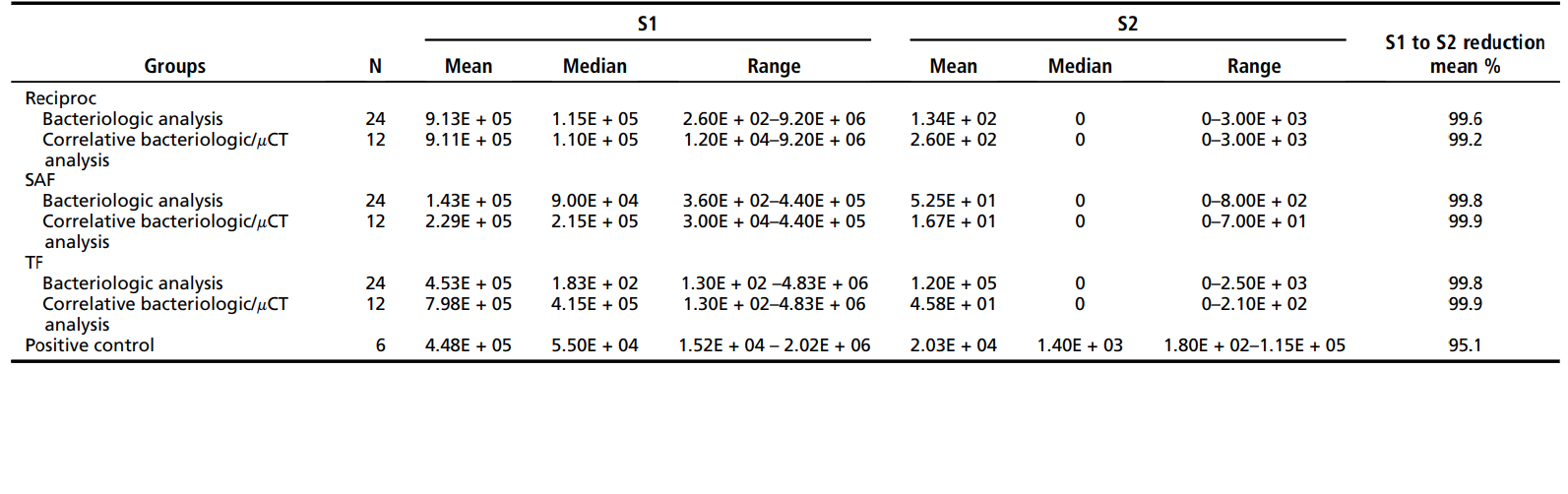
Tabella 2 mostra i dati dell'analisi mCT. Non è stata osservata alcuna differenza statistica tra gli strumenti Reciproc, SAF e TF riguardo alla percentuale media di aumento del volume, all'aumento della superficie e all'area superficiale non preparata (P > .05). L'analisi intragruppo ha rivelato una differenza statisticamente significativa riguardo al volume e alla superficie prima e dopo la preparazione del canale radicolare (P < .05). La %RV e la %RA dell'istmo nei gruppi Reciproc, SAF e TF erano rispettivamente 22.9 ± 15.2 e 23.9 ± 16.2, 16.9 ± 16.51 e 17.5 ± 13.3, e 23.7 ± 16.3 e 23.7 ± 12.8, rispettivamente, senza differenza statistica significativa tra i gruppi (P > .05).
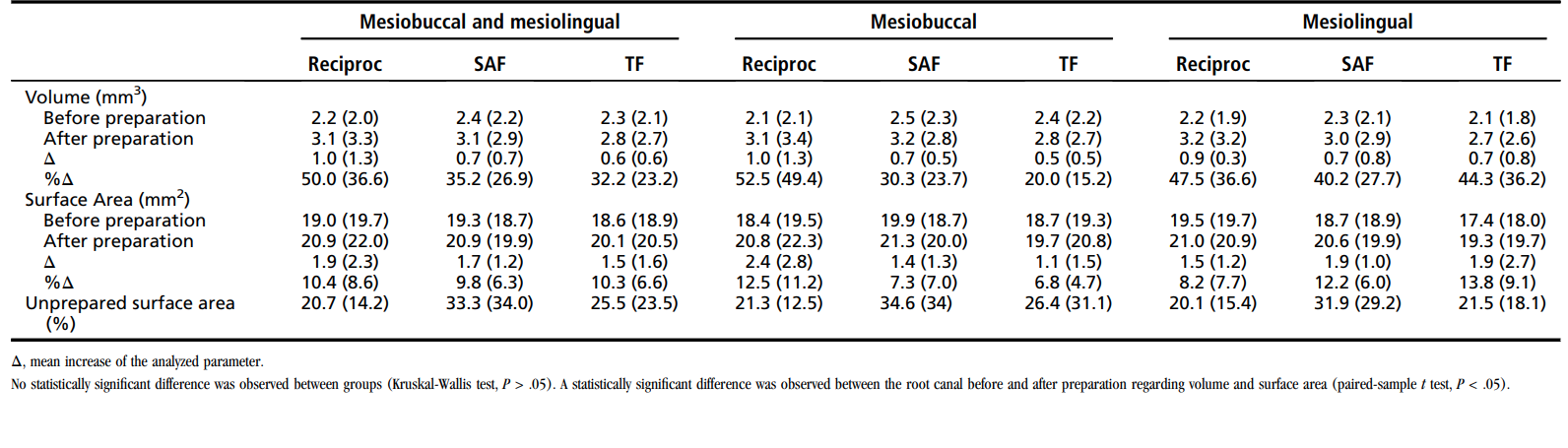
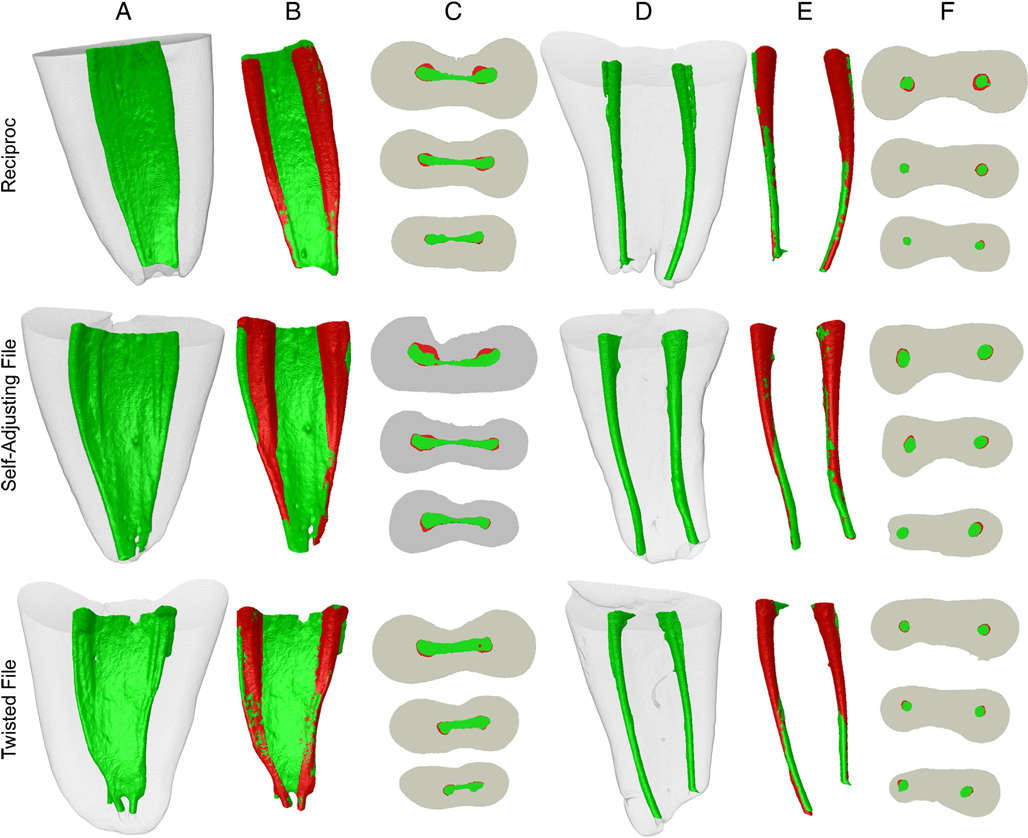
Figura 1A attraverso F mostra esempi rappresentativi di canali radicolari sovrapposti prima e dopo l'istrumentazione del canale in ciascun gruppo. Le modifiche nella forma del canale sono mostrate come sovrapposizioni di aree non preparate (verdi) e preparate (rosse). Il rosso mostra le aree sovrapposte. Tutti i gruppi hanno mostrato più aree non toccate principalmente nell'istmo e nel terzo apicale del canale. Nessuno dei sistemi di strumentazione è stato in grado di preparare tutte le aree superficiali del canale radicolare. L'analisi correlativa non ha mostrato alcuna relazione statisticamente significativa tra la riduzione batterica e l'aumento percentuale medio dei parametri analizzati (P > .05).
Discussione
Il presente protocollo di studio è stato progettato per consentire un'analisi abbinata della capacità di 3 tecniche di strumentazione nel modellare e disinfettare i canali radicolari mesiali dei molari mandibolari. A tal fine, la capacità di modellatura è stata valutata utilizzando l'analisi mCT degli stessi denti sottoposti ad analisi batteriologica.
Un'innovazione del presente studio è stata l'uso dello screening mCT per una selezione adeguata dei denti per il saggio di disinfezione dei canali ex vivo. Studi precedenti hanno selezionato i denti in base all'anatomia esterna e alle radiografie effettuate sia in direzione mesiodistale che buccolinguale. Selezionando i denti in base all'anatomia interna rivelata dallo screening mCT, ci si aspetta una migliore distribuzione dei campioni tra i gruppi, eliminando potenziali bias significativi che potrebbero interferire con i risultati. Le misurazioni del volume e dell'area superficiale del canale radicolare non sono state utilizzate in questo studio per la selezione dei denti e la distribuzione tra i gruppi e sarebbero informazioni aggiuntive interessanti per studi futuri. Tuttavia, questi fattori non sono stati trovati interferire con i risultati, come dimostrato statisticamente.
L'analisi batteriologica ha mostrato che la preparazione chemomeccanica con i 3 diversi sistemi è stata statisticamente ugualmente efficace nel promuovere una riduzione altamente significativa dei conteggi batterici intracanalari. Tuttavia, molti casi presentavano ancora batteri rilevabili dopo l'istrumentazione. L'incidenza di colture positive nei campioni S2 (analisi qualitativa) variava dal 25% (gruppo Reciproc) al 37,5% (gruppo TF), il che è in consonanza con studi precedenti ex vivo e in vivo. Vale la pena sottolineare che la maggior parte degli studi precedenti si basava su canali di denti monoradicolati, mentre nello studio attuale sono state utilizzate le radici mesiali dei molari mandibolari, che si prevede presentino una maggiore complessità anatomica. I risultati attuali confermano che, sebbene la preparazione chemomeccanica possa essere considerata il passo principale in termini di controllo dell'infezione, potrebbe non essere sufficiente per disinfettare in modo prevedibile i canali radicolari, indipendentemente dagli strumenti utilizzati. I batteri rimanenti sono concepibilmente annidati in aree non preparate e recessi del canale principale, così come in istmi e altre irregolarità del sistema canalare. La principale sfida terapeutica è raggiungerli e eliminarli in quelle posizioni.
Le tecniche a file singola sono state recentemente raccomandate per la preparazione dei canali radicolari, e nuovi strumenti sono stati lanciati principalmente basati su opinioni e comodità piuttosto che su efficacia dimostrata. Tuttavia, è stato dimostrato che le capacità di modellatura e disinfezione di questi sistemi sono comparabili con quelle degli strumenti convenzionali che utilizzano un'ampia gamma di strumenti. Questi risultati sono stati confermati nello studio presente sia per la disinfezione che per la modellatura.
Il sistema SAF è anche un approccio a strumento singolo, ma il design dello strumento e il principio di azione sono completamente diversi. Lo strumento è progettato per adattarsi alla morfologia del canale radicolare nella sezione trasversale. Di conseguenza, i risultati del SAF in termini di pulizia, modellatura e disinfezione di canali che sono curvi e/o irregolari nella sezione trasversale si sono dimostrati superiori a quelli degli strumenti convenzionali. Tuttavia, i risultati dello studio presente nei canali mesiali dei molari non hanno mostrato risultati superiori per il SAF né nella capacità di modellatura né nell'efficacia antibatterica. Va notato che il SAF è stato utilizzato per 3 minuti nel canale. Sebbene uno studio precedente abbia riportato che il sistema SAF ha promosso una significativa riduzione delle popolazioni batteriche nei canali a forma ovale degli incisivi e dei premolari anche dopo solo 2 minuti di funzionamento, i risultati più impressionanti sono stati ottenuti dopo 6 minuti. Se gli effetti del SAF nei canali mesiali migliorerebbero dopo un tempo di funzionamento più lungo rimane da indagare.
La radice mesiale dei molari mandibolari presenta un alto grado di complessità, rendendo difficile ottenere risultati ottimali in termini di capacità antibatterica e di modellamento. Molte aree del canale radicolare principale sono rimaste non preparate indipendentemente dalla tecnica di strumentazione utilizzata, variando in media dal 20% al 35% (area dell'istmo esclusa). Si può ragionevolmente supporre che preparazioni apicali più ampie potrebbero aver portato a un aumento dell'area di superficie preparata e a una migliore disinfezione, e questo merita ulteriori indagini utilizzando questo approccio correlativo. Quando presenti, gli istmi non sono stati meccanicamente influenzati dalla strumentazione e probabilmente nemmeno dagli irriganti. Questi ultimi non potevano essere valutati mediante analisi mCT, e le limitazioni delle procedure di campionamento utilizzando punti di carta impediscono all'analisi batteriologica di valutare la permanenza dei batteri negli istmi.
Nonostante i diversi design e coni degli strumenti, sono stati fatti sforzi per standardizzare le dimensioni delle preparazioni il più possibile. Le dimensioni dei file utilizzati per la preparazione apicale finale erano le seguenti: TF dimensione 25 con cono 0.06 mm/mm lungo l'albero elicoidale dello strumento, Reciproc R25 con un cono di 0.08 lungo gli ultimi 3 mm dalla punta, e il SAF utilizzato per 3 minuti dopo il percorso di scorrimento preparato con un file rotativo convenzionale dimensione 25/0.04. Questi approcci hanno portato a preparazioni senza differenze significative nel volume finale e nell'area di superficie preparata come mostrato dall'analisi mCT. Poiché il volume totale degli irriganti era lo stesso, questa mancanza di una differenza significativa si è riflessa anche nell'efficacia antibatterica dei 3 approcci di strumentazione, che non differivano nemmeno con un ulteriore aumento della dimensione del campione.
Si prevedeva che i canali che mostrano risultati positivi per i batteri dopo l'istrumentazione presentassero una superficie non preparata più ampia. Tuttavia, anche se tutti i campioni che mostrano la presenza di batteri in S2 avevano aree non preparate, c'erano anche campioni con ampie aree non preparate che mostrano colture negative. L'analisi correlativa non è riuscita a mostrare relazioni statisticamente significative tra l'eliminazione dei batteri e l'aumento percentuale medio dei parametri analizzati nell'imaging mCT. È ragionevole supporre che in alcuni campioni le aree del canale principale non toccate dagli strumenti potrebbero non essere state colonizzate dai batteri perché la colonizzazione non è solitamente uniforme lungo le pareti del canale. Un'altra possibilità è che le aree non preparate siano state disinfettate con successo dal NaOCl, che ha forti attività antibatteriche e antibiofilm.
Sebbene questo studio sia innovativo nel senso che combina dati da 2 approcci consentendo un'analisi correlativa, non è privo di limitazioni. La mancanza di correlazione tra le 2 analisi potrebbe essere correlata ai fattori discussi in precedenza o potrebbe essere stata il risultato delle limitazioni delle procedure di campionamento utilizzando punti di carta, che potrebbero non riuscire a ottenere un buon campione rappresentativo dal sistema del canale radicolare, specialmente da irregolarità, recessi e aree lontane dal canale principale. Studi futuri che utilizzano analisi istobatteriologiche o criopulverizzazione dei campioni radicolari dovrebbero aggirare queste limitazioni. Tuttavia, questi approcci hanno anche le proprie limitazioni perché entrambi sono distruttivi e non consentono di valutare i campioni prima e dopo l'istrumentazione. Inoltre, l'analisi istobatteriologica fornisce informazioni bidimensionali (2D) delle aree selezionate e non fornisce informazioni sulla vitalità, mentre la criopulverizzazione non indica la posizione dei batteri persistenti. Studi futuri dovrebbero considerare di aggiungere uno di questi approcci a quelli utilizzati nello studio presente per un'analisi più completa. Ulteriori ricerche utilizzando questo approccio correlativo potrebbero indagare il potenziale impatto delle variabili dell'irrigante (ad es., modelli di flusso, concentrazione, tempo di esposizione e temperatura) così come diverse configurazioni anatomiche e sistemi di preparazione sull'esito.
In conclusione, questo studio ha mostrato che le 3 tecniche di strumentazione hanno prestazioni disinfettanti e di modellamento simili nella preparazione dei canali mesiali dei molari mandibolari. Ulteriori perfezionamenti nell'analisi correlativa utilizzata in questo studio hanno il potenziale di contribuire a un metodo che può valutare in modo completo le prestazioni degli strumenti e delle tecniche di strumentazione.
Autori: José F. Siqueira, Jr, Flávio R.F. Alves, Marco A. Versiani, Isabela N. Rôças, Bernardo M. Almeida, Mônica A.S. Neves, Manoel D. Sousa-Neto
Riferimenti:
- Siqueira JF Jr, Lopes HP. Preparazione chemomeccanica. In: Siqueira JF Jr, ed. Trattamento delle infezioni endodontiche. Londra: Quintessence Publishing; 2011:236–84.
- Sjögren U, Figdor D, Persson S, et al. Influenza dell'infezione al momento del riempimento della radice sull'esito del trattamento endodontico di denti con parodontite apicale. Int Endod J 1997;30:297–306.
- Siqueira JF Jr, Rôças IN. Implicazioni cliniche e microbiologia della persistenza batterica dopo le procedure di trattamento. J Endod 2008;34:1291–13013.
- Barbizam JV, Fariniuk LF, Marchesan MA, et al. Efficacia delle tecniche di strumentazione manuale e rotativa per la pulizia dei canali radicolari appiattiti. J Endod 2002;28: 365–6.
- Usman N, Baumgartner JC, Marshall JG. Influenza della dimensione dello strumento sulla detersione del canale radicolare. J Endod 2004;30:110–2.
- Siqueira JF Jr, Araujo MC, Garcia PF, et al. Valutazione istologica dell'efficacia di cinque tecniche di strumentazione per la pulizia del terzo apicale dei canali radicolari. J Endod 1997;23:499–502.
- Peters OA, Schönenberger K, Laib A. Effetti di quattro tecniche di preparazione Ni-Ti sulla geometria del canale radicolare valutati mediante microtomografia computerizzata. Int Endod J 2001;34: 221–30.
- Vera J, Siqueira JF Jr, Ricucci D, et al. Trattamento endodontico di denti con parodontite apicale in una o due visite: uno studio istobatteriologico. J Endod 2012;38: 1040–52.
- Nair PN, Henry S, Cano V, et al. Stato microbico del sistema del canale radicolare apicale dei primi molari mandibolari umani con parodontite apicale primaria dopo il trattamento endodontico "in un'unica visita". Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 99:231–52.
- Metzger Z, Teperovich E, Zary R, et al. Il file auto-regolante (SAF). Parte 1: rispetto dell'anatomia del canale radicolare—un nuovo concetto di file endodontiche e la sua implementazione. J Endod 2010;36:679–90.
- Metzger Z, Teperovich E, Cohen R, et al. Il file auto-regolante (SAF). Parte 3: rimozione dei detriti e strato di fango—uno studio con microscopio elettronico a scansione. J Endod 2010;36:697–702.
- De-Deus G, Souza EM, Barino B, et al. Il file auto-regolante ottimizza la qualità della detersione nei canali radicolari a forma ovale. J Endod 2011;37:701–5.
- Ribeiro MVM, Silva-Sousa YT, Versiani MA, et al. Confronto dell'efficacia di pulizia del file auto-regolante e dei sistemi rotativi nel terzo apicale di canali a forma ovale. J Endod 2013;39:398–401.
- Siqueira JF Jr, Alves FR, Almeida BM, et al. Capacità di preparazione chemomeccanica con strumenti rotativi o file auto-regolanti di disinfettare canali radicolari a forma ovale. J Endod 2010;36:1860–5.
- Versiani MA, Pecora JD, de Sousa-Neto MD. Preparazione del canale radicolare flat-ovale con strumento file auto-regolante: uno studio di microtomografia computerizzata. J Endod 2011;37:1002–7.
- Paque F, Peters OA. Preparazione del canale radicolare dei molari mascellari con il file auto-regolante: uno studio di microtomografia computerizzata. J Endod 2011;37:53–7.
- Markvart M, Darvann TA, Larsen P, et al. Analisi micro-CT dell'ingrandimento apicale e della complessità del canale radicolare molare. Int Endod J 2012;45:273–81.
- Solomonov M, Paque F, Fan B, et al. La sfida dei sistemi di canali a forma di C: uno studio comparativo del file auto-regolante e del ProTaper. J Endod 2012;38: 209–14.
- Paque F, Balmer M, Attin T, et al. Preparazione di canali radicolari a forma ovale nei molari mandibolari utilizzando strumenti rotativi in nichel-titanio: uno studio di microtomografia computerizzata. J Endod 2010;36:703–7.
- Paque F, Ganahl D, Peters OA. Effetti della preparazione del canale radicolare sulla geometria apicale valutati mediante microtomografia computerizzata. J Endod 2009;35:1056–9.
- Alves FR, Almeida BM, Neves MA, et al. Effetti antibatterici dipendenti dal tempo del file auto-regolante utilizzato con due concentrazioni di ipoclorito di sodio. J Endod 2011; 37:1451–5.
- Siqueira JF Jr, Rôças IN. Analisi basata sulla reazione a catena della polimerasi dei microrganismi associati al fallimento del trattamento endodontico. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2004;97:85–94.
- Tassani S, Matsopoulos GK, Baruffaldi F. Identificazione 3D della zona di frattura dell'osso trabecolare utilizzando uno schema di registrazione automatica delle immagini: uno studio di validazione. J Biomech 2012;45:2035–40.
- Paiva SS, Siqueira JF Jr, Rôças IN, et al. Integrazione degli effetti antimicrobici della detersione chemomeccanica con irrigazione ultrasonica passiva o un risciacquo finale con clorexidina: uno studio clinico. J Endod 2012;38:1202–6.
- Ricucci D, Loghin S, Siqueira JF Jr. Infezione da biofilm exuberante in un canale laterale come causa di fallimento del trattamento endodontico a breve termine: rapporto di un caso. J Endod 2013;39:712–8.
- Ruckman JE, Whitten B, Sedgley CM, et al. Confronto del file auto-regolante con strumentazione rotativa e manuale in canali radicolari a forma lunga e ovale. J Endod 2013;39: 92–5.
- Siqueira JF Jr, Lima KC, Magalhaes FA, et al. Riduzione meccanica della popolazione batterica nel canale radicolare mediante tre tecniche di strumentazione. J Endod 1999;25: 332–5.
- Siqueira JF Jr, Rôças IN, Lopes HP. Modelli di colonizzazione microbica nelle infezioni primarie del canale radicolare. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002; 93:174–8.
- Ordinola-Zapata R, Bramante CM, Cavenago B, et al. Effetto antimicrobico delle soluzioni endodontiche utilizzate come irriganti finali su un modello di biofilm dentinale. Int Endod J 2012;45:162–8.
- Alves FR, Siqueira JF Jr, Carmo FL, et al. Profilazione della comunità batterica di campioni macinati criogenicamente dai segmenti radicolari apicali e coronali di denti con parodontite apicale. J Endod 2009;35:486–92.
