Passaggi Aggiuntivi per la Disinfezione del Sistema Canalare Radicolare del Molare Mandibolare: Un Approccio Correlativo Bacteriologico, Micro-Tomografia Computata e Criopulverizzazione
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo).
Abstract
Introduzione: Questo studio ha valutato la capacità disinfettante della preparazione chemomeccanica con strumenti rotanti in nichel-titanio, seguita da 2 procedure aggiuntive distinte nei canali radicolari dei molari mandibolari estratti mediante un approccio analitico correlative.
Metodi: Ventidue molari mandibolari estratti sono stati selezionati e abbinati anatomici tra i gruppi sulla base di un'analisi micro–tomografica computazionale. Nella prima fase dell'esperimento, i canali radicolari sono stati contaminati con Enterococcus faecalis e sottoposti a preparazione chemomeccanica con strumenti BT RaCe e irrigazione con NaOCl al 2,5%. Successivamente, è stato utilizzato o lo strumento XP-Endo Finisher o l'irrigazione ultrasonica passiva per integrare la disinfezione. La micro–tomografia computazionale è stata utilizzata per mostrare se la percentuale di aree non preparate fosse correlata ai conteggi batterici. Nella seconda fase, gli stessi denti sono stati contaminati nuovamente e sono state utilizzate le procedure aggiuntive. Campioni dall'area dell'istmo delle radici mesiali e dal frammento apicale di 5 mm delle radici distali sono stati ottenuti mediante criopulverizzazione. I campioni prelevati prima e dopo i passaggi di trattamento in entrambe le fasi sono stati valutati mediante reazione a catena della polimerasi quantitativa e analizzati statisticamente.
Risultati: Nella fase 1, la preparazione in entrambi i gruppi ha portato a una sostanziale diminuzione dei conteggi batterici (P < .001). Gli approcci aggiuntivi hanno portato a una ulteriore piccola riduzione batterica, che è risultata significativa per XP-Endo Finisher (P < .05). Non sono state osservate differenze significative tra i gruppi per i conteggi batterici persistenti. L'analisi correlativa non ha rivelato alcuna relazione statisticamente significativa tra la riduzione batterica e la percentuale di aree non preparate (P > .05). Nella fase 2, entrambi i metodi hanno avuto effetti antibatterici significativi nel canale principale, ma nessuno di essi è riuscito a disinfettare in modo prevedibile le aree dell'istmo/recessi.
Conclusioni: Sia XP-Endo Finisher che l'irrigazione ultrasonica passiva hanno mostrato efficacia antibatterica, ma solo il primo ha causato una significativa riduzione dei conteggi batterici dopo la preparazione chemomeccanica. Nessuno di essi è stato efficace nel disinfettare in modo prevedibile le aree dell'istmo/recessi. (J Endod 2016;42:1667–1672).
Indipendentemente dalle tecniche di strumentazione, dagli strumenti e dagli irriganti, una pulizia, disinfezione e modellamento approfonditi del canale radicolare non sono stati comunemente raggiunti, specialmente nei denti con canali curvi o anatomie insolite. Studi che hanno utilizzato la tecnologia di imaging tomografico micro–computato ad alta risoluzione (micro-CT) hanno dimostrato che l'11%–48% delle aree principali del canale radicolare rimangono intatte dopo la strumentazione. Queste aree possono essere colonizzate da biofilm che hanno il potenziale di rimanere inalterati e mettere a rischio l'esito del trattamento. Inoltre, alcune complessità anatomiche del sistema del canale radicolare, come ramificazioni, recessi e istmi, non vengono comunemente raggiunte da strumenti e irriganti. I batteri situati in queste aree possono persistere e portare a una periodontite apicale persistente. In effetti, studi batteriologici clinici hanno dimostrato che i batteri sono ancora rilevati in circa il 30%–60% dei canali dopo la preparazione chemomeccanica. I batteri che persistono nel canale sono il fattore di rischio più importante per la periodontite apicale post-trattamento. Sono stati fatti sforzi per sviluppare approcci ausiliari per migliorare la disinfezione del canale radicolare. Questo comporta approcci che guidano gli irriganti verso aree difficili da raggiungere o consentono allo strumento di raggiungere e debride meccanicamente le regioni non interessate. Uno di questi approcci ausiliari è l'irrigazione ultrasonica passiva (PUI), che comprende l'attivazione ultrasonica di un irrigante. I dati da studi in vitro e in vivo che valutano i benefici in termini di effetti antibatterici dell'approccio ausiliario PUI con NaOCl sono stati inconcludenti.
Lo strumento XP-Endo Finisher (FKG Dentaire, La Chaux-de-Fonds, Svizzera) è stato recentemente introdotto con la promessa di migliorare la pulizia e la disinfezione dei canali radicolari. Si tratta di uno strumento di dimensione 25 non conico, realizzato in lega di nichel-titanio (NiTi) MaxWire (Martensite-Austenite Electropolish FleX). A temperatura ambiente, lo strumento è dritto nella sua fase martensitica, ma a temperatura corporea cambia nella fase austenitica e sviluppa una forma a cucchiaio; quando ruotato e mosso su e giù nel canale, questa forma consente allo strumento di espandersi e contrarsi per toccare le pareti del canale e agitare la soluzione irrigante. Uno studio recente ha dimostrato che XP-Endo Finisher e PUI sono riusciti a ridurre significativamente i livelli di detriti di tessuto duro nel sistema del canale radicolare mesiale rispetto all'irrigazione convenzionale e a un protocollo modificato del sistema Self-Adjusting File. Finora, solo 1 studio ha indagato i benefici antibatterici dell'uso di XP-Endo Finisher e ha riportato risultati migliori rispetto all'irrigazione convenzionale. Nessuno studio ha valutato gli effetti antibatterici di questo strumento dopo le procedure chemomeccaniche.
Lo studio attuale intendeva valutare la capacità disinfettante e di modellamento della preparazione chemomeccanica con strumenti rotanti in NiTi, seguita da 2 approcci ausiliari distinti nei canali radicolari dei molari mandibolari estratti mediante un'analisi batteriologica e micro-CT correlativa. È stato utilizzato un approccio di criopulverizzazione per valutare le condizioni batteriologiche dell'istmo e delle aree recessuali dopo l'uso di uno strumento XP-Endo Finisher o di procedure ausiliarie PUI.
Materiali e Metodi
Selezione e Preparazione dei Denti
Il protocollo dello studio è stato approvato dal Comitato Etico dell'Università Estácio de Sá, Rio de Janeiro, RJ, Brasile. Ventidue molari mandibolari estratti con 2 canali indipendenti uniti apicalmente da un istmo nella radice mesiale (tipo II di Vertucci) e un singolo canale distale (tipo I di Vertucci) sono stati selezionati da una collezione di 185 molari mandibolari sulla base di radiografie effettuate in entrambe le direzioni buccolinguale e mesiodistale, esplorazione con piccoli strumenti dopo la preparazione dell'accesso e imaging micro-CT utilizzando uno scanner SkyScan 1174v2 (Bruker-microCT, Kontich, Belgio) operante a 50 Kv, 800 mA, risoluzione isotropica di 19.86 mm e rotazione di 180◦ attorno all'asse verticale con un passo di rotazione di 1.0 utilizzando un filtro in alluminio spesso 0.5 mm.
Le immagini di ciascun campione sono state ricostruite con una correzione dell'artefatto ad anello di 5, una correzione dell'irraggiamento di 15% e una levigatura di 5 (NRecon v.1.6.9.16; Bruker-microCT). Il software CTAn v.1.14.4 (Bruker-microCT) è stato utilizzato per la valutazione tridimensionale (3D) del canale radicolare riguardo al volume e all'area superficiale, e il software CTVol v.2.2.1 (Bruker-microCT) è stato utilizzato per la visualizzazione e la valutazione qualitativa della configurazione del sistema del canale radicolare. I campioni sono stati abbinati in coppie sulla base degli aspetti morfologici e anatomici dei sistemi del canale radicolare mesiale e distale, valutati tramite micro-CT, e 1 campione di ciascuna coppia è stato assegnato casualmente a 1 dei 2 gruppi sperimentali.
I canali radicolari sono stati esplorati con file K manuali #15 fino a quando la punta dello strumento ha raggiunto il forame apicale, come visualizzato da un stereomicroscopio. Questa misura è stata registrata come lunghezza di patenza, e i canali sono stati inizialmente allargati fino a questo punto utilizzando lo strumento BioRaCe BR2 (25/04) (FKG Dentaire) operato nel motore VDW Gold (VDW, Monaco di Baviera, Germania) a 300 rpm, 1.5 N • cm, per standardizzare il diametro iniziale del canale e creare spazio per la contaminazione batterica. Lo strato di detrito è stato rimosso utilizzando irrigazione con EDTA al 17% e NaOCl al 2.5%. Il NaOCl è stato inattivato con tiosolfato di sodio al 5%. I denti sono stati scansionati nuovamente in micro-CT utilizzando i parametri precedentemente menzionati, e i set di dati ottenuti sono stati utilizzati come base per il confronto con le immagini post-preparazione.
Fase 1
Per la contaminazione, i canali radicolari sono stati riempiti con brodo di soia trypticase (Difco, Detroit, MI) utilizzando aghi Navitip (Ultradent Products Inc, South Jordan, UT) fino a quando il brodo non è fuoriuscito attraverso il forame apicale. I denti sono stati posti in un pallone contenente 50 mL di brodo di soia trypticase e sottoposti a ultrasuoni per 1 minuto per liberare l'aria intrappolata e consentire la penetrazione del mezzo di coltura nelle irregolarità del canale radicolare. Successivamente, i denti sono stati sterilizzati in un autoclave. È stata utilizzata una coltura fresca di Enterococcus faecalis ATCC 29212 coltivata per 24 ore a 37◦C come inoculo per la contaminazione del canale radicolare. I denti sono stati incubati per 30 giorni a 37◦C sotto agitazione delicata, e il mezzo di coltura è stato rifornito ogni settimana. Successivamente, tutti i denti contaminati hanno avuto il mezzo di coltura in eccesso gocciolato via, e le loro superfici radicolari esterne sono state pulite con garza sterile. Due denti sono stati fissati in formalina tamponata al 10% e processati per microscopia elettronica a scansione (SEM) per confermare la colonizzazione batterica come descritto altrove.
Le foraminazioni apicali di ciascun dente sono state sigillate con Topdam (FGM, Joinville, SC, Brasile) per prevenire la perdita batterica apicale e creare un sistema a fondo chiuso. Prima della preparazione del canale radicolare, le superfici esterne delle radici sono state pulite con perossido di idrogeno al 3% e disinfettate con NaOCl al 2,5%, seguite dall'inattivazione di quest'ultimo con tiosolfato di sodio al 5%. I denti sono stati montati verticalmente fino alla regione cervicale in blocchi realizzati con materiale per impronte in silicone (President Jet; Coltène AG, Cuyahoga Falls, OH). La corona del dente, comprese le pareti della camera pulpare, e la superficie in silicone sono state disinfettate con NaOCl al 2,5%, seguite dall'inattivazione di questa sostanza con tiosolfato di sodio al 5%. I campioni sono stati prelevati dal canale radicolare utilizzando punti di carta prima (P1S1) e dopo la preparazione chemomeccanica (P1S2) e dopo l'approccio aggiuntivo (P1S3) (Fig. 1A). Il canale radicolare è stato risciacquato con 1 mL di soluzione salina sterile al 0,85% per rimuovere le cellule non attaccate, e sono stati utilizzati sequenzialmente 3–5 punti di carta sterili alla lunghezza di lavoro (WL), stabilita a 0,5 mm dalla lunghezza di patenza. Ogni punto di carta è rimasto nel canale per 1 minuto. I punti di carta sono stati trasferiti in tubi contenenti 1 mL di tampone Tris-EDTA (10 mmol/L Tris-HCl, 1 mmol/L EDTA, pH 7.6) e congelati a –20◦C. Nella radice mesiale, i campioni sono stati prelevati da ciascun canale, ma sono stati raggruppati per ulteriori analisi batteriologiche poiché i 2 canali si univano in 1 nella porzione apicale. I canali sono stati preparati alla WL utilizzando il sistema BT RaCe (FKG Dentaire), operato nel motore VDW Gold a 600 rpm, 1,5 N • cm, fino allo strumento BT3. L'irrigazione è stata effettuata utilizzando NaOCl al 2,5% somministrato tramite aghi Navitip portati fino a 2 mm prima della WL (Fig. 1A). Durante l'istrumentazione dei canali mesiali, l'orifizio del canale distale è stato sigillato con Topdam (e viceversa) per evitare la perdita di irriganti al suo interno. Dopo la preparazione apicale, il canale è stato irrigato con NaOCl, EDTA (per la rimozione della pellicola di smear), e poi di nuovo con NaOCl (Fig. 1A). Dopo l'inattivazione di NaOCl con tiosolfato di sodio al 5%, il campione P1S2 è stato prelevato come descritto sopra, e i denti di ciascun gruppo sono stati sottoposti a procedure aggiuntive PUI o XP-Endo Finisher come segue.
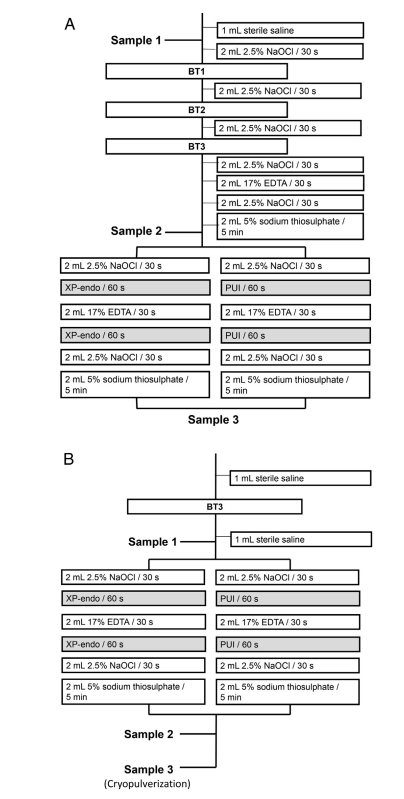
PUI.
I canali radicolari sono stati irrigati con 2 mL di NaOCl al 2,5%, attivato ultrasonicamente nel canale per 1 minuto utilizzando il dispositivo EndoUltra (Vista Dental Products, Racine, WI), con la punta della sonda posizionata 1 mm prima del WL. I canali sono stati irrigati con 2 mL di EDTA, attivato ultrasonicamente nello stesso modo di sopra, seguito da un risciacquo finale con NaOCl al 2,5%. Infine, il NaOCl è stato inattivato con 2 mL di tiosolfato di sodio al 5% e è stato prelevato un campione P1S3.
Strumento XP-Endo Finisher.
XP-Endo Finisher è stato utilizzato fino al WL per 1 minuto dopo l'irrigazione con 2 mL di NaOCl al 2,5%. Lo strumento è stato accoppiato al motore VDW Gold a 800 rpm, 1 N • cm, con movimenti lenti su e giù di 7-8 mm di lunghezza. I canali radicolari sono stati poi irrigati con EDTA al 17%, e XP-Endo è stato utilizzato nuovamente. Dopo le irrigazioni finali con NaOCl al 2,5% e tiosolfato di sodio, è stato prelevato un campione P1S3.
Lo stesso volume finale di irriganti è stato utilizzato per gruppo, con 14 mL di NaOCl per canale. In entrambi i gruppi, gli irriganti sono stati preriscaldati a 37◦C per le procedure intracanalari, che sono state eseguite a 37◦C all'interno di un armadio contenente un riscaldatore (800-Heater; PlasLabs, Lansing, MI).
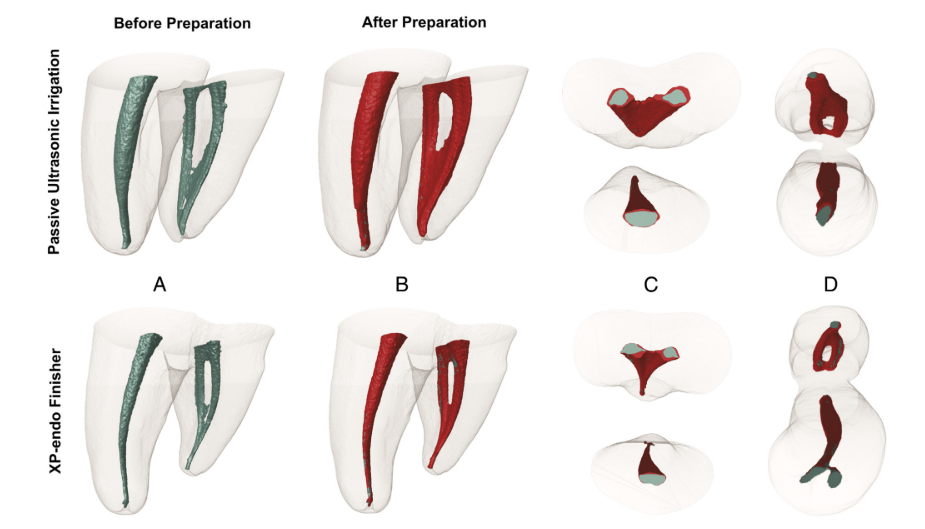
I campioni sono stati sottoposti a sterilizzazione in autoclave e a una nuova scansione micro-CT utilizzando le impostazioni di parametro sopra menzionate. I modelli 3D colorati preoperatori e postoperatori dei canali mesiali sono stati resi (CTVol v.2.2.1; Bruker-microCT) e co-registrati con i rispettivi set di dati preoperatori (il verde e il rosso indicano le superfici dei canali preoperatori e postoperatori, rispettivamente) utilizzando il modulo di registrazione rigida del software 3D Slicer 4.3.1 (disponibile su http://www.slicer.org), con un'accuratezza superiore a 1 voxel. Successivamente, le immagini abbinate sono state esaminate per calcolare il volume (mm3) e l'area superficiale (mm2) del sistema del canale radicolare mesiale prima e dopo la preparazione utilizzando il software CTAn v.1.14.4 (Bruker micro-CT). L'area della superficie del canale non toccata è stata determinata calcolando il numero di voxel statici ed espressa come percentuale del numero totale di voxel presenti sulla superficie del canale.
Fase 2
Gli stessi campioni dentali della fase 1 sono stati utilizzati nella seconda fase dell'esperimento. Diciotto denti erano ancora disponibili. Questa seconda fase è stata eseguita per aumentare il numero di denti con canali positivi per batteri prima dell'applicazione degli approcci aggiuntivi, consentendo un confronto statistico più robusto. Inoltre, è stato possibile testare entrambi gli approcci contro carichi batterici iniziali più controllati. Infine, la valutazione degli effetti dell'approccio aggiuntivo isolato sulle aree dell'istmo è stata inclusa in questo secondo esperimento.
I denti sono stati sterilizzati in autoclave, contaminati e montati come descritto nella fase 1. Successivamente, i canali radicolari sono stati risciacquati con 1 mL di soluzione salina e strumentati nuovamente con uno strumento BT3 per ridurre leggermente il carico batterico iniziale. P2S1 è stato prelevato come nella fase 1. Ogni canale è stato irrigato con 2 mL di NaOCl al 2,5% e sono stati utilizzati o lo strumento XP-Endo Finisher o PUI come descritto in precedenza (Fig. 1B). Dopo l'irrigazione con EDTA, gli approcci aggiuntivi sono stati eseguiti nuovamente, e poi il canale è stato irrigato con NaOCl e tiosolfato di sodio. Il campione P2S2 è stato raccolto.
Sulla base delle immagini micro-CT della sezione trasversale del canale radicolare, è stata stabilita la posizione dell'istmo nella radice mesiale, e i campioni sono stati tagliati utilizzando dischi diamantati sterili a doppia faccia per generare frammenti di radice contenenti istmo per l'analisi. Le radici distali avevano un singolo canale appiattito contenente recessi e sono state sezionate a 5 mm dall'apice. I frammenti di radice corrispondenti all'area dell'istmo della radice mesiale e alla parte apicale della radice distale hanno avuto le superfici esterne pulite con perossido di idrogeno al 3% e disinfettate con NaOCl al 2,5%, che è stato ulteriormente inattivato con tiosolfato di sodio. In sequenza, le superfici esterne delle radici sono state campionate utilizzando un punto di carta sterile #80 inumidito con tampone Tris-EDTA. Questo campione ha servito come controllo di sterilità ed è stato valutato mediante un saggio di reazione a catena della polimerasi quantitativa in tempo reale (qPCR). Queste procedure di disinfezione e campionamento di controllo sono state condotte sotto un microscopio operatorio. Un mulino a freddo 6750 (Spex, Metuchen, NJ) operante a temperatura di azoto liquido è stato utilizzato per macinare criogenicamente ciascun frammento di radice come descritto altrove. Dopo la macinazione, i campioni di polvere radicolare apicale (P2S3) sono stati sospesi in tampone Tris-EDTA e conservati a –20◦C.
Estrazione del DNA e Assay qPCR
Il DNA è stato estratto dai campioni di entrambe le fasi sperimentali e utilizzato come template per la quantificazione delle cellule di E. faecalis utilizzando un assay qPCR mirato al gene 16S rRNA. I passaggi di estrazione del DNA e qPCR, i controlli e le condizioni sono stati descritti in precedenza. Tutte le misurazioni sono state effettuate in triplicato.
Analisi Statistica
Il test dei ranghi congiunti di Wilcoxon è stato utilizzato per confrontare la riduzione intragruppo dei conteggi batterici da P1S1/P2S1 a P1S2/P2S2, da P1S1/P2S1 a P1S3/P2S3 e da P1S2/P2S2 a P1S3/P2S3. I campioni iniziali (P1S1/P2S1) sono stati confrontati tra i gruppi utilizzando il test non parametrico di Mann-Whitney U, che non ha rivelato differenze significative tra di essi (P> .05). Pertanto, lo stesso test è stato utilizzato per confrontare i conteggi nei campioni P1S2/P2S2 e P1S3/P2S3 tra i gruppi. Inizialmente, le analisi sono state effettuate separatamente per le radici mesiali e distali. Poiché non c'erano differenze significative tra i canali mesiali e distali, i dati sono stati raccolti anche per aumentare la robustezza dell'analisi statistica. L'analisi di correlazione di Pearson è stata utilizzata per verificare le relazioni tra la riduzione batterica e la percentuale di aree non preparate. Le analisi statistiche sono state effettuate con STATISTICA versione 8 (StatSoft, Tulsa, OK) con un livello di significatività fissato al 5%.
Risultati
L'analisi SEM ha rivelato che E. faecalis colonizzava le pareti del canale radicolare, formando generalmente strutture simili a biofilm (dati non mostrati). La colonizzazione del canale radicolare è stata ulteriormente confermata da risultati positivi di qPCR nei campioni P1S1/P2S1 di tutti i denti.
Fase 1
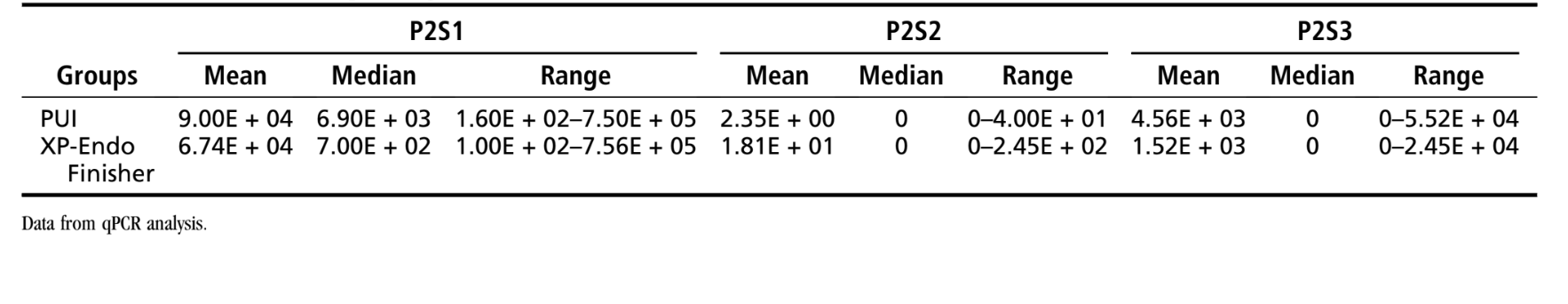
Tabella 1 mostra la media, la mediana e l'intervallo dei conteggi di E. faecalis osservati per i gruppi di test. Nel gruppo XP-Endo Finisher, i conteggi di E. faecalis sono stati sostanzialmente ridotti da P1S1 a P1S2 (P < .001). Dopo l'uso dello strumento XP-Endo (P1S3), c'è stata un'ulteriore riduzione significativa (P < .05). Tutti i 20 campioni erano positivi per E. faecalis in P1S1, 6 in P1S2 e 6 in P1S3. Nel gruppo PUI, i conteggi batterici iniziali (P1S1) sono stati anch'essi significativamente ridotti dopo la preparazione (P1S2) (P < .001). Sebbene i conteggi batterici siano stati ulteriormente ridotti in P1S3, non erano significativamente diversi da P1S2 (P > .05). Tutti i 20 campioni erano positivi in P1S1, 10 in P1S2 e 7 in P1S3. Non sono state osservate differenze significative confrontando P1S3 tra i gruppi XP-Endo e PUI (P > .05).

L'analisi statistica dei dati mesiali e distali separatamente ha mostrato l'assenza di significatività per tutti i confronti tra P1S2 e P1S3 (P > .05) tranne che per i canali mesiali nel gruppo XP-Endo Finisher (P < .05). I dati delle radici mesiali e distali separatamente sono mostrati nella Tabella Supplementare S1.
L'analisi Micro-CT non ha mostrato differenze significative nei volumi iniziali dei canali tra i gruppi (P > .05). Per quanto riguarda le aree non preparate, è stato osservato un valore percentuale medio di voxel statici del 4,5% (mediana, 4,3%) per il gruppo XP-Endo Finisher e 4,3% (mediana, 5,4%) per il gruppo PUI (P > .05) (Fig. 2). L'analisi correlativa non ha rivelato alcuna relazione statisticamente significativa tra la riduzione batterica e la percentuale di aree non preparate (P > .05).
Fase 2
Tabella 2 mostra i dati quantitativi della fase 2. Nel gruppo XP-Endo Finisher, i conteggi di E. faecalis in P2S1 sono stati significativamente ridotti dopo l'uso di questo strumento (P< .001). Tutti e 18 i campioni erano positivi per batteri in P2S1, 2 in P2S2 e 4 in P2S3 (campioni polverizzati). La procedura PUI è stata anche altamente efficace nel ridurre i conteggi batterici nel canale principale (P< .001). Tutti e 18 i campioni erano positivi per batteri in P2S1, 1 in P2S2 e 6 in P2S3 (campioni polverizzati). Non sono state osservate differenze significative confrontando gli effetti di XP-Endo e PUI in P2S2 (canali principali) o P2S3 (istmi/recessi) (P> .05). L'analisi statistica dei dati mesiali e distali separatamente non ha mostrato differenze significative tra i gruppi (P> .05) (Tabella Supplementare S2).
Discussione
Questo studio ha correlato diversi strumenti analitici per valutare, in 2 fasi sperimentali, gli effetti antibatterici degli approcci aggiuntivi nel sistema canalare radicolare del molare mandibolare. Nella prima fase, sono stati valutati gli effetti delle 2 procedure utilizzate immediatamente dopo la preparazione chemomeccanica con strumentazione rotativa in NiTi e irrigazione con NaOCl. Questa analisi è stata limitata agli effetti antibatterici nel canale radicolare principale come determinato dal campionamento con punti di carta. Poiché il 50% (gruppo PUI) e il 70% (gruppo XP-Endo Finisher) dei casi hanno mostrato risultati negativi per i batteri in P1S2, riducendo la dimensione del campione per l'analisi intergruppo di P1S3, è stata ideata una seconda fase per aumentare il numero di canali sottoposti a entrambi gli approcci e includere l'analisi dei loro effetti non solo nei canali principali ma anche nell'istmo e nelle aree recessuali mediante macinazione criogenica della radice per il prelievo di campioni.
Nella prima fase, l'istrumentazione chemomeccanica con BT RaCe e irrigazione con NaOCl ha promosso una sostanziale eliminazione batterica in entrambi i gruppi, il che è in accordo con studi precedenti. Mentre il passaggio procedurale aggiuntivo con PUI non è riuscito a ridurre significativamente ulteriormente i conteggi batterici, i conteggi intracanalari di E. faecalis dopo l'uso di XP-Endo Finisher erano significativamente inferiori a quelli ottenuti immediatamente dopo la preparazione. I risultati significativamente migliori per XP-Endo si sono verificati nelle radici mesiali. Nella seconda fase, i campioni iniziali consistevano in un carico batterico iniziale inferiore per consentire il confronto di entrambi gli approcci rispetto ai numeri batterici compatibili con ciò che ci si aspetta che gli interventi aggiuntivi affrontino nella situazione clinica. In questa fase, gli approcci PUI e XP-Endo Finisher sono stati simili e altamente efficaci nella riduzione dei conteggi batterici nel canale principale.
Per quanto riguarda le aree dell'istmo/recessi, la natura distruttiva dell'approccio di criopulverizzazione non ha permesso di effettuare un'analisi longitudinale. Pertanto, non è possibile dedurre se i risultati negativi siano stati causati dagli effetti degli approcci aggiuntivi o da una contaminazione batterica non riuscita in quelle aree. Tuttavia, non ci sono state differenze significative nei conteggi batterici tra i gruppi. I conteggi nell'area dell'istmo (P2S3) erano infatti superiori a quelli nel canale principale (P2S2), suggerendo che gli effetti di PUI e XP-Endo Finisher in quella regione non sono prevedibili. Questo, insieme ai risultati di diversi denti con campioni negativi nel canale e positivi nell'istmo, evidenzia la limitazione dell'approccio con punta di carta nel campionamento del sistema del canale radicolare.
I risultati complessivi per lo strumento XP-Endo Finisher sono stati incoraggianti perché ha generalmente mostrato prestazioni comparabili con PUI, un approccio aggiuntivo ampiamente raccomandato. In uno studio recente, lo strumento XP-Endo Finisher è stato più efficiente rispetto ad altre tecniche nella disinfezione dello spazio del canale principale. Il design e il movimento elicoidale dello strumento potrebbero avergli permesso di raggiungere aree precedentemente non toccate e di spostare i biofilm batterici. L'aumento delle aree toccate non è stato valutato tramite micro-CT a causa della minima, se non nulla, capacità di taglio dello strumento XP-Endo Finisher.
I nostri risultati con PUI sono in accordo con diversi studi che hanno riportato nessun miglioramento significativo nella disinfezione dopo la preparazione. Gli effetti antibatterici di PUI sono suggeriti essere correlati alla cavitazione, al flusso acustico e al riscaldamento dell'irrigante, ma se questi fenomeni si verificano realmente nel canale radicolare, non sembrano essere sufficienti per migliorare significativamente l'eliminazione batterica.
Non c'era correlazione tra la percentuale di aree non preparate e i livelli batterici in P1S3, il che è in consonanza con uno studio precedente. Esiste la possibilità che in alcuni campioni le aree non toccate del canale principale non siano state colonizzate da batteri. Inoltre, è possibile che le aree non strumentate siano state effettivamente disinfettate dall'irrigazione con NaOCl. Le limitazioni della procedura di campionamento puntuale del documento potrebbero anche aver contribuito a questa mancanza di correlazione.
Il presente disegno sperimentale ha alcuni aspetti degni di nota. Sono state utilizzate scansioni Micro-CT per selezionare e abbinare i denti in base a somiglianze anatomiche prima della distribuzione tra i gruppi, minimizzando le variabili inerenti all'anatomia. Inoltre, sono stati utilizzati irriganti riscaldati durante tutti gli esperimenti. Questo doveva essere fatto perché lo strumento XP-Endo Finisher subisce una trasformazione di fase a temperatura corporea. Abbiamo quindi deciso di includere soluzioni riscaldate in tutte le fasi dell'esperimento, che è stato anche eseguito all'interno di un armadio con temperatura mantenuta a 37◦C. La maggior parte degli studi precedenti su denti estratti è stata condotta a temperatura ambiente. Poiché la temperatura può influenzare l'attività antibatterica di NaOCl, è consigliabile eseguire test antibatterici a una temperatura simile a quella corporea. Un altro vantaggio di questo studio è stato l'uso della qPCR per la quantificazione batterica. Questo approccio è molto sensibile e potrebbe essere utilizzato in modo affidabile in campioni criopulverizzati (studi pilota che utilizzavano colture hanno mostrato una perdita di conteggio batterico a causa dell'approccio di macinazione). L'uso della criopulverizzazione, a sua volta, è stato essenziale per consentire l'analisi degli effetti antibatterici degli approcci testati in aree come istmi e recessi, che potrebbero non essere campionati correttamente da punti di carta.
Sebbene questo studio sia innovativo nel combinare diversi approcci analitici, presenta anche delle limitazioni. Il prelievo di campioni con punti di carta è solitamente limitato al canale principale, e alcune aree come irregolarità, isthmi e recessi potrebbero non essere campionate. La limitazione della tecnica del punto di carta è stata evidente nella fase 2, quando più canali sono risultati positivi per i batteri in P2S3 rispetto a P2S2; sono stati mostrati anche conteggi medi più elevati per P2S3. Inoltre, poiché il campionamento con punti di carta non distingue il segmento del canale principale, rimane sconosciuto in quale parte siano rimasti i batteri. La criopulverizzazione può aggirare queste limitazioni, ma è un metodo distruttivo e può essere utilizzato solo per analisi trasversali. Un'altra limitazione può riferirsi all'uso della qPCR per la rilevazione batterica. C'è preoccupazione che il DNA delle cellule recentemente morte a causa del trattamento antibatterico possa essere rilevato anche con questo metodo. Tuttavia, uno studio precedente che ha utilizzato un protocollo simile in vitro non ha mostrato differenze significative per i conteggi batterici tra coltura e qPCR nei campioni post-trattamento. Questo, insieme all'alta occorrenza di risultati negativi della qPCR nei campioni post-trattamento, suggerisce fortemente che il DNA delle cellule morte potrebbe non essere stato un problema significativo nello studio attuale. Il DNA libero può essere degradato da NaOCl o potrebbe essere stato lavato via durante l'irrigazione.
In conclusione, questo studio ha dimostrato che entrambi gli approcci aggiuntivi hanno causato una piccola riduzione nel conteggio batterico dopo la preparazione chemomeccanica, che è stata significativa solo per XP-Endo Finisher. Né XP-Endo né PUI sono stati efficaci nel disinfettare in modo prevedibile le aree dell'istmo/recessi dei molari mandibolari.
Autori: Flavio R.F. Alves, Carlos V. Andrade-Junior, Marılia F. Marceliano-Alves, Alejandro R. Perez, Isabela N. Rôças, Marco A. Versiani, Manoel D. Sousa-Neto, Jose C. Provenzano, Jose F. Siqueira
Riferimenti:
- Siqueira JF Jr, Araujo MC, Garcia PF, et al. Valutazione istologica dell'efficacia di cinque tecniche di strumentazione per la pulizia del terzo apicale dei canali radicolari. J Endod 1997;23:499–502.
- Peters OA, Schönenberger K, Laib A. Effetti di quattro tecniche di preparazione Ni-Ti sulla geometria del canale radicolare valutati tramite microtomografia computerizzata. Int Endod J 2001;34: 221–30.
- Vera J, Siqueira JF Jr, Ricucci D, et al. Trattamento endodontico in un'unica visita rispetto a due visite di denti con parodontite apicale: uno studio istobatteriologico. J Endod 2012;38: 1040–52.
- Paqué F, Zehnder M, De-Deus G. Confronto basato su microtomografia della tecnica a file singola F2 ProTaper a movimento reciproco rispetto alla sequenza rotativa completa. J Endod 2011; 37:1394–7.
- Markvart M, Darvann TA, Larsen P, et al. Analisi Micro-CT dell'ingrandimento apicale e della complessità del canale radicolare dei molari. Int Endod J 2012;45:273–81.
- Siqueira JF Jr, Alves FR, Versiani MA, et al. Analisi batteriologica e micro-tomografica correlativa dei canali mesiali dei molari mandibolari preparati con file auto-regolabili, sistemi Reciproc e Twisted File. J Endod 2013;39:1044–50.
- Peters OA, Arias A, Paque F. Valutazione micro-tomografica della preparazione del canale radicolare con un nuovo strumento, TRUShape, nelle radici mesiali dei molari mandibolari. J Endod 2015;41:1545–50.
- Ricucci D, Siqueira JF Jr. Biofilm e parodontite apicale: studio della prevalenza e associazione con risultati clinici e istopatologici. J Endod 2010;36:1277–88.
- Ricucci D, Siqueira JF Jr, Bate AL, Pitt Ford TR. Indagine istologica di denti trattati con canale radicolare con parodontite apicale: uno studio retrospettivo su ventiquattro pazienti. J Endod 2009;35:493–502.
- Paiva SS, Siqueira JF Jr, Rôças IN, et al. Integrazione degli effetti antimicrobici del debridement chemomeccanico con irrigazione ultrasonica passiva o un risciacquo finale con clorexidina: uno studio clinico. J Endod 2012;38:1202–6.
- Byström A. Valutazione del trattamento endodontico di denti con parodontite apicale [dissertazione odontologica n. 27]. Umea, Svezia: Università di Umea; 1986.
- Vianna ME, Horz HP, Gomes BP, Conrads G. Valutazione in vivo della riduzione microbica dopo la preparazione chemomeccanica di canali radicolari umani contenenti tessuto pulpare necrotico. Int Endod J 2006;39:484–92.
- Sjögren U. Successo e fallimento in endodonzia [dissertazione odontologica n. 60]. Umea, Svezia: Università di Umea; 1996.
- Neves MA, Provenzano JC, Rôças IN, Siqueira JF Jr. Efficacia antibatterica clinica della preparazione del canale radicolare con sistemi a strumento singolo a movimento reciproco o sistemi multi-strumento a rotazione continua. J Endod 2016;42:25–9.
- Siqueira JF Jr, Rôças IN. Implicazioni cliniche e microbiologia della persistenza batterica dopo le procedure di trattamento. J Endod 2008;34:1291–13013.
- Siqueira JF Jr, Rôças IN. Ottimizzazione della disinfezione in un'unica visita con approcci supplementari: una ricerca di prevedibilità. Aust Endod J 2011;37:92–8.
- Alves FR, Almeida BM, Neves MA, et al. Disinfezione di canali radicolari a forma ovale: efficacia di diversi approcci supplementari. J Endod 2011;37:496–501.
- Tardivo D, Pommel L, La Scola B, et al. Efficacia antibatterica dell'irrigazione ultrasonica passiva rispetto all'irrigazione sonica: irrigazione ultrasonica del canale radicolare. Odontostomatol Trop 2010;33:29–35.
- Carver K, Nusstein J, Reader A, Beck M. Efficacia antibatterica in vivo dell'ultrasuono dopo strumentazione manuale e rotativa in molari mandibolari umani. J Endod 2007; 33:1038–43.
- Paiva SS, Siqueira JF Jr, Rôças IN, et al. Valutazione microbiologica molecolare dell'attivazione ultrasonica passiva come passo supplementare di disinfezione: uno studio clinico. J Endod 2013;39:190–4.
- Debelian G, Trope M. Pulizia della terza dimensione. Endodontic Practice 2015;8: 22–4.
- Leoni GB, Versiani MA, Silva-Sousa YT, et al. Valutazione ex vivo di quattro protocolli di irrigazione finale sulla rimozione di detriti di tessuto duro dal sistema del canale radicolare mesiale dei primi molari mandibolari. Int Endod J 2016 Mar 18. http://dx.doi.org/ 10.1111/iej.12630. [Epub ahead of print].
- Azim AA, Aksel H, Zhuang T, et al. Efficacia di 4 protocolli di irrigazione nell'uccisione di batteri colonizzati nei tubuli dentinali esaminati tramite un'analisi innovativa con microscopio laser confocale. J Endod 2016;42:928–34.
- Siqueira JF Jr, Alves FR, Almeida BM, et al. Capacità della preparazione chemomeccanica con strumenti rotativi o file auto-regolabili di disinfettare canali radicolari a forma ovale. J Endod 2010;36:1860–5.
- Alves FR, Siqueira JF Jr, Carmo FL, et al. Profilazione della comunità batterica di campioni macinati criogenicamente dai segmenti radicolari apicali e coronali di denti con parodontite apicale. J Endod 2009;35:486–92.
- Antunes HS, Rôças IN, Alves FR, Siqueira JF Jr. Livelli batterici totali e specifici nel sistema del canale radicolare apicale di denti con parodontite apicale post-trattamento. J Endod 2015;41:1037–42.
- Alves FR, Rôças IN, Almeida BM, et al. Analisi molecolare quantitativa e culturale dell'eliminazione batterica in canali radicolari a forma ovale tramite una tecnica di strumentazione a file singola. Int Endod J 2012;45:871–7.
- van der Sluis LW, Versluis M, Wu MK, Wesselink PR. Irrigazione ultrasonica passiva del canale radicolare: una revisione della letteratura. Int Endod J 2007;40:415–26.
- Martin H. Disinfezione ultrasonica del canale radicolare. Oral Surg Oral Med Oral Pathol 1976;42:92–9.
- Ahmad M, Pitt Ford TR, Crum LA. Debridement ultrasonico dei canali radicolari: un'analisi dei meccanismi coinvolti. J Endod 1987;13:93–101.
- Sirtes G, Waltimo T, Schaetzle M, Zehnder M. Gli effetti della temperatura sulla stabilità a breve termine dell'ipoclorito di sodio, sulla capacità di dissoluzione della polpa e sull'efficacia antimicrobica. J Endod 2005;31:669–71.
- Siqueira JF Jr, Rôças IN. Sfruttare i metodi molecolari per esplorare le infezioni endodontiche: parte 1—tecnologie molecolari attuali per la diagnosi microbiologica. J Endod 2005;31:411–23.
- McCarty SC, Atlas RM. Effetto della dimensione dell'amplicone sulla rilevazione PCR di batteri esposti al cloro. PCR Methods Appl 1993;3:181–5.
- Fouad AF, Barry J. L'effetto degli antibiotici e degli antimicrobici endodontici sulla reazione a catena della polimerasi. J Endod 2005;31:510–3.

/social-network-service/media/default/6758/89a8282e.png)