Passaggi supplementari per rimuovere i detriti di tessuto duro dai sistemi canalari contenenti isthmus
Traduzione automatica
L'articolo originale è scritto in lingua EN (link per leggerlo).
Abstract
Introduzione: Lo scopo di questo studio ex vivo era valutare la riduzione percentuale dei detriti di tessuto duro accumulati (AHTD) nel sistema canalare mesiale dei molari mandibolari sotto diversi regimi di irrigazione finale mediante imaging micro–tomografico computerizzato.
Metodi: Sono state selezionate sessanta radici mesiali curve di molari mandibolari con 2 canali indipendenti uniti apicalmente da un istmo (Vertucci tipo II). I campioni sono stati scansionati a una risoluzione di 12,5 mm, anatomicamente abbinati e distribuiti in 3 gruppi (n = 20) secondo il protocollo di preparazione: Self-Adjusting File (SAF; ReDent Nova, Ra’anana, Israele), Reciproc (VDW GmbH, Monaco, Germania) e Revo-S (Micro-Mega, Besançon, Francia). Successivamente, ogni gruppo è stato suddiviso in 2 sottogruppi (n = 10) secondo il protocollo di irrigazione finale con il sistema SAF o EndoVac (Discus Dental, Culver City, CA). Il volume percentuale e la riduzione percentuale di AHTD dopo la preparazione del canale radicolare e i protocolli di irrigazione finale sono stati confrontati statisticamente utilizzando l'analisi della varianza unidirezionale, il campione abbinato e i test t di Student indipendenti. Il livello di significatività è stato fissato al 5%.
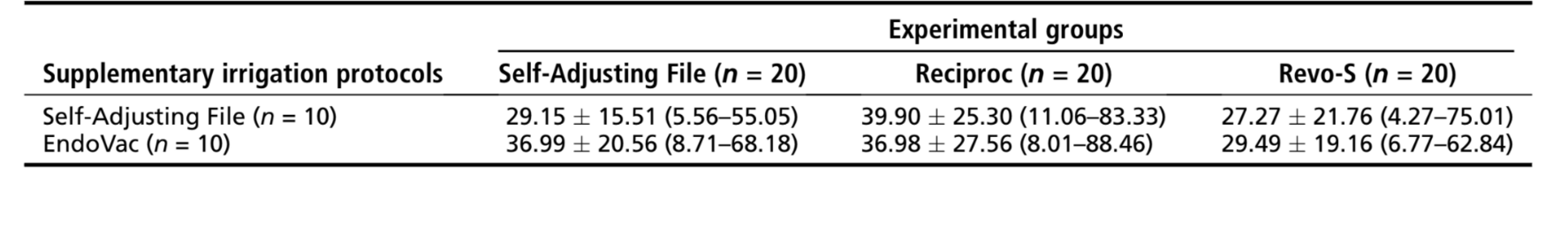
Risultati: All'interno dei gruppi, la percentuale media di volume è stata significativamente ridotta dopo le procedure di irrigazione finali sia nei sottogruppi SAF (da 1.52%– 1.78% a 1.01%–1.20%) che EndoVac (da 2.11%–2.23% a 1.31%–1.52%) (P < .05). Nei gruppi sperimentali, la riduzione percentuale media di AHTD è variata dal 29.15% al 39.90% dopo i protocolli di irrigazione, senza differenze statistiche tra i gruppi (P > .05).
Conclusioni: Nessuno degli approcci di irrigazione è riuscito a rendere il sistema canalare mesiale privo di AHTD. Una riduzione percentuale simile di AHTD è stata ottenuta dopo i protocolli di irrigazione finale utilizzando sia il sistema SAF che EndoVac. (J Endod 2016;42:1677–1682)
Il risultato del trattamento endodontico dipende dal controllo efficace dell'infezione intracanalare mediante l'uso di protocolli chemi-meccanici efficaci. Con l'avvento di strumenti rotanti e reciprocanti in nichel-titanio, sono stati superati diversi limiti delle procedure di preparazione convenzionali che potrebbero influenzare negativamente la terapia endodontica. Tuttavia, studi che utilizzano la tecnologia della microtomografia computerizzata ad alta risoluzione (micro-CT) hanno dimostrato che i detriti creati dall'azione di taglio degli strumenti sul dentina durante la preparazione meccanica possono essere imballati nelle complessità anatomiche del sistema canalare, impedendo l'azione idrodinamica del flusso dell'irrigante. Di conseguenza, le procedure di disinfezione potrebbero essere compromesse e microrganismi persistenti in queste aree potrebbero svilupparsi o mantenere la parodontite apicale.
Negli ultimi anni, sono stati fatti diversi sforzi per sviluppare approcci aggiuntivi per migliorare la disinfezione dei canali radicolari. Tra gli approcci supplementari maggiormente utilizzati per guidare gli irriganti nelle complessità anatomiche del sistema del canale radicolare ci sono i dispositivi sonici, le tecniche ultrasoniche e il sistema EndoVac (Discus Dental, Culver City, CA). Il Self-Adjusting File (SAF; ReDent Nova, Ra’anana, Israele) si è anche dimostrato efficace nella riduzione dei detriti di tessuto duro accumulati (AHTD) durante o dopo la preparazione del canale radicolare. Nonostante il fatto che studi recenti abbiano mostrato l'efficacia di questi approcci come potenziali ausili per l'irrigazione per la rimozione dei detriti dopo la preparazione del canale radicolare, manca ancora una conoscenza completa riguardo all'attivazione degli irriganti in diversi protocolli di irrigazione finale al fine di rimuovere i detriti di tessuto duro dall'area dell'istmo. Pertanto, questo ex vivo studio mirava a valutare la percentuale di riduzione dell'AHTD nei canali radicolari mesiali contenenti istmo dei molari mandibolari sotto diversi regimi di irrigazione finale mediante imaging micro-CT. L'ipotesi nulla era che non ci fosse differenza nella riduzione dell'AHTD tra i protocolli di irrigazione testati.
Materiali e Metodi
Stima della Dimensione del Campione
La dimensione del campione è stata calcolata dopo la stima della dimensione dell'effetto del volume percentuale di AHTD come riportato da Paqué et al. In quello studio, il volume percentuale di AHTD dopo la preparazione SAF era dell'1,7%. Un'analisi a priori della varianza (ANOVA) (effetti fissi, omnibus, unidirezionale) è stata selezionata dalla famiglia del test F nel software G*Power 3.1.7 per Macintosh (Heinrich Heine, Universität Düsseldorf, Düsseldorf, Germania).
Selezione dei Campioni Dentali
Dopo l'approvazione del comitato etico locale per la ricerca (protocollo n. 2013/145), sono stati ottenuti 250 radici mesiali di molari mandibolari da un pool di denti. Il sesso e l'età dei pazienti erano sconosciuti. Per prevenire l'introduzione di variabili confondenti, le radici distali sono state sezionate e i denti sono stati decoronati a ~3 mm sopra la giunzione cemento-smalto. Ogni radice mesiale è stata inizialmente ispezionata con l'ausilio di un stereomicroscopio con ingrandimento 12× e radiografata sia in direzione buccolinguale che mesiodistale per rilevare eventuali ostruzioni del canale radicolare. I criteri di inclusione comprendevano solo denti con radici mesiali con curvatura moderata (15◦– 20◦) e un'apice completamente formato. I criteri di esclusione erano trattamenti canalari precedenti e la presenza di difetti dentinali nell'aspetto esterno delle radici. Di conseguenza, sono state selezionate 160 radici mesiali e immagini separate sono state acquisite a una risoluzione isotropica di 12,5 mm utilizzando un dispositivo micro-CT (SkyScan 1172; Bruker-microCT, Kontich, Belgio). I parametri dello scanner erano impostati a 80 kV, 124 mA, rotazione di 180◦ attorno all'asse verticale, un passo di rotazione di 0,48◦ e un tempo di esposizione della camera di 620 millisecondi utilizzando un filtro in alluminio spesso 0,5 mm. Successivamente, sono state selezionate 60 radici mesiali moderatamente curve e completamente formate di molari mandibolari con 2 canali indipendenti uniti apicalmente da un istmo (configurazione di tipo II di Vertucci).
Le immagini di proiezione acquisite sono state ricostruite (software NRecon v.1.6.9, Bruker-microCT), con un'acquisizione di 1000 a 1200 sezioni trasversali per radice. Il volume di interesse è stato selezionato estendendosi dal livello di furcazione all'apice, impostato dall'integrazione di tutte le sezioni trasversali. Ai fini di questo studio, la regione di interesse in ciascuna sezione comprendeva l'area dei canali mesiali e l'istmo. Modelli tridimensionali preoperatori dei sistemi canalari radicolari mesiali sono stati resi (CTVol v.2.2.1, Bruker micro-CT), e i parametri morfologici dell'area dell'istmo (lunghezza, volume e area superficiale) e dell'intero sistema canalare radicolare (volume e area superficiale) sono stati calcolati (software CTAn v.1.14.4, Bruker-microCT). Con l'obiettivo di migliorare la validità interna dell'esperimento, i canali mesiali sono stati abbinati per creare 20 gruppi di 3 basati sugli aspetti morfologici del canale. Successivamente, 1 radice di ciascun gruppo è stata assegnata casualmente a 1 dei 3 gruppi sperimentali (n = 20) secondo il protocollo di preparazione: sistemi SAF, Reciproc (VDW GmbH, Monaco, Germania) e Revo-S (Micro-Mega, Besançon, Francia). Dopo aver verificato l'assunzione di normalità (test di Shapiro-Wilk) e l'uguaglianza delle varianze (test di Levene), è stata confermata la misura di omogeneità (baseline) dei gruppi rispetto a ciascuno dei parametri morfologici (test AN-OVA unidirezionale, P > .05) (Tabella 1).
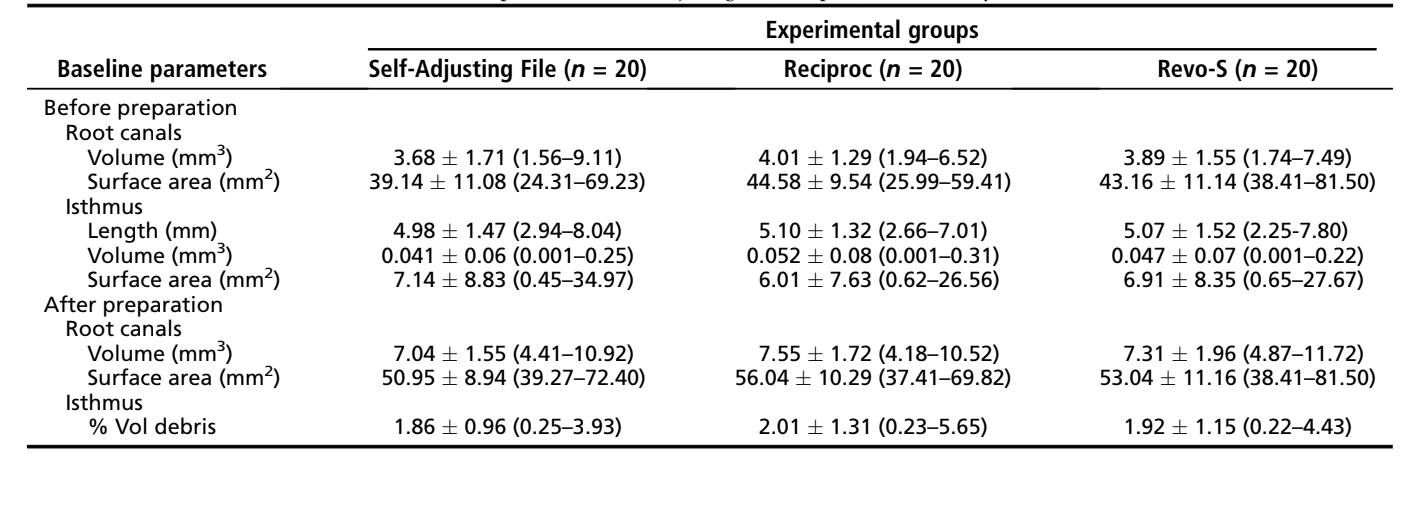
Preparazione del Canale Radicolare
Dopo che le apici delle radici mesiali sono state sigillate con resina epossidica a rapida indurimento per creare un sistema a fondo chiuso, sono stati accessibili i canali e il terzo coronale è stato progressivamente allargato con frese Gates Glidden di dimensioni 2 e 3 (Dentsply Maillefer, Baillagues, Svizzera), seguito da irrigazione con 3 mL di ipoclorito di sodio al 2,5% (NaOCl). La pervietà è stata confermata inserendo un K-file di dimensione 10 (Dentsply Maillefer) attraverso il forame apicale prima e dopo il completamento della preparazione del canale. Per tutti i gruppi, è stato creato un percorso di scorrimento esplorando un K-file in acciaio inossidabile di dimensione 15 (Dentsply Maillefer) fino alla lunghezza di lavoro (WL), stabilita sottraendo 1 mm dalla lunghezza del canale. Successivamente, i canali radicolari in ciascun gruppo sono stati preparati secondo i seguenti protocolli (Fig. 1):
- Il sistema SAF (n = 20): Uno strumento SAF di 1,5 mm è stato utilizzato con una testa RDT3-NX (ReDent Nova) adattata a un manipolo a bassa velocità (NSK, Tokyo, Giappone) operante a 5000 rpm per 4 minuti. Il SAF è stato gradualmente inserito nel canale e utilizzato fino alla WL con un movimento a picchiettare. Irrigazione continua a un flusso di 5 mL/min con NaOCl al 2,5% è stata applicata durante tutta la procedura utilizzando un apparecchio di irrigazione speciale (VATEA, ReDent-Nova).
- Il sistema Reciproc (n = 20): Lo strumento R25 (dimensione 25, 0,08 di taper nei primi 3 mm) è stato introdotto nel canale fino a quando non si è sentita resistenza e poi attivato in movimento reciproco utilizzando il motore VDW Silver (VDW GmbH). Lo strumento è stato spostato lentamente in direzione apicale utilizzando un delicato movimento a picchiettare di circa 3 mm di ampiezza. Dopo 3 movimenti a picchiettare, lo strumento è stato rimosso dal canale e pulito. Ogni volta che lo strumento Reciproc veniva rimosso, sono stati applicati 2 mL di NaOCl al 2,5% utilizzando un ago a punta chiusa da 27-G adattato a una siringa di plastica monouso e posizionato 1 mm prima della WL.
- Il sistema Revo-S (n = 20): Gli strumenti rotanti in nichel-titanio Revo-S SC1 (dimensione 25, 0,06 di taper), SC2 (dimensione 25, 0,04 di taper) e SU (dimensione 25, 0,06 di taper) sono stati utilizzati a 300 rpm in modo crown-down fino alla WL utilizzando un delicato movimento a picchiettare in entrata e uscita. L'irrigazione ha seguito lo stesso protocollo del gruppo Reciproc.
In tutti i gruppi, la preparazione è stata completata in 4 minuti utilizzando un totale di 20 mL di NaOCl al 2,5% per canale. Dopo la preparazione, è stata eseguita un'irrigazione finale con 5 mL di EDTA al 17% (pH = 7,7) somministrata a una velocità di 1 mL/min per 5 minuti, seguita da un'irrigazione di 5 minuti con 5 mL di acqua bidistillata in ciascun canale, con la punta dell'ago da 27-G posizionata 1 mm prima della lunghezza di lavoro (WL). Successivamente, i canali sono stati leggermente asciugati con punti di carta assorbente e le radici sottoposte a una nuova scansione, applicando le impostazioni dei parametri precedentemente menzionate (Fig. 1).
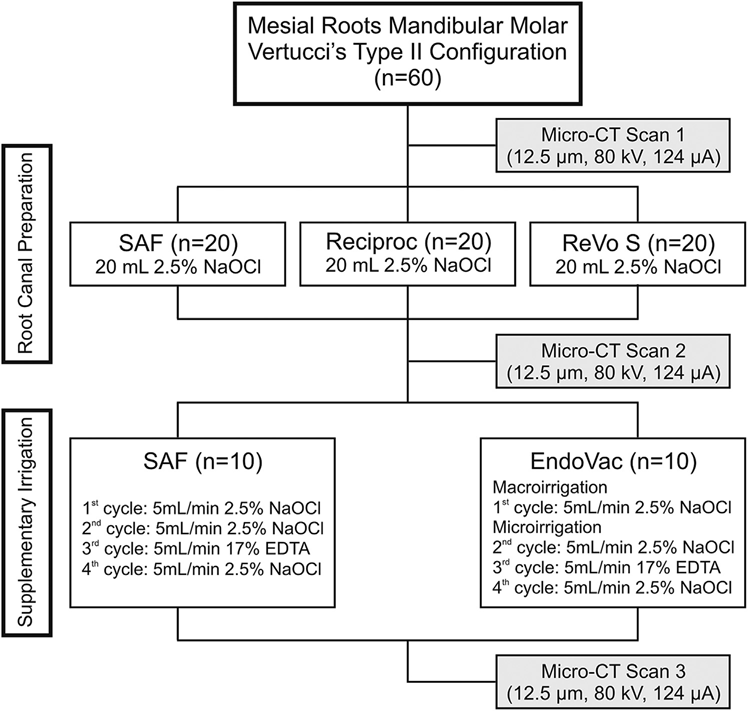
Le scansioni postoperatorie sono state coregistrate con i rispettivi set di dati preoperatori utilizzando il modulo di registrazione rigida del software 3D Slicer 4.3.1 (disponibile su http://www.slicer.org). La quantificazione dell'AHTD è stata eseguita mediante la differenza tra lo spazio del canale radicolare non preparato e quello preparato utilizzando procedure di post-elaborazione con il software Fiji (Fiji v.1.47n; Fiji, Madison, WI). La sequenza di immagini risultante da questa operazione è stata ulteriormente utilizzata per identificare l'AHTD mediante operazioni morfologiche (Fig. 2) come descritto in dettaglio altrove. La presenza di un materiale con densità simile a quella della dentina in regioni precedentemente occupate dall'aria nello spazio del canale radicolare non preparato è stata considerata detrito e quantificata mediante l'intersezione tra le immagini prima e dopo l'istrumentazione del canale. Il volume totale di AHTD è stato calcolato in millimetri cubici (mm3) ed espresso come percentuale del volume totale del sistema canalare dopo la preparazione (%vol) (Tabella 1).
Per le prossime procedure sperimentali, è stata adattata una banda automatrix trasparente in plastica alla parte coronale delle radici. Successivamente, i campioni sono stati abbinati in coppie in ciascun gruppo rispetto al %vol di AHTD acquisito nella scansione post-preparazione, e 1 radice di ciascuna coppia è stata assegnata casualmente a 1 dei 2 sottogruppi (n = 10) secondo il seguente protocollo di irrigazione supplementare (Fig. 1):
- Il sistema SAF (n = 10): I canali radicolari sono stati irrigati in 4 cicli di 60 secondi utilizzando uno strumento SAF da 1,5 mm collegato all'apparato di irrigazione VATEA. Nel primo ciclo, il SAF è stato inserito fino alla WL e mosso su e giù con un flusso continuo di irrigante NaOCl al 2,5% a una velocità di flusso di 5 mL/min. Dopo di che, il SAF è stato rimosso dal canale e l'irrigante è stato lasciato indisturbato per 60 secondi. Questo ciclo è stato ripetuto. Poi, nei terzi e quarti cicli, il SAF è stato utilizzato con irrigazione continua di 5 mL/min di EDTA al 17% (pH = 7,7) e 5 mL/min di NaOCl al 2,5%, rispettivamente.
- Il sistema EndoVac (n = 10): I canali radicolari sono stati irrigati in 4 cicli di 60 secondi utilizzando il sistema EndoVac. Nel primo ciclo, è stata effettuata una macroirrigazione con 5 mL di NaOCl al 2,5% utilizzando una macrocannula inserita nel canale e mossa su e giù da un punto dove si appoggiava alle pareti del canale. Poi, l'irrigante è stato lasciato indisturbato per 60 secondi. Dopo di che, sono seguiti 3 cicli di microirrigazione. La microcannula è stata inserita 1 mm prima della WL e mantenuta per 60 secondi, mentre 5 mL di irrigante venivano costantemente reintegrati. La microcannula è stata rimossa e l'irrigante è stato lasciato indisturbato per 60 secondi. Nei successivi 2 cicli di microirrigazione, sono stati utilizzati rispettivamente 5 mL/min di EDTA al 17% (pH = 7,7) e 5 mL/min di NaOCl al 2,5%.
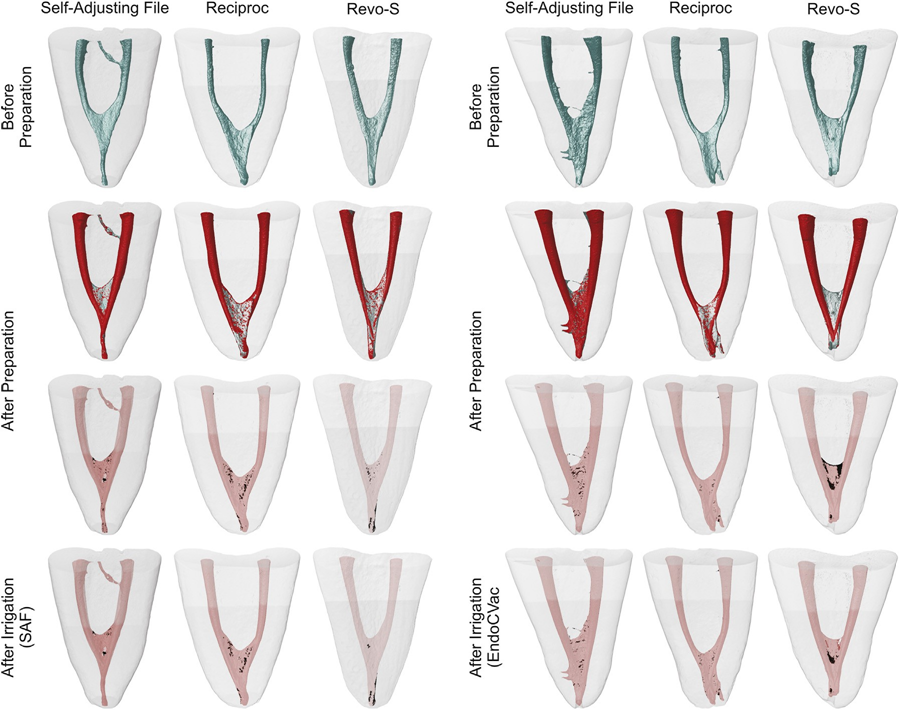
Dopo le procedure di irrigazione supplementari, i canali sono stati leggermente asciugati con punti di carta assorbente e è stata eseguita una scansione finale (Fig. 1). I set di dati sono stati registrati con i rispettivi controparte e il %vol di AHTD in ciascun canale è stato calcolato. Successivamente, è stata ottenuta la riduzione percentuale (%red) dell'AHTD secondo la seguente formula: 100 — ([VAF × 100]/VBF), dove VBF e VAF sono il volume di AHTD prima e dopo i protocolli di irrigazione, rispettivamente. Modelli di canali radicolari codificati a colori (colori verde e rosso che indicano le superfici del canale pre e post-operatorie, rispettivamente) e detriti (in colore nero) hanno consentito un confronto qualitativo dei canali radicolari abbinati prima e dopo le procedure sperimentali.
Analisi Statistica
I dati erano distribuiti normalmente (test di Shapiro-Wilk) e omoscedastici (test di Levene). Pertanto, i risultati sono stati espressi come media e deviazione standard e confrontati tra i gruppi utilizzando l'ANOVA a 1 via e all'interno del gruppo mediante campioni appaiati e test t di Student indipendenti, con un livello di significatività fissato al 5% (SPSS v17.0; SPSS Inc, Chicago, IL).
Risultati
La stima della dimensione del campione ha mostrato che 9 campioni per gruppo erano indicati come la dimensione ideale del campione (errore di tipo alfa <0.05 e potenza beta del 99%). Pre- e post-operatoriamente, il grado di omogeneità (baseline) dei gruppi e sottogruppi è stato confermato riguardo ai parametri morfologici analizzati dei canali radicolari così come il % vol di AHTD dopo la preparazione (P > .05) (Tabella 1).
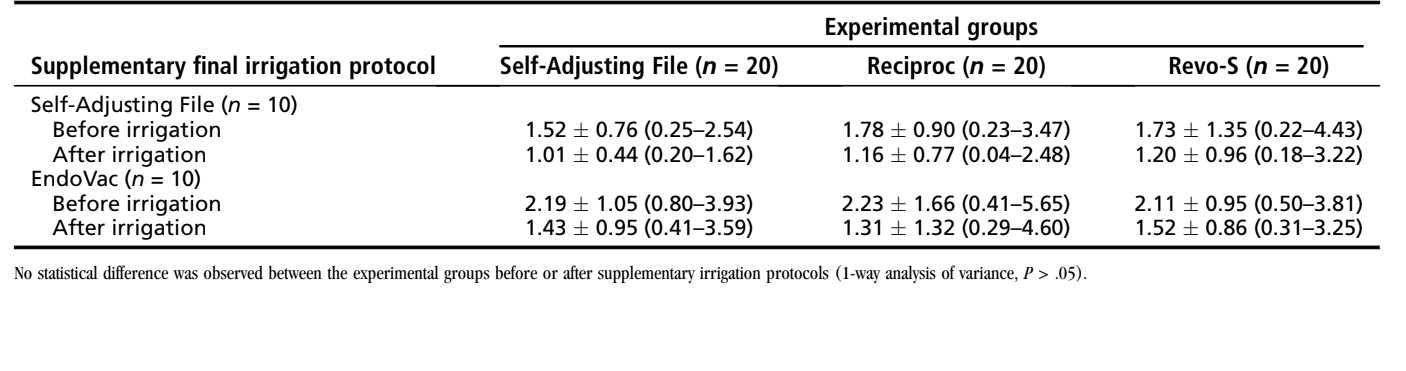
Il % vol medio e il % rosso di AHTD valutati prima e dopo le procedure di irrigazione supplementari sono dettagliati in Tabelle 2 e 3, rispettivamente. All'interno dei gruppi, il % vol medio di AHTD è stato significativamente ridotto dopo le procedure di irrigazione finale con i sistemi SAF (da 1.52%–1.78% a 1.01%–1.20%) o EndoVac (da 2.11%–2.23% a 1.31%–1.52%) (P < .05) (Tabella 2). In generale, il % rosso medio di AHTD variava dal 29.15%–39.90% senza differenze statistiche tra i gruppi sperimentali (P > .05) (Tabella 3). Pertanto, l'ipotesi nulla è stata confermata. Modelli tridimensionali di canali radicolari mesiali rappresentativi in ciascun gruppo sperimentale mostrano la distribuzione dell'AHTD dopo la preparazione chimico-meccanica e i protocolli di irrigazione supplementari (Fig. 3). In generale, i detriti residui dopo i protocolli di irrigazione finale sono stati osservati principalmente nel terzo apicale e nell'area dell'istmo.
Discussione
In generale, il debridement del canale radicolare è stato valutato mediante metodi convenzionali come il sezionamento delle radici, la microscopia elettronica a scansione e l'istologia. Più recentemente, la tecnologia micro-CT non distruttiva è stata utilizzata come strumento preciso per la valutazione quantitativa tridimensionale dei detriti di tessuto duro accumulati nelle recessi durante la preparazione del canale. Le evidenze di questi studi indicano che le particelle di dentina tagliate dalle pareti del canale dagli strumenti endodontici possono essere attivamente imballate nelle complessità anatomiche del sistema canalare, diventando più resistenti alla rimozione. Nonostante sia difficile trarre conclusioni affidabili dalla letteratura riguardo al protocollo di irrigazione più efficace per superare questo problema, esiste un accordo generale sui benefici dell'attivazione dell'irrigante durante e dopo le procedure di preparazione. Complessivamente, studi precedenti hanno dimostrato che l'uso di approcci di irrigazione supplementari dopo la preparazione del canale porta a meno detriti all'interno delle complessità del sistema canalare, come mostrato nello studio presente.
Il SAF è uno strumento cavo in nichel-titanio a forma di reticolo che pulisce le pareti del canale mediante vibrazioni verticali e consente un'irrigazione simultanea e continua durante la preparazione meccanica del canale radicolare. Ad oggi, solo 2 studi hanno tentato di quantificare il volume di detriti di tessuto duro accumulati nell'area dell'istmo delle radici mesiali dei molari mandibolari dopo l'uso del sistema SAF. In uno di essi, il SAF è stato utilizzato come strumento di finitura dopo la preparazione del canale radicolare e ha lasciato il 4,3% del volume del canale riempito con AHTD. Questo risultato era più del doppio rispetto a quanto riportato da Paqué et al e ai risultati trovati nel presente studio, ma può essere spiegato perché il protocollo del SAF è stato modificato e applicato per solo 1 minuto in ciascun canale per equalizzare i gruppi sperimentali in termini di tempo di preparazione e quantità di irrigante. Pertanto, si potrebbe consigliare che gli studi che utilizzano il SAF come passo supplementare per la pulizia del canale radicolare seguano il suo protocollo completo, come utilizzato qui. Tuttavia, nonostante il fatto che il SAF si sia dimostrato efficiente come potenziale ausilio per l'irrigazione nella rimozione dei detriti, deve essere sottolineato che questo strumento non è in grado di rimuovere tutto il contenuto di AHTD dal canale perché durante il suo utilizzo continua a pulire le pareti del canale, producendo più detriti dentinali. Inoltre, sebbene il SAF si conformi alla forma del canale, non può entrare nell'area dell'istmo. Di conseguenza, la sua efficacia nel presente studio può essere attribuita al flusso continuo con un irrigante fresco e completamente attivo sostituito.
Il sistema EndoVac comprende un diverso regime di irrigazione che coinvolge la pressione negativa apicale e utilizza una punta master per somministrare ed evacuare l'irrigante contemporaneamente a livello della camera pulpare, mentre microcannule vengono utilizzate in profondità nel canale. Nella letteratura, il confronto degli effetti di pulizia e disinfezione tra EndoVac e irrigazione convenzionale ha raggiunto risultati inconcludenti. Sebbene alcuni studi abbiano mostrato una superiore eliminazione batterica e una migliore pulizia utilizzando il sistema EndoVac, altri autori non hanno trovato differenze significative tra queste tecniche. Recentemente, 2 studi hanno valutato l'efficacia di EndoVac nell'eliminare i detriti di tessuto duro accumulati nei canali radicolari mesiali contenenti istmo dei molari mandibolari. È stato riportato che la percentuale mediana di volume di AHTD è stata ridotta al 2,12% e al 3,4% dopo aver utilizzato il sistema EndoVac come protocollo finale di irrigazione, il che è in accordo con i risultati presenti. Tuttavia, è importante sottolineare che la configurazione del canale radicolare dei campioni selezionati qui e in quegli studi (tipo II di Vertucci) può favorire l'efficacia del sistema EndoVac rispetto ad altri approcci di irrigazione. In questo tipo di configurazione in cui i canali radicolari sono collegati da un istmo, l'azione di lavaggio meccanico di EndoVac produce un flusso di corrente dell'irrigante verso il terzo apicale in entrambi i canali radicolari simultaneamente. Di conseguenza, questo flusso costante di irrigante può spostare i detriti di tessuto duro dall'area dell'istmo favorendone la rimozione, il che può spiegare questi risultati.
Sebbene un protocollo di irrigazione finale con SAF e EndoVac abbia portato a una significativa riduzione del contenuto di detriti, che può essere tradotto in una migliore pulizia del sistema canalare, la sua rilevanza clinica rimane poco chiara, e sono necessari ulteriori studi per valutare il suo impatto sul tasso di successo del trattamento canalare. Vale anche la pena menzionare che i gruppi sperimentali in questo studio differivano non solo nel modo di somministrazione dell'irrigante ma anche nel protocollo di somministrazione; il sistema EndoVac somministra l'irrigante nella camera pulpare e non nel sistema canalare. Tuttavia, queste differenze non sembravano influenzare negativamente i risultati, probabilmente a causa dell'approccio di distribuzione del campione utilizzato qui, che si basava sugli aspetti morfologici sia dei canali radicolari che dell'area dell'istmo (Tabella 1). Questo passaggio metodologico è fondamentale per ridurre i potenziali significativi pregiudizi anatomici che potrebbero interferire con i risultati, migliorando la validità interna dell'esperimento.
Nonostante i risultati di questo studio rivelino che i protocolli di irrigazione aggiuntivi con i sistemi SAF o EndoVac non siano riusciti a rendere il sistema canalare radicolare mesiale contenente istmo dei molari mandibolari privo di AHTD, è stata dimostrata la loro efficacia nella riduzione dei detriti creati dagli strumenti durante le procedure di pulizia e modellamento.
Autori: Ali Keleş, Hatice Alçin, Manoel D. Sousa-Neto, Marco A. Versiani
Riferimenti:
Siqueira JF Jr, Alves FRF, Versiani MA, et al. Analisi batteriologica e micro–tomografica correlativa dei canali mesiali dei molari mandibolari preparati con i sistemi Self-Adjusting File, Reciproc e Twisted File. J Endod 2013;39:1044–50.
Siqueira JF Jr. Reazione dei tessuti periradicolari al trattamento canalare: benefici e svantaggi. Endod Topics 2005;10:123–47.
Hülsmann M, Peters OA, Dummer PMH. Preparazione meccanica dei canali radicolari: obiettivi di modellamento, tecniche e mezzi. Endod Topics 2005;10: 30–76.
Versiani MA, Pécora JD, Sousa-Neto MD. Preparazione del canale radicolare flat-oval con strumento a file auto-regolante: uno studio di micro-tomografia computerizzata. J Endod 2011;37: 1002–7.
De-Deus G, Marins J, Silva EJ, et al. Accumulo di detriti duri prodotti durante la preparazione canalare rotativa e reciprocante in nichel-titanio. J Endod 2015;41: 676–81.
De-Deus G, Roter J, Reis C, et al. Valutazione dei detriti duri accumulati utilizzando micro-tomografia computerizzata e software gratuito per l'elaborazione e l'analisi delle immagini. J Endod 2014;40:271–6.
Freire LG, Iglecias EF, Cunha RS, et al. Valutazione micro-tomografica della rimozione dei detriti duri dopo diversi metodi di irrigazione e la loro influenza sul riempimento dei canali curvi. J Endod 2015;41:1660–6.
Paqué F, Al-Jadaa A, Kfir A. Accumulo di detriti duri creato dall'istrumentazione rotativa convenzionale rispetto a quella con file auto-regolanti nei sistemi canalari mesiali dei molari mandibolari. Int Endod J 2012;45:413–8.
Paqué F, Boessler C, Zehnder M. Livelli di detriti duri accumulati nelle radici mesiali dei molari mandibolari dopo fasi di irrigazione sequenziali. Int Endod J 2011; 44:148–53.
Paqué F, Laib A, Gautschi H, Zehnder M. Analisi dell'accumulo di detriti duri tramite scansioni di tomografia computerizzata ad alta risoluzione. J Endod 2009;35: 1044–7.
Paqué F, Peters OA. Valutazione micro-tomografica della preparazione di canali radicolari lunghi ovali nei molari mandibolari con il file auto-regolante. J Endod 2011;37:517–21.
Paqué F, Rechenberg DK, Zehnder M. Riduzione dell'accumulo di detriti duri durante l'istrumentazione canalare rotativa mediante acido etidronico in un irrigante a base di ipoclorito di sodio. J Endod 2012;38:692–5.
Versiani MA, Alves FRF, Andrade Junior CV, et al. Valutazione micro-CT dell'efficacia della rimozione di tessuti duri dall'area del canale radicolare e dell'istmo mediante sistemi di irrigazione a pressione positiva e negativa. Int Endod J. 2015 Oct 13. http://dx.doi.org/10.1111/iej.12559. [Epub ahead of print].
Ricucci D, Siqueira JF Jr, Bate AL, Pitt Ford TR. Indagine istologica di denti trattati canalari con parodontite apicale: uno studio retrospettivo su ventiquattro pazienti. J Endod 2009;35:493–502.
Siqueira JF Jr, Rôças IN. Ottimizzazione della disinfezione in un'unica visita con approcci supplementari: una ricerca di prevedibilità. Aust Endod J 2011;37:92–8.
Adorno CG, Fretes VR, Ortiz CP, et al. Confronto di due sistemi a pressione negativa e irrigazione con siringa per l'irrigazione canalare: uno studio ex vivo. Int Endod J 2016; 49:174–83.
Leoni GB, Versiani MA, Silva Sousa YT, et al. Valutazione ex vivo di quattro protocolli di irrigazione finale sulla rimozione di detriti duri dal sistema canalare mesiale dei molari mandibolari di prima classe. Int Endod J. 2016 Mar 18. http://dx.doi.org/ 10.1111/iej.12630. [Epub ahead of print].
Susin L, Liu Y, Yoon JC, et al. Efficacia della detersione del canale e dell'istmo di due tecniche di agitazione dell'irrigante in un sistema chiuso. Int Endod J 2010;43: 1077–90.
Tay FR, Gu LS, Schoeffel GJ, et al. Effetto del blocco di vapore sulla detersione del canale radicolare utilizzando un ago a ventilazione laterale per la somministrazione di irrigante a pressione positiva. J Endod 2010;36: 745–50.
Haapasalo M, Shen Y, Wang Z, Gao Y. Irrigazione in endodonzia. Br Dent J 2014;216: 299–303.
Gu LS, Kim JR, Ling J, et al. Revisione delle tecniche e dei dispositivi di agitazione degli irriganti contemporanei. J Endod 2009;35:791–804.
Nusstein JM. Irrigazione sonica e ultrasonica. In: Bettina B, ed. Irrigazione Endodontica: Disinfezione Chimica del Sistema Canalare. Basilea, Svizzera: Springer; 2015:173–98.
Metzger Z, Teperovich E, Zary R, et al. Il file auto-regolante (SAF). Parte 1: rispetto dell'anatomia del canale radicolare—un nuovo concetto di file endodontiche e la sua implementazione. J Endod 2010;36:679–90.
Versiani MA, Pécora JD, Sousa-Neto MD. Analisi micro-tomografica della morfologia del canale radicolare dei canini mandibolari a radice singola. Int Endod J 2013;46: 800–7.


